甲状腺球蛋白抗体与分化型甲状腺癌131I 治疗效果的关系研究
2021-02-15南楠鲜于志群赵明朱小华
南楠 鲜于志群 赵明 朱小华
华中科技大学同济医学院附属同济医院核医学科, 武汉 430030
南楠作者现单位浙江省宁波市第一医院核医学科 315010
分化型甲状腺癌(DTC)是最常见的内分泌系统恶性肿瘤,且发病率呈逐年迅速上升的趋势。甲状腺球蛋白(thyroglobulin, Tg)是DTC 患者随访时主要的血清肿瘤标志物,可监测治疗后肿瘤是否复发或转移[1]。高滴度甲状腺球蛋白抗体(thyroglobulin antibody, TgAb)会影响Tg 水平测定的准确性,亦会降低Tg 作为肿瘤标志物的灵敏度[2]。关于TgAb阳性患者治疗后如何进行病情监测是临床工作中的一个难点问题。既往有研究者认为,TgAb 可作为一种DTC 替补肿瘤标志物[3],TgAb 阳性患者远期肿瘤复发或转移的概率增加[4-5]。也有研究者认为,TgAb 变化趋势较单一静态TgAb 水平对DTC 患者的病情监测更具意义[6-7]。目前的研究多针对TgAb与肿瘤远期复发或转移的关系,而对于治疗后早期疾病状态与TgAb 的关系研究较少。本研究旨在探讨DTC 患者术后131I 治疗前、后TgAb 水平的变化趋势对131I 治疗效果的预测价值。
1 资料与方法
1.1 研究对象
回顾性分析2016 年12 月至2018 年5 月在华中科技大学同济医学院附属同济医院核医学科就诊的95 例DTC 患者的临床资料,其中男性16 例、女性79 例,年龄11~63(37.74±11.27)岁,随访时间6~20 个月。纳入标准:(1)接受双侧甲状腺全切术,并根据术前淋巴结转移评估结果进行中央区淋巴结清扫及选择性颈侧区淋巴结清扫;(2)具备详细的组织病理学检查资料;(3)首次行131I 清甲或清甲及清灶治疗;(4)术后131I 治疗前TgAb 阳性(TgAb>60 U/mL);(5)131I 治疗后定期规律随访,具有完整的131I 全身显像或其他影像学检查结果和血清学检查结果;(6)随访至少6 个月,并判断疗效。排除标准:(1)手术方式为甲状腺部分切除或未进行淋巴结清扫;(2)131I 治疗后未规律随访;(3)血清Tg、TgAb 水平检测未采用同一种方法。
所有患者在治疗前均签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
1.2 研究方法
1.2.1131I 治疗方法
患者131I 清甲或清甲及清灶治疗准备和方案均参照《131I 治疗分化型甲状腺癌指南(2014 版)》[8]及美国甲状腺协会(American Thyroid Association,ATA)指南[1]。所有患者均在术后2~6 个月进行131I治疗。根据患者清甲治疗前的血清学检查、2 h 及24 h 摄碘率测定、影像学检查及组织病理学检查结果综合评估残留甲状腺的大小及是否存在远处和(或)淋巴结转移。结合治疗前的评估结果给予不同剂量的131I 治疗。131I 清甲治疗剂量为3.7×103MBq,131I 清甲及清灶治疗剂量为5.55×103MBq。
1.2.2 主要仪器
Tg 的检测使用美国罗氏公司Roche Cobas e411全自动电化学发光免疫分析仪,检测范围0.04~500 ng/mL。TgAb 水平的检测使用德国西门子公司ADVIA Centaur 自动化学发光免疫分析仪,检测范围15~500 U/mL,超出测定范围分别记作15、500 U/mL。TgAb 正常值<60 U/mL。
1.2.3 疗效评价及分组
131I 治疗后的DTC 患者均定期复查,复查的首次时间为治疗后1.5 个月,之后每隔2~3 个月复查一次。复查项目包括血清学检查(TSH、刺激性Tg、TgAb 水平)、影像学检查[颈部超声、胸部CT、131I全身显像(131I-whole body scan,131I-WBS)等]。根据ATA 指南中DTC 治疗反应评估体系[9],参考复查时DTC 患者的影像学表现,将131I 治疗效果评估为以下3 种。(1)影像学表现满意: 影像学结果证实无疾病存在的临床表现,诊断性全身显像(diagnostic whole body scan, Dx-WBS)未见异常摄碘灶和(或)颈部超声始终无异常表现。(2)影像学表现不满意:有持续存在的或出现新增的颈部淋巴结转移灶和(或)远处转移灶,包括颈部超声检查(≥2 次随访)提示有异常淋巴结[10],131I-WBS 显像存在异常摄碘灶,手术或穿刺活检结果证实的淋巴结转移病灶。(3)影像学表现不确切:存在不能判定良恶性的影像学表现,包括颈部超声检查提示有非特异性淋巴结且在131I-WBS 时表现为不摄碘,Dx-WBS 示残留甲状腺。根据以上影像学疗效评估结果将95 例患者分为3 组:影像学表现满意组(A 组)54 例、影像学表现不满意组(B 组)19 例、影像学表现不确切组(C 组)22 例。
1.2.4 观察指标
观察A、B、C 组患者的年龄、性别、肿瘤的组织病理学特征、是否合并桥本甲状腺炎、131I 治疗距离手术的天数、2 h 和(或)24 h 摄碘率、131I 治疗剂量、131I 治疗前TSH 水平、131I 治疗前TgAb 水平和131I 治疗后1.5、3~6、6~12 个月的TgAb 变化率及变化速率等指标,分析131I 治疗后TgAb 变化率和变化速率与疗效的关系,以及影响131I 治疗疗效的因素。以治疗前TgAb 水平和治疗后1.5、3~6 个月TgAb 变化率绘制ROC 曲线,确定其预测疗效的最佳临界值及其诊断效能。
TgAb 变化率=( TgAb治疗前-TgAb治疗后) /TgAb治疗前×100%
TgAb 变化速率=(TgAb治疗前-TgAb治疗后)/(复查时间-治疗时间)×100%
1.3 统计学分析
应用SPSS 20.0 软件对数据进行统计学分析。符合正态分布的计量资料以±s表示,不符合正态分布的以M(P25~P75)表示,计数资料以绝对数(构成比)表示。计量资料的年龄、摄碘率的组间比较采用方差分析,肿瘤大小、距离手术的天数、TSH水平、治疗前TgAb 水平、治疗后TgAb 的变化率及变化速率的组间比较采用Kruskal-Wallis 秩和检验;计数资料的性别、肿瘤组织病理学特征、131I 剂量的比较采用卡方检验或Fisher 确切概率法。对单因素分析中有统计学意义的变量采用多因素Logistic回归分析,由于变量间存在明显的多重共线性,因此采用逐步回归的方法进行变量选择,确定最终的回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组DTC 患者临床及病理资料的比较
由表1 可知,A 组患者的年龄较B、C 组更大(F=3.48,P=0.03),淋巴结转移率更低(χ2=10.28,P<0.01),性别及其他病理基线资料3 组间 的差异均无统计学意义(均P>0.05)。
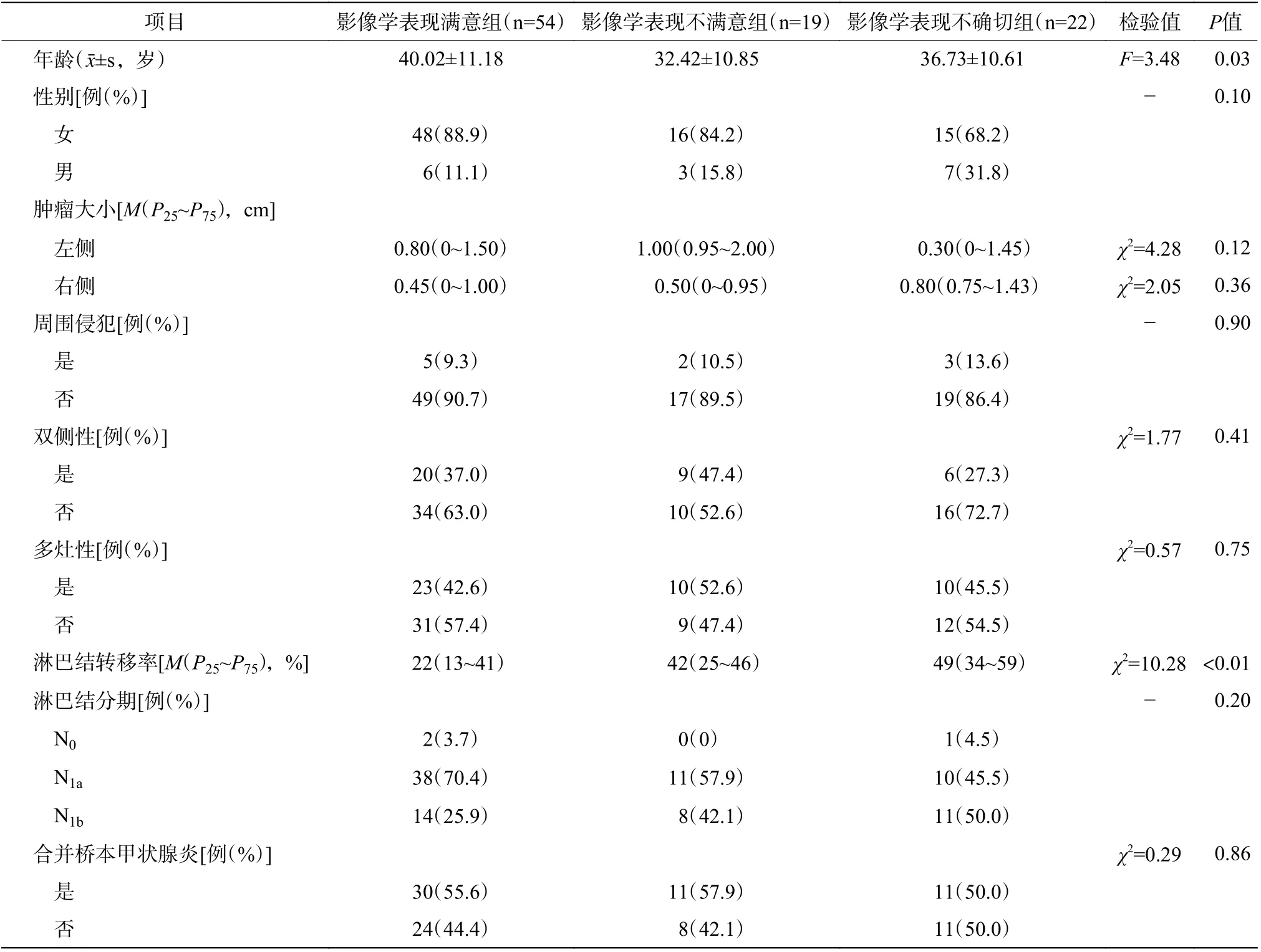
表1 3 组分化型甲状腺癌患者的临床及病理资料比较Table 1 Comparison of clinical and pathological data between the three groups of differentiated thyroid carcinoma patients
2.2 131I 治疗后TgAb 变化率和变化速率与疗效的关系
由表2 可知,131I 治疗后A、B、C 组DTC患者除治疗后6~12 个月的TgAb 变化速率外,在治疗后1.5、3~6、6~12 个月复查时的TgAb 变化率及变化速率的差异均有统计学意义(均P<0.05)。A 组的TgAb 变化率和变化速率均明显高于B 组。131I 治疗后TgAb 水平持续上升者有5 例,其中B 组3 例(15.8%)、C 组2 例(9.1%);其余90 例患者TgAb 水平均呈下降趋势或保持不变。

表2 3 组分化型甲状腺癌患者131I 治疗后TgAb 变化率和变化速率的比较[M(P25~P75) , %]Table 2 Comparison of percent change and rate of change of thyroglobulin antibody between the three groups of differentiated thyroid carcinoma patients[ M ( P25~P75) , %]
2.3 影响131I 治疗效果的因素
由表3 可知,131I 治疗前3 组DTC 患者的TgAb水平的差异有统计学意义(P<0.01),其中A 组治疗前的TgAb 水平明显低于B 组和C 组。多因素Logistic 回归分析结果显示,131I 治疗前TgAb 水平( β=-0.006,OR=0.994,P<0.01)和治疗后1.5 个月TgAb 变化率( β=0.327,OR=1.387,P=0.046)、3~6个月TgAb 变化率( β=2.521,OR=12.439,P=0.041)可能为131I 治疗效果的独立影响因素(表4)。
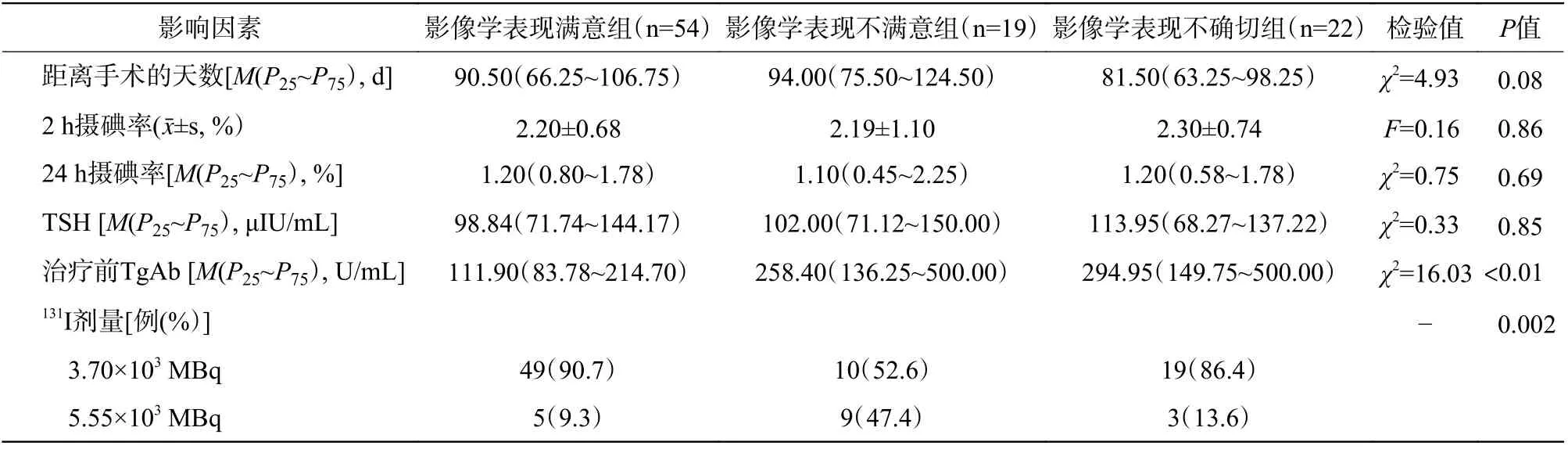
表3 3 组分化型甲状腺癌患者 131I 治疗效果的影响因素Table 3 Affecting factors of 131I therapeutic effect between the three groups of differentiated thyroid carcinoma patients
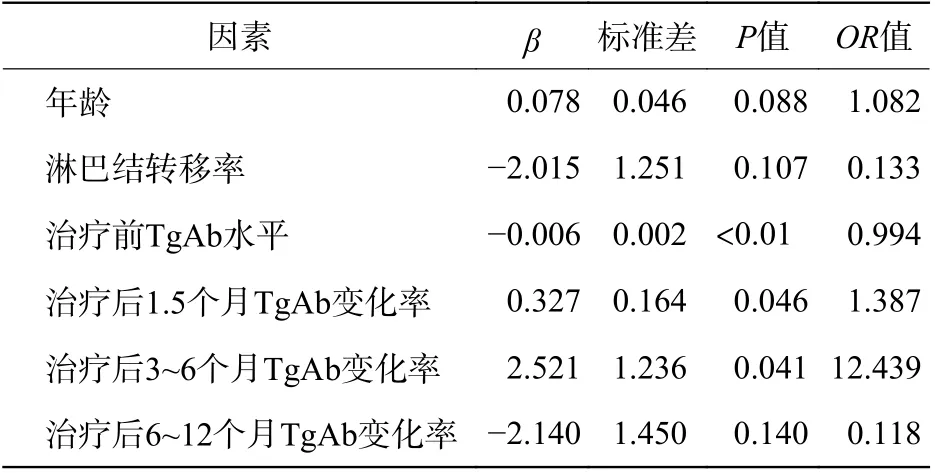
表4 3 组分化型甲状腺癌患者 131I 治疗效果的多因素Logistic回归分析Table 4 The multivariate Logistic regression analysis of 131I therapeutic effect between the three groups of differentiated thyroid carcinoma patients
2.4 131I 治疗前TgAb 水平及治疗后TgAb 变化率的诊断效能
ROC 曲线分析结果表明,131I 治疗前TgAb 水平预测131I 疗效的最佳临界值为201.4 U/mL,其灵敏度、特异度和曲线下面积(AUC)分别为74.1%、68.3%和0.740;治疗后1.5 个月及3~6 个月TgAb 变化率预测疗效的最佳临界值分别为9.7%和19.2%,其灵敏度、特异度、曲线下面积分别为72.2%、61.0%、0.660 和87.0%、58.5%、0.752。其他具体数据见表5。
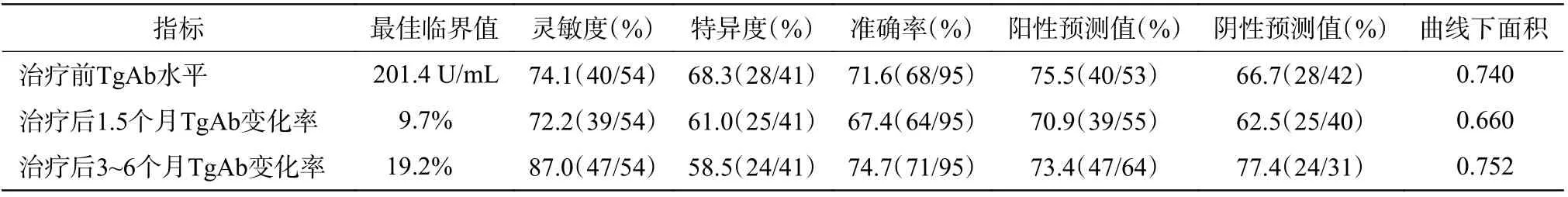
表5 95 例分化型甲状腺癌患者131I 治疗前TgAb 水平及治疗后TgAb 变化率的诊断效能Table 5 Diagnostic efficacy of TgAb level before 131I treatment and percent change of TgAb after treatment in 95 patients with differentiated thyoid carcinoma
3 讨论
TgAb 是针对Tg 产生的抑制性自身抗体,其异常增高可见于25%~30%的DTC 患者。当TgAb存在时,Tg 检测的准确性会受到干扰,限制了其作为肿瘤标志物在DTC 患者随访中的应用[2]。理论上,通过甲状腺全切及随后的131I 治疗,完全清除了残留的甲状腺组织及DTC 组织,可以导致抗原刺激的停止以及TgAb 水平的逐渐下降,最终完全消失[11]。因此,有研究结果表明,可以将TgAb 作为DTC 患者的替补肿瘤标志物[3]。既往一些研究结果显示,131I 治疗后TgAb 阳性对DTC 预后可能有预测作用。Chung 等[12]的研究结果显示,TgAb 阳性患者的复发率高于TgAb 阴性患者(49%对3.4%,P<0.0001)。范群等[13]的研究结果也表明,TgAb 可作为监测131I 清甲治疗后TgAb 阳性患者复发和(或)转移的指标,并计算TgAb 的临界值为204 IU/mL,且TgAb 水平越高,发生复发和(或)转移的概率越大。以上研究结果表明,TgAb 阳性与DTC 复发和(或)转移有相关性,但关于TgAb预测131I 治疗效果的研究较少。本研究结果显示,影像学表现满意组的术后TgAb 水平较影像学表现不满意组和影像学表现不确切组更低,这表明术后TgAb 水平可以预测131I 治疗效果,TgAb 水平较低者疗效较好,其最佳临界值为201.4 U/mL。
有研究结果表明,动态监测无复发和(或)转移的TgAb 阳性的DTC 患者手术及131I 治疗后TgAb水平的变化趋势,其中90%以上的患者经治疗后TgAb 水平呈持续下降趋势;相反的,大多数疾病持续状态的DTC 患者TgAb 水平无变化或升高[11]。Kim 等[3]的研究结果显示,手术+131I 治疗后6~12个月TgAb 水平下降至小于基线值(治疗前)50%的患者有较好的预后;治疗后TgAb 水平与基线值相比没有增加的患者,无病生存率大约为80%,而TgAb 水平上升的患者,只有55%的无病生存率。有研究者认为,治疗后早期TgAb 水平呈下降趋势者的预后较好;TgAb 水平的变化趋势比任何一次测定的TgAb 值都重要,尤其是对于DTC 治疗后早期。张娜和梁军[14]的研究结果表明,TgAb 水平的变化趋势与甲状腺乳头状癌患者的清甲疗效相关,TgAb 水平下降幅度小或升高者清甲的疗效较差。刘日信等[15]的研究结果显示,131I 治疗效果在TgAb 下降组、TgAb 稳定组、TgAb 升高组间的疗效比较,差异有统计学意义(χ2=22.267,P<0.001),两两组间比较显示TgAb 下降组131I 治疗效果优于TgAb 稳定组和升高组。本研究中,影像学表现满意组患者治疗后TgAb 水平均呈持续下降状态或仅在第1 次复查时升高而后持续下降,无持续升高的情况;治疗后TgAb 水平持续升高者有5 例,其中影像学表现不满意组有3 例(15.8%)、影像学表现不确切组有2 例(9.1%)。1.5 个月TgAb 变化率和3~6 个月TgAb 变化率在3 组间的差异有统计学意义,两两比较显示影像学表现满意组在治疗后1.5个月和3~6 个月复查时的TgAb 水平下降率均显著高于影像学表现不满意组,TgAb 水平下降越显著,131I 治疗的效果越好。ROC 曲线分析结果显示,治疗后1.5 个月时TgAb 水平下降>9.7%、3~6 个月时TgAb 水平下降>19.2%,这提示131I 治疗后达到影像学表现满意的可能性大。
综上所述,TgAb 阳性的DTC 患者131I 治疗前TgAb 水平及治疗后 1.5、3~6 个月的TgAb 变化率均对131I 治疗效果具有较好的预测价值,可以作为临床有价值的早期参考指标,为后续治疗提供参考。由于本研究属于回顾性单中心研究,病例数较少,存在一定的选择偏倚,结论需要进一步的多中心随机对照研究进行证实。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 南楠负责研究命题的设计、试验过程的实施、数据的采集与分析、论文的撰写;鲜于志群、赵明负责试验的实施、数据的采集;朱小华负责研究命题的提出与设计、论文最终版本的修订。
