PEG400修饰的ZnS:Cu量子点荧光猝灭法检测农药敌草快
2021-02-12王艳君
王艳君,张 帆
(1. 福建技术师范学院, 福建 福清 350300;2. 现代设施农业福建省高等学校工程研究中心, 福建 福清 350300)
0 引言
【研究意义】农药敌草快(1,1′-亚乙基-2,2′-联吡啶二溴盐,Diquat)是非选择型联吡啶类阳离子季铵盐除草剂,具有高水溶性和低挥发性的特点,因其价格低廉,在全球的应用范围较广[1],具有一定的传导性,对部分农作物不利[2,3],且敌草快是一种中低毒性农药,对哺乳动物有一定的危害,可造成环境的破坏及水体污染。为应对农药对人类及环境造成的威胁,许多研究者对农药残留的检测方法进行不断探索[4]。建立快速、灵敏和实时检测环境与食品中农药含量的技术对环境及食品中农药残留的检测具有积极的意义。【前人研究进展】国内外学者对农药残留检测方法进行大量的研究,王纪平等[5]采用表面增强拉曼散射的方法检测敌草快,当含量在0.05~1.00 μg·kg-1时,检出限达到0.05 μg·kg-1;赵静等[6]通过高效液相色谱法建立了一种简单且易于应用在实际中检测敌草快的方法;多种类型的量子点用于农药残留的检测, CdTe、CdSe/ZnS 以及 CdSe/ZnSe/ZnS 量子点联用检测有机磷农药,检测限为0.05~10.00 μg·L-1[7];不同的金属离子掺杂型量子点与传统的量子点相比,掺杂型量子点的优势具有高荧光量子产率,热稳定性。可通过聚乙二醇、聚乙烯、牛血清白蛋白等改善量子点的表面性能,Li等[8]采用环芳烃大分子对量子点进行修饰,可实现对草甘膦的特异性检测,检测限大幅提高;为提高量子点的检测灵敏度,在掺杂量子点、表面修饰的基础上,不断开发出分子印迹复合量子点、核酸适配体量子点等,研发趋势从有毒性的量子点向无毒性环境友好型量子点发展。目前对农药残留的检测方法中,常用色谱法、酶联免疫法和电化学分析法检测农药残留,但存在处理过程复杂、仪器设备要求高[9]、价格昂贵等缺点[10],使得其在现场环境条件下缺少实用性。因此,建立简单、快速、有效的检测方法已成为研究热点[11]。量子点(QDs)是荧光发光材料,其制备简单、稳定性好,可作为一种便捷、高效、廉价的农药检测材料。国内外研究表明,量子点可与所测化学物质发生一定的化学或物理反应,从而使量子点发生荧光猝灭[12],以生物荧光探针、生物传感器的形式被广泛应用,目前已有量子点应用于草甘膦、氟啶胺、杀草强等农药残留、抗生素及杀虫剂等检测中[13-14]。量子点是由Ⅲ-Ⅴ族或Ⅱ-Ⅵ族元素组成,直径在1~10 nm,一般可溶于水,其荧光发射光谱对称且狭窄,荧光激发光谱宽且连续。因此,比普通有机发光材料、无机磷粉具有更好的光学性能[15-16]。由Ⅱ-Ⅵ族元素组成的ZnS量子点是一种绿色环保的量子点,但由于它在激发时容易氧化,且材料的尺寸相对较小,使得电子跃迁受到影响,影响其光学性能,较难广泛应用。为了使其发射寿命延长、细胞毒性降低、荧光稳定性增强,将量子点与过渡金属离子进行反应,形成掺杂型量子点,可通过水相合成法制备,水相合成具有环境友好、价格低廉、操作方便,对设备要求低,可重复性高等优势[16],化学共沉淀法是目前最常见的合成水溶性量子点的方法,步骤简单、成本低廉,较适合大规模的量子点合成,但前驱体和配体的种类和数量以及实验参数对量子点的尺寸及发光性能影响较大;微波辅助合成法虽加热均匀、能量利用效率高,但微波可产生与常规加热不同的选择性及可能存在的微波非热效应等。【本研究切入点】水相合成法的最大优势是操作简单、反应条件温和,合成的粒子稳定性好,粉末可存放较长时间后于水溶液中重新分散,尤其是对于生物学材料而言,可选择不同类型的表面修饰剂控制粒子的表面形貌,为生物标记物的构建提供便利。而关于水相合成法制备水溶性量子点有待深入研究。【拟解决关键问题】在量子点制备时可添加聚乙二醇、壳聚糖、L-半胱氨酸等进行修饰,解决由表面效应和其他原子发生结合出现团聚的现象,使量子点的结晶度变好,荧光量子产率提升[17-19],加之ZnS:Cu量子点的细胞毒性低、荧光性能稳定,本研究采用水相合成法制备ZnS:Cu量子点,并加入PEG400对量子点进行修饰,利用量子点的荧光猝灭强度来检测农药敌草快,探究PEG400对ZnS:Cu量子点的修饰效果、量子点与农药敌草快的荧光猝灭效果,以期建立一种快捷且灵敏度高的方法用于农药检测。
1 材料与方法
1.1 试验材料
1.1.1 试剂 3-巯基乙酸、硝酸锌、氯化铜(分析纯,麦克林生化科技有限公司);硫化钠(Na2S·9H2O,分析纯,国药集团化学试剂股份有限公司),聚乙二醇PEG400(分析纯,阿拉丁化学试剂有限公司),无水乙醇、乙醇(95%,分析纯,北京坛墨质检科技有限公司)。
1.1.2 仪器 Nicolet 380型傅里叶红外光谱(美国热电公司),970 CRT型荧光分光光度计(上海精科仪器有限公司),FD-1E型台式冷冻干燥机(北京德天佑科技发展有限公司)。
1.2 试验方法
1.2.1 PEG400修饰的ZnS:Cu量子点制备 在60 ℃温度下,依次加入0.1 mol·L-1的硝酸锌溶液10 mL、0.005 mol·L-1氯 化 铜 溶 液1 mL、140 μL3-巯 基 丙 酸(MPA)、34 mL超纯水和一定量PEG400,于恒温磁力搅拌器充分搅拌40 min[20],标记为A溶液;将A溶液的pH调节至7.0,并加入0.1 mol·L-1的硫化钠溶液7 mL,于室温下静置2 min后将pH调至10.0,标记为B溶液;将B溶液置于恒温磁力搅拌器上搅拌30 min后,置于50 ℃恒温水浴锅中陈化2 h取出,即得PEG400修饰的ZnS:Cu水溶胶;取出部分水溶胶并加入80 mL的无水乙醇使其出现沉淀,在5000 r·min-1的条件下离心5 min并分离去除上层溶液,留下白色沉淀并用无水乙醇重复清洗3次,再用超纯水溶解沉淀;将所制得的溶液置于真空冷冻干燥箱冷冻干燥2 d,即得粉末状PEG400修饰的ZnS:Cu量子点[21-22]。
1.2.2 量子点的表征 紫外光谱分析:采用紫外-可见吸收光谱,条件为室温下,以空气为参比,200~650 nm扫描,间隔5 nm扫描1次。荧光光谱分析:将样品稀释一定倍数,采用970CRT型荧光分光光度计检测分析样品的荧光发射光谱,狭缝宽10 nm,激发波长350 nm。红外光谱分析:采用 KBr 压片法,室温下,取1.5 mg量子点粉末与100~120 mg干燥KBr粉末充分研磨,置于模具中进行压片,将压片置于傅里叶红外光谱仪中,400~4000 cm-1扫描。
1.2.3 敌草快对量子点的荧光猝灭分析 农药敌草快的浓度为0.588 mol·L-1,置于4 ℃冰箱保存备用。取100 μL PEG400-ZnS:Cu量子点溶液、不同浓度的敌草快溶液8 mL分别加入到10 mL比色管中,定容至刻度混匀,设置荧光光谱的激发波长为350 nm,发射狭缝的宽度为10 nm、激发狭缝的宽度为10 nm,在300~500 nm范围内进行扫描[23-24]。
1.2.4 量子点的抑菌性和毒性试验 抑菌试验:活化大肠杆菌DH5α感受态细胞。配制含氨苄抗性的LB固体培养基,试验组加入200 μL PEG400修饰的ZnS:Cu量子点,对照组LB固体培养基中不加量子点,倒平板并划线,于37 ℃培养箱培养24 h,计数并取平均值,根据公式:η/%=[(N1-N2)÷N1]×100 ;其中η为抑菌率;N1为无PEG400修饰的ZnS:Cu量子点培养基中单菌落数;N2为含有PEG400修饰的ZnS:Cu量子点培养基在的单菌落数[25]。毒性试验:将同管已转化的大肠杆菌DH5α感受态细胞分别吸取5 μL加入至4瓶100 mL含5 μL氨苄青霉素的LB液体培养基中,并加入200 μL PEG400修饰的ZnS:Cu量子点,充分摇匀,做4组空白对照,放入37 ℃、200 r·min-1摇床培养16~18 h,每隔2 h测定600 nm下的吸光度值(OD值),设4组平行试验[26,27],根据培养时间和对应OD值绘制大肠杆菌生长曲线。
1.2.5 反应时间对荧光猝灭的影响 在确定最适量子点用量及适合的敌草快浓度的条件下,探究反应时间对量子点荧光猝灭的影响。取8 mL适当浓度的敌草快溶液,加入200 μL PEG400修饰的ZnS:Cu量子点,定容至10 mL,测定在0~2 h的时间范围内,量子点荧光猝灭情况,间隔为30 min,并比较荧光猝灭曲线的变化[23,24]。
2 结果与分析
2.1 不同含量PEG400-ZnS:Cu量子点荧光光谱图分析
由荧光激发光谱图(图1)可知,在发射波长不变的情况下,激发波长不断增大,量子点的荧光强度先上升后下降,最大值激发波长为351 nm。PEG400修饰过的ZnS:Cu量子点的荧光强度显著高于未经修饰的量子点。PEG400是一种非离子型溶剂,在常温下化学稳定好,在静电作用下PEG400与量子点复合,使ZnS:Cu量子点更易溶于水中,降低了量子点颗粒间发生的团聚现象,从而使其荧光强度提高。PEG400的含量对ZnS:Cu量子点的荧光强度影响显著,其中添加100 μL PEG400制备的量子点的荧光强度最大,添加200 μL PEG400制备的量子点的荧光强度最小,即在100~200 μLPEG400含量的范围内,PEG400含量增加,量子点的荧光强度逐渐降低;添加过量的修饰剂PEG400,使量子点溶液黏度增大,根据架桥作用,ZnS:Cu量子点重新团聚,促使悬挂键和不饱和键的数量在量子点表面增多,从而在量子点表面形成缺陷,使荧光强度逐渐降低[18]。
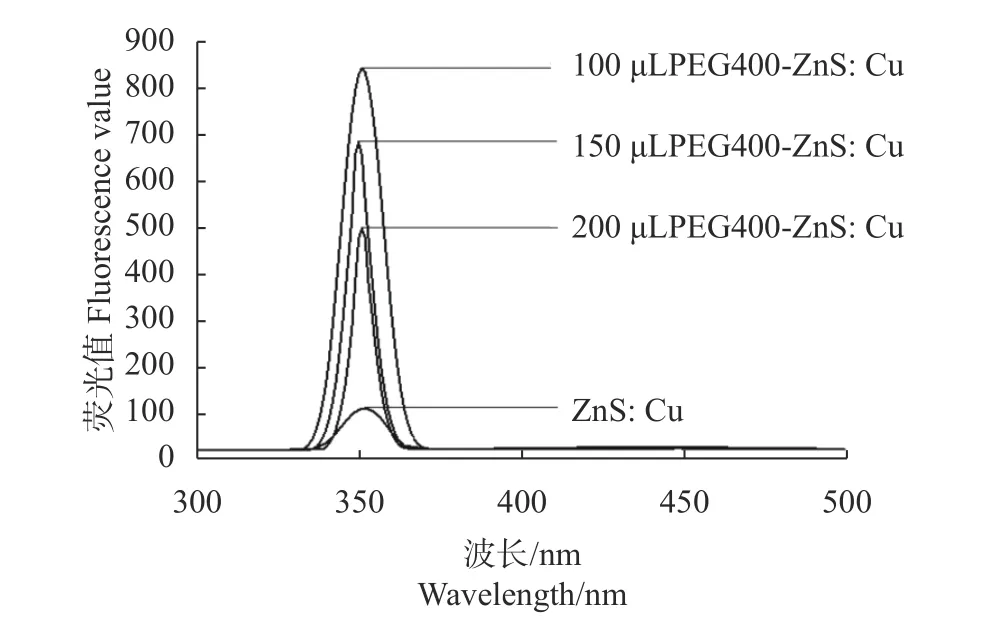
图1 ZnS:Cu量子点、不同含量PEG-ZnS:Cu量子点荧光激发光谱Fig. 1 Fluorescence excitation spectra of ZnS: Cu QDs and QDs containing varied amounts of PEG
2.2 不同含量PEG400-ZnS:Cu量子点红外光谱图
ZnS:Cu量子点与100 μL、150 μLPEG400修饰量子点的曲线在1383.85 cm-1、1635.40 cm-1和2345.34 cm-1处出现了3个吸收峰(图2),200 μL PEG400修饰PEG-ZnS:Cu量子点只在1383.85 cm-1、1635.40 cm-1出现2个峰。1635.40 cm-1为C-C的振动吸收,2345.34 cm-1为饱和-CH的振动吸收,1383.85 cm-1为C=O基的反对称伸缩振动,分析原因是在量子点制备过程中3-巯基丙酸发生水解反应含C=O的部分与Zn2+发生络合[28]。在3400 cm-1处未出现-OH的吸收峰,分析原因可能是由于制备量子点过程中-OH发生充分反应造成的。且100 μL PEG400修饰的ZnS:Cu量子点透过率最低、200 μL PEG400修饰的ZnS:Cu量子点透过率最高。透过率越低,其吸收值越高,可以表明100 μL PEG400修饰的ZnS:Cu量子点吸收值最高。
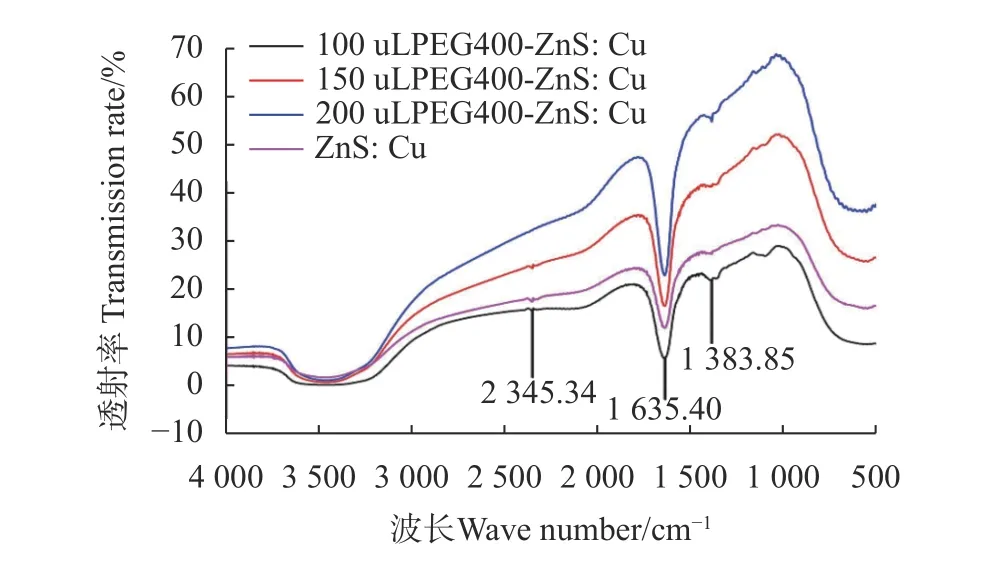
图2 ZnS:Cu量子点与不同含量PEG400修饰的PEGZnS:Cu量子点的红外光谱Fig. 2 Infrared spectra of ZnS:Cu QDs and QDs modified with varied amounts of PEG400
2.3 不同含量PEG400-ZnS:Cu量子点紫外光谱图分析
量子点的紫外吸收范围较广,添加PEG修饰的各量子点在240 nm附近有最大的吸收峰(图3),随着波长的增加,吸光度值逐渐降低;而ZnS:Cu在235 nm附近出现最大的吸收峰。这主要是由于ZnS:Cu量子点发生电荷跃迁造成的,由过渡金属Cu2+受到辐射能激发后,一个电子从给予外层轨道向接受体跃迁产生。此外,PEG400修饰的ZnS:Cu量子点的吸收范围比ZnS:Cu量子点宽,可能是由于PEG400中含有环氧乙烷,其中含有的-OH是助色基团,从而使吸收峰发生红移。
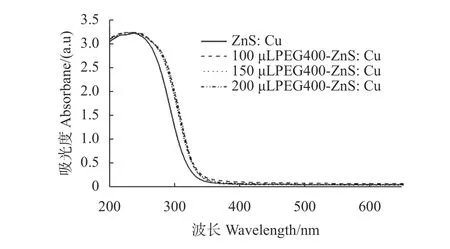
图3 ZnS:Cu量子点与不同含量PEG400修饰的PEGZnS:Cu量子点的紫外光谱Fig. 3 UV spectra of ZnS:Cu quantum dots and QDs modified with varied amounts of PEG400
2.4 敌草快浓度对PEG400修饰的ZnS:Cu量子点的荧光猝灭的影响
由图4可知,在351 nm附近100 μL PEG400-ZnS:Cu量子点具有最大荧光值846.36,加入不同浓度的敌草快后,100 μL PEG400-ZnS:Cu量子点的荧光强度明显下降,随着敌草快浓度从0增至13.05×10-6mol·L-1,100 μL PEG400-ZnS:Cu量子点的荧光值降低至初始的5.56%。试验表明,PEG400-ZnS:Cu量子点与敌草快之间存在荧光猝灭效应,并在敌草快浓度较低时(1.45×10-6mol·L-1)荧光猝灭响应迅速。
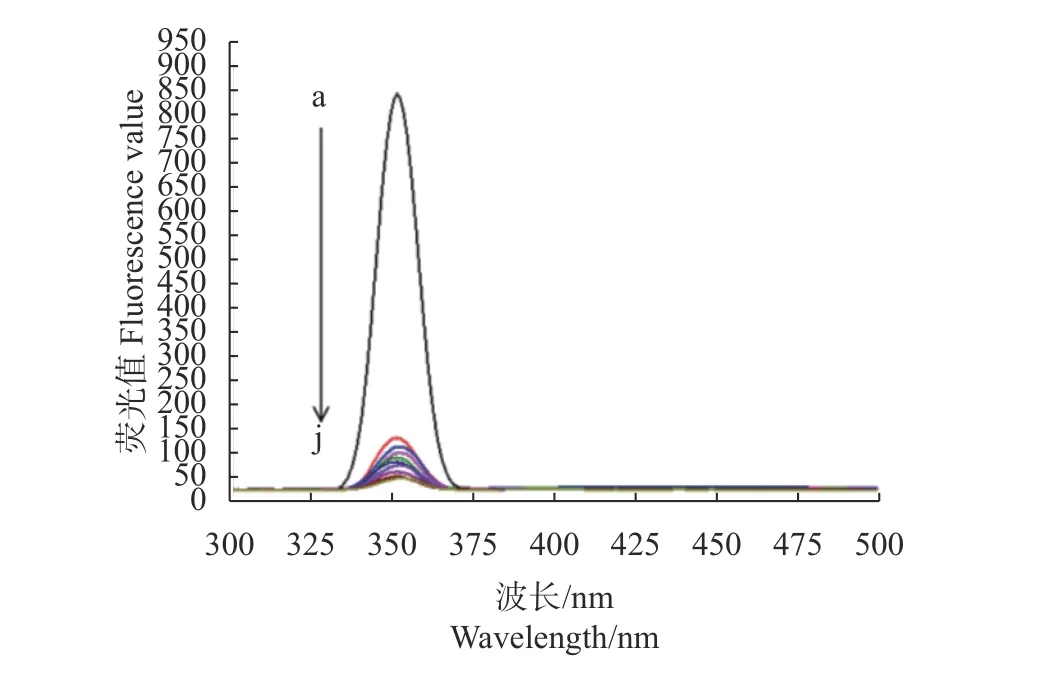
图4 敌草快浓度对量子点的荧光猝灭光谱图Fig. 4 Fluorescence quenching spectra of QDs with varied diquat concentrations
由Stern-Volmer方程:I0/I=1+Ksv[S],其中I0为在351 nm处不加入量子点的荧光值,I表示在351 nm处加入不同浓度敌草快后量子点的荧光值,[S]为敌草快的浓度,Ksv为敌草快对PEG400-ZnS:Cu量子点的猝灭常数[23,24]。当敌草快浓度处于1.45×10-6~8.70×10-6mol·L-1时I0/I与[S]之间有较好的线性关系(图5),相关系数R2=0.9999。经计算Ksv=67.5×104L·mol-1·s-1。取2.90×10-6mol·L-1的 敌 草 快 进 行5次空白测定后的相对标准偏差是0.9964%,检出限为2.071×10-7mol·L-1,表明敌草快对PEG400修饰的ZnS:Cu量子点的荧光猝灭的灵敏度较好。
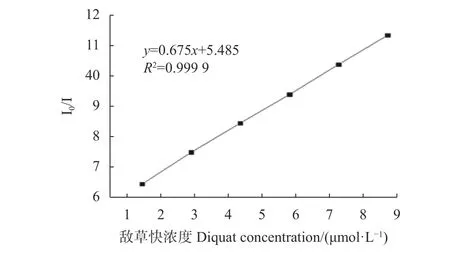
图5 荧光强度与敌草快浓度的Stern-Volmer关系方程Fig. 5 Stern-Volmer equation on relationship between fluorescence intensity and diquat concentration
2.5 反应时间对PEG400修饰的ZnS:Cu量子点荧光猝灭的影响
选取浓度为2.90×10-6mol·L-1的敌草快,加入100 μLPEG400-ZnS:Cu量子点,反应150 min并进行荧光强度的检测。结果由图6可知,加入敌草快后,100 μL PEG400-ZnS:Cu量子点会迅速发生猝灭,但是在前60 min内,随着反应时间增加,荧光值降低,在60 min之后荧光值增高并保持稳定,因此,量子点与敌草快的荧光猝灭的检测时间为60 min后。

图6 反应时间对量子点的荧光猝灭的光谱图Fig. 6 Spectrogram of fluorescence quenching of QDs by reaction time
2.6 PEG400修饰的ZnS:Cu量子点的抑菌性检测
PEG400修饰的ZnS:Cu量子点对大肠杆菌生长的影响由表1可知,未添加量子点情况下大肠杆菌的平均数为275;添加量子点后大肠杆菌的平均数为230。计算抑菌率η为16.36%,小于50%,说明PEG400修饰的ZnS:Cu量子点对大肠杆菌无抑菌性。
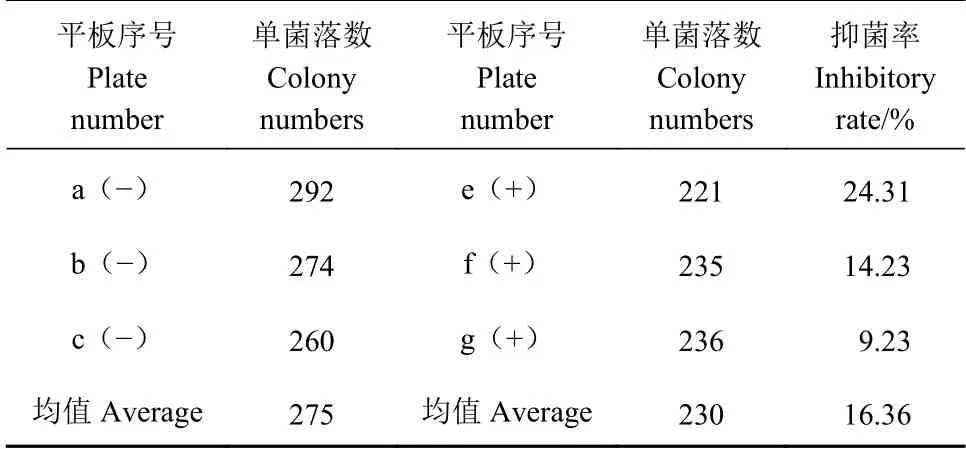
表1 量子点对大肠杆菌生长的平板计数测定Table 1 Plate counts of Escherichia coli by QDs
2.7 PEG400修饰的ZnS:Cu量子点的毒性检测
大肠杆菌的生长曲线,由图7可知,在培养8 h后菌体进入对数增长期,12 h后逐渐平缓。加入100 μLPEG400修饰的ZnS:Cu量子点的大肠杆菌生长曲线与未加入量子点保持相同的生长趋势,且添加量子点的曲线在未添加量子点上方,可能是因为量子点在600 nm处有一定的吸光度,结合平板计数可知,将PEG400加入到ZnS:Cu中,并未产生致毒物质。所以PEG400修饰的ZnS:Cu量子点有望用于生物检测中。
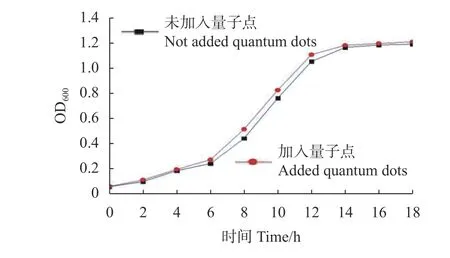
图7 量子点对大肠杆菌的生长的影响Fig. 7 Effect of quantum dots on the growth of Escherichia coli
3 讨论与结论
本研究通过水相合成法制备PEG400修饰的ZnS:Cu量子点,复合量子点的荧光强度明显高于未经PEG400修饰的ZnS:Cu量子点,以100 μL PEG400修饰的ZnS:Cu量子点与农药敌草快具有较好的荧光猝灭响应,在敌草快浓度为1.45×10-6-8.7×10-6mol·L-1时PEG400-ZnS:Cu的荧光猝灭与敌草快的浓度存在一定的线性关系,相关系数R2达到0.9999,检出限为2.071×10-7mol·L-1且荧光猝灭迅速,在反应60 min之后基本稳定。通过以大肠杆菌典型模式生物[29]进行量子点抑菌性及毒性检测表明,PEG400修饰的ZnS:Cu量子点对大肠杆菌没有抑菌性和生物毒性,量子点的使用并没有通过生态链底层的微生物来打破生态平衡[30],保障了环境的可持续发展战略。因此,PEG400修饰的ZnS:Cu量子点,是一种具有高荧光强度、且无毒、水溶性好、对环境污染小的量子点类型[31]。
近年来,量子点材料在环境、食品等农药残留方面被广泛应用,这得益于两个方面,其一,高光致发光性,本试验制备ZnS:Cu量子点,是一种具有高光致发光性的水溶性量子点[27],与单纯的ZnS量子点相比,Cu2+的加入可以使量子点的性能更加完善,陆梦晨等[22]的研究结果显示:Cu2+的加入修复了ZnS量子点表面的缺陷,由此使其发光性能得到增强。其二,量子点的表面效应,当量子点尺寸达到纳米级别时,表现量子化效应,显示出优越的光学特性。比表面积增大,使得量子点表现出较高的表面能及不饱和度,从而引发量子点团聚及表面缺陷,以PEG400修饰后的量子点在一定程度上弥补了表面缺陷,聚乙二醇的加入使量子点表面包裹了更多具有亲水性的羟基,提高量子点的水溶性,而水溶性的量子点具有更稳定的荧光特性[32]。
在探究敌草快的荧光猝灭效果的研究中,本研究获得的荧光猝灭法将PEG400修饰的ZnS:Cu量子点可用于农药敌草快的快速检测中,是一种便捷、经济、准确度和灵敏度都较高的方法,可为农药检测方法的探索及生物传感的发展提供数据支持。
