MRI水-脂分离Dixon技术与弥散加权成像技术在良恶性椎体压缩性骨折诊断中的应用
2021-02-10茹云乔宏宇李新苗
茹云,乔宏宇,李新苗
(浙江省荣军医院,浙江 嘉兴 314001)
椎体压缩性骨折是临床上十分常见的一种骨骼系统疾病,多发于中老年人[1-3]。椎体压缩性骨折根据病因的不同,有良性和恶性之分,其中良性椎体压缩性骨折的病因主要是外伤、骨质疏松及感染性疾病,恶性椎体压缩性骨折的病因主要是原发性骨肿瘤或转移性骨肿瘤[4-6]。准确、及时地区分良恶性病变信号对椎体压缩性骨折的鉴别诊断具有重要的意义。MRI检查是临床上常用的诊断方法,可显示椎体压缩性骨折的病变部位[7-9]。近年来研究发现[10-12],MRI水-脂分离Dixon技术可分析脂肪肝、肾脏等含脂性组织或病灶部位水、脂肪含量,有助于疾病诊断;MRI弥散加权成像(diffusion weighted imaging,DWI)技术可通过观察活体组织中水分子的微观弥散运动,判断组织结构,对疾病进行鉴别诊断。目前,关于MRI水-脂分离Dixon技术与DWI技术在良恶性椎体压缩性骨折鉴别诊断中应用效果的报道尚不多见。本研究旨在探讨MRI水-脂分离Dixon技术与DWI技术在良恶性椎体压缩性骨折诊断中的应用价值,现报告如下。
1 临床资料
1.1 一般资料以2016年1月至2020年5月浙江省荣军医院收治的椎体压缩性骨折患者为研究对象。试验方案经医院医学伦理委员会审查通过。
1.2 纳入标准①经CT、MRI检查确诊为椎体压缩性骨折;②MRI影像资料完整,包括MRI常规矢状位T1WI、T2WI、短时反转恢复序列扫描及T2WI-Dixon、DWI序列扫描;③通过腰椎穿刺取病变组织行病理检查;④病例资料完整。
1.3 排除标准①合并其他部位骨折者;②合并心、肝、肾等脏器严重衰竭者;③妊娠期妇女。
2 方 法
2.1 分组方法按病理检查结果分为良性组和恶性组。
2.2 MRI检查方法MRI检查采用德国Siemens Avanto1.5T MRI扫描仪,采用16通道相控阵脊柱线圈,患者取仰卧位。扫描序列及参数:自旋回波矢状位T1WI,重复时间(repetition time,TR)/回波时间(echo time,TE)=412 ms/10 ms;快速自旋回波矢状位T2WI,TR/TE=3000 ms/104 ms;矢状位短时反转恢复序列,TR/TE=4230 ms/98.00 ms,反转时间为180.00 ms,矩阵320 mm×256 mm,层厚4 mm;T2WI-Dixon 序列,TR/TE=3070 ms/91 ms,扫描时间190.00 ms;DWI,TR/TE=2000 ms/80 ms,b值600 s·mm-2,扫描时间250 s),矩阵260 mm×256 mm,层厚4 mm,层距0.5 mm。
2.3 图像分析及相关指标测量方法将获得的MRI图像导入Siemens syngo.via工作站,由2名高年资影像医师采用双盲法阅片,意见不一致时,经讨论达成一致。在良性组及恶性组同相位、反相位、纯水相及纯脂相4幅图像(水-脂分离Dixon技术采用双回波序列成像,将同相位与反相位2种图像信息相减或相加后再除以2,可获得同一层面相互匹配的同相位、反相位、纯水相及纯脂相4幅图像)中选取椎体病变范围最大层面,测定病变椎体信号强度比(signal intensity ratio,SIR)、脂肪信号分数(fat-signal fraction,FF)。通过工作站对DWI矢状位扫描图像进行后处理,获得表面弥散系数(apparent diffusion coefficient,ADC)图,在此图上选取感兴趣区(选取范围需覆盖病灶区的75%),测量病灶最大显示层面上感兴趣区的ADC,连续测量3次,取其平均值。SIR=SIOP/SIIP×100%,FF=SIFO/(SIWO+SIFO)×100%,SIOP、SIIP、SIWO、SIFO分别为反相位、同相位、纯水相、纯脂相的信号强度。
2.4 数据统计方法采用SPSS22.0软件进行数据统计分析。2组患者性别的比较采用χ2检验,年龄、SIR、FF、ADC的组间比较采用t检验;采用受试者工作特征(receiver operator characteristic,ROC)曲线分析评价应用SIR、FF、ADC诊断良恶性椎体压缩性骨折的准确性。检验水准α=0.05。
3 结 果
符合要求的患者共60例,良性组34例,其中18例骨质疏松性骨折、10例创伤性骨折、6例感染性骨折,典型病例见图1;恶性组26例,其中22例转移性骨折、2例非霍奇金淋巴瘤、2例多发性骨髓瘤,典型病例见图2。2组患者的基线资料比较,差异无统计学意义,有可比性(表1)。良性组患者SIR低于恶性组,FF、ADC均高于恶性组(表2)。应用SIR、FF及ADC诊断良恶性椎体压缩性骨折的ROC分析结果见表3、图3。
4 讨 论
椎体压缩性骨折良、恶性病变的鉴别诊断一直是临床诊断的难点,及时、准确的诊断有利于临床椎体压缩性骨折治疗方式的选择和预后评估[13-15]。正常的椎体骨髓一般由黄骨髓和红骨髓组成,其中黄骨髓中脂肪含量约占80%,红骨髓中脂肪和水的含量接近,且随着年龄的增长椎体骨髓中的红骨髓逐渐被黄骨髓所取代[16-18]。水-脂分离Dixon技术利用了化学位移效应,在MRI常规自旋回波序列基础上,通过调整不同的回波时间,采集同相位与反相位图像。通过此图像可以计算出SIR、FF的值,其中SIR可反映反相位信号强度,其值越高代表反相位信号越强,而反相位信号强度随着脂肪含量的增加而降低;FF可反映机体脂肪含量,其值越高代表脂肪含量越高[19-20]。有研究[21]发现,水-脂分离Dixon技术可测量病变骨骼中脂肪含量,脂肪含量较高则高度提示骨骼病变为良性。DWI技术可反映活体组织功能状态。通过ADC值可得知组织中水分子的弥散特点,从而判断水分子受限制的程度和方向,分辨正常组织和病理组织。
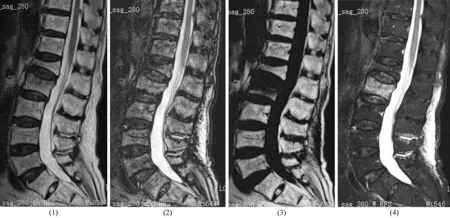
图1 L2椎体压缩性骨折MRI水-脂分离Dixon技术获取图像
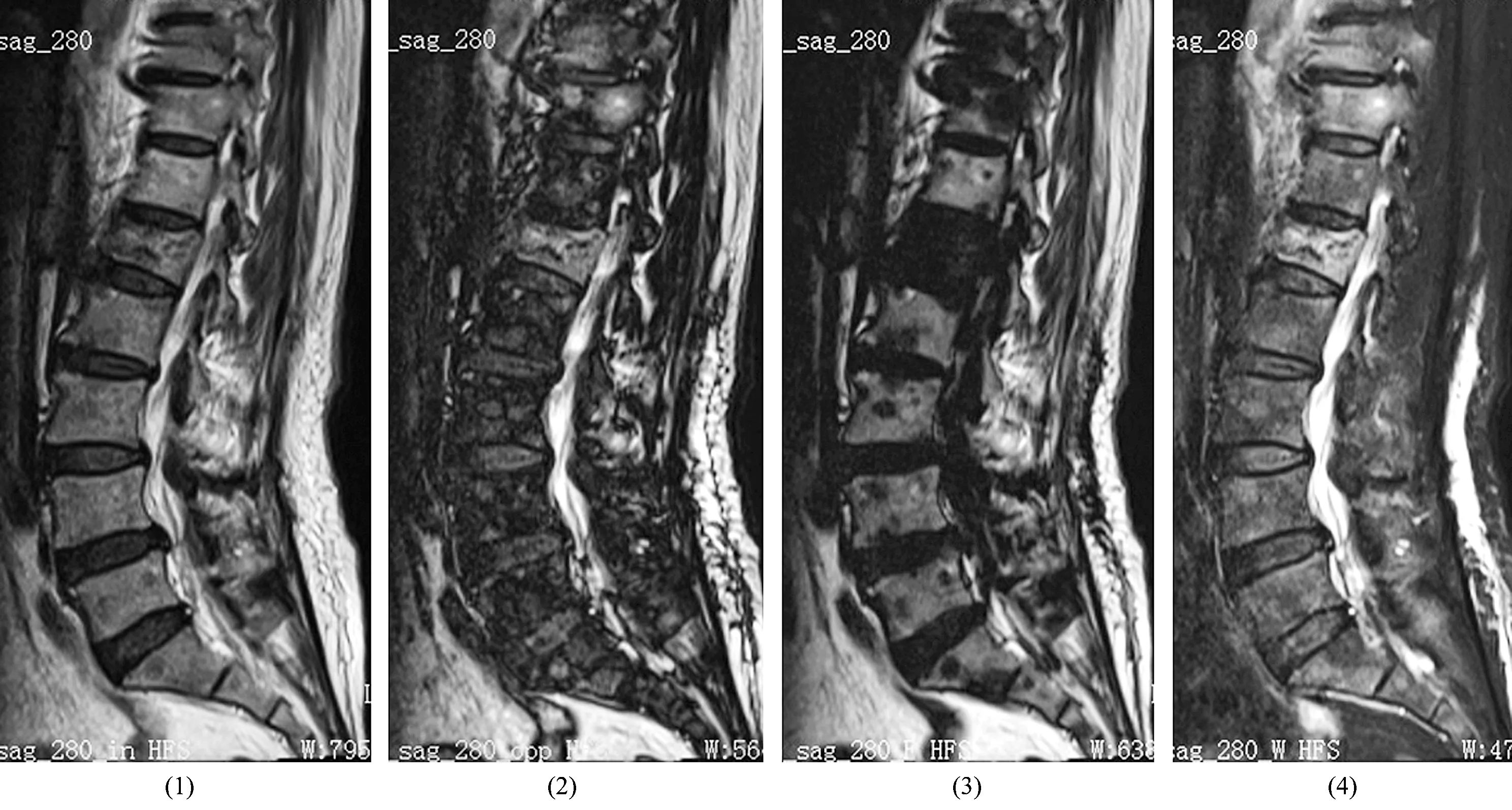
图2 L1椎体压缩性骨折MRI水-脂分离Dixon技术获取图像

表1 2组椎体压缩性骨折患者的基线资料

表2 2组椎体压缩性骨折患者的SIR、FF、ADC

表3 应用SIR、FF、ADC诊断良恶性椎体压缩性骨折的ROC曲线分析结果
良性椎体压缩性骨折患者骨小梁网络结构缺失,由脂肪细胞所取代,脂肪比例升高,导致反相位图像信号损失,反相位信号强度降低,因此良性组患者FF值升高而SIR值降低[22]。此外,良性椎体压缩性骨折患者常伴有不同程度的骨髓水肿,导致细胞外容积增加,水分子自由运动增加,故良性组患者ADC值变大[23]。恶性椎体压缩性骨折患者正常骨髓通常由肿瘤细胞所取代,脂肪成分遭到破坏,致使骨髓脂肪含量下降,反相位信号增强,故恶性组患者FF值下降而SIR值升高;同时恶性椎体压缩性骨折部位有反应性硬骨形成、坏死骨质产生,导致骨髓细胞间隙减少,水分子自由运动受到空间限制,因而良性组患者ADC值变小[24]。本研究结果显示,应用SIR、FF及ADC诊断良恶性椎体压缩性骨折的ROC曲线下面积(曲线下面积取值范围为0.5~1.0,曲线下面积越接近1.0,诊断方法的真实性越高)分别为0.885、0.804和0.870,说明三者均具有良好的诊断价值,可作为良恶性椎体压缩性骨折的诊断指标。马茜等[25]研究认为,ADC在脊柱椎体良恶性压缩骨折的鉴别诊断中具有较高的应用价值;张薇等[26]的研究也表明,SIR、ADC在椎体压缩骨折的诊断中均具有一定的价值,且灵敏度、特异度较高,这与本研究结果一致。

SIR:信号强度比;FF:脂肪信号分数;ADC:表面弥散系数。
本研究结果显示,应用MRI水-脂分离Dixon技术及DWI技术可有效区分良恶性椎体压缩性骨折。
