桤叶唐棣花色苷分离纯化及抗氧化与抑菌活性1)
2021-02-10张卓睿崔金麒赵羚汐贾淇舒杨春晓王琦
张卓睿 崔金麒 赵羚汐 贾淇舒 杨春晓 王琦
(北华大学,吉林,132013)
姜贵全 彭钰博
(北华大学木质材料科学与工程省重点实验室(北华大学)) (澳大利亚阿德莱德大学)
桤叶唐棣(Amelanchieralnifolia)是蔷薇科唐棣属落叶小乔木或灌木,为北美洲内陆的重要经济林树,目前在我国辽宁、吉林、黑龙江、山西、陕西、宁夏、内蒙、新疆、青海等省区均有引种栽培[1]。桤叶唐棣果实为小浆果,形似蓝莓,主要营养物质也与蓝莓极为相近,花色苷、原花青素、绿原酸等活性成分含量较高[2]。近年来,随着对桤叶唐棣果实中活性物质组成、含量及功能性研究的逐步深入,桤叶唐棣的种植及果实深加工技术也得到了迅速发展[1]。花色苷属于水溶性的天然色素,是一种多酚类化合物,由花色素和糖以糖苷键结合而成,其基本结构单元是C6-C3-C6骨架构成的2-苯基苯并吡喃[3],具有抗氧化[4-5]、抗突变[6]、抗肿瘤[7-8]、预防心血管疾病[9]、抗炎症[10]和保护视力[11]等功效,已逐渐成为植物学、药学及营养学的研究热点。桤叶唐棣花色苷粗提物中含有大量的糖类、蛋白质类、脂类及色素等杂质[3],严重影响花色苷的纯度,若要深入地研究其生物学活性并开发相关产品,则必须对花色苷粗提物进行分离和纯化。目前,花色苷的纯化方法主要用大孔树脂层析法、凝胶层析法、C18反相色谱法等[3]。大孔树脂是一类高分子吸附分离介质,具有高稳定性、高选择性、操作简单、成本低廉、适于工业化生产[12-13]等特点,是当前纯化天然产物最常采用的一种分离技术,已被广泛应用于花色苷[13]、多糖[14]、多酚[15]等活性成分的分离纯化。本文对桤叶唐棣花色苷粗提物在大孔树脂上的吸附—解吸特性进行了研究,优选出了最佳的分离纯化条件,结合高效液相色谱—质谱联用检测技术对纯化组分进行了鉴定分析,并评价了纯化物的抗氧化活性和抑菌性,为桤叶唐棣花色苷的深入研究及开发利用提供了理论依据,具有一定的实际应用价值和意义。
1 材料与方法
1.1 材料与仪器
桤叶唐棣花色苷提取液:称取桤叶唐棣果100 g,破碎后加入体积分数为70%乙醇溶液1 L,在280 W条件下超声提取30 min,提取液以8 000 r/min离心分离5 min,取上清液,在低于40 ℃条件下旋转蒸发除去乙醇,浓缩液按1∶1的体积比加入乙酸乙酯萃取,除去脂溶性物质,再在35 ℃条件下旋转减压浓缩除去乙酸乙酯,浓缩液过0.45 μm膜后,得到桤叶唐棣花色苷粗提液,冷冻干燥,密封保存。
HP-2MGL型大孔树脂购于日本三菱公司;XAD7HP型大孔树脂购于美国罗门哈斯公司;AB-8型、X-5型、D101型大孔树脂购于安徽三星树脂科技有限公司;XDA-8型、LSA-10型大孔树脂购于西安朴天吸附材料有限公司;HB-16型、HB1600型、XAD-1600型大孔树脂购于上海旻永实业有限公司;甲酸、甲醇、乙醇购于中国医药集团上海化学试剂公司,均为色谱纯;DPPH自由基购于美国Sigma公司;维生素C购于天津尖峰生物制品有限公司;其他化学试剂购于国药集团化学试剂有限公司,均为分析纯;大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌由北华大学林学院微生物实验室提供。
试验流程:

图1 实验设计流程图
1.2 桤叶唐棣花色苷的分离纯化
大孔树脂的预处理:先将树脂用无水乙醇浸泡24 h,然后用超纯水冲洗至无醇味,再分别用1 mol/L的HCl和NaOH分别浸泡3 h,超纯水冲洗至pH中性,最后置于砂芯漏斗中,真空抽干备用[16]。
大孔树脂的静态吸附—解吸试验。
(1)大孔树脂的筛选:分别称取预处理后的AB-8、X-5、D-101、LSA-10、XAD-7HP、XDA-8、XDA-1600、HB-16、HB-1600、HP2MGL共10种型号大孔树脂0.5 g于250 mL具塞锥形瓶中,各加入质量浓度为0.125 g/L花色苷溶液20 mL,于25 ℃、100 r/min的恒温振荡器中振荡24 h,抽滤,采用pH示差法[17]测定滤液中花色苷的质量浓度,同时向吸附平衡的树脂中各加入60%乙醇20 mL,于25 ℃、100 r/min的恒温振荡器中振荡24 h,抽滤,pH示差法测定滤液中花色苷的质量浓度。按公式(1)、(2)计算不同型号树脂的吸附率和解吸率,考察不同树脂对桤叶唐棣花色苷的吸附和解吸情况。
(1)
(2)
式中:A为吸附率(%);Co为花色苷溶液初始质量浓度(g/L);Ce为树脂吸附平衡时,抽滤液中花色苷质量浓度(g/L);D为解吸率(%);Cd为解吸液中花色苷质量浓度(g/L);Vd为解吸液体积(mL);Vi为花色苷溶液体积(mL)。
(2)吸附时间对吸附率的影响:精确称取筛选出的2种大孔树脂各0.5 g,置于具塞锥形瓶中,各加入20 mL质量浓度为0.125 g/L花色苷溶液,于25 ℃、100 r/min的振荡器中振荡,每隔1 h吸取2 mL,测定花色苷的质量浓度并计算吸附率,考察吸附时间对树脂吸附效果的影响。
(3)上样质量浓度对吸附率的影响:精确称取5份XDA-8型大孔树脂各0.5 g,置于具塞锥形瓶中,各加入20 mL质量浓度分别为0.050、0.100、0.150、0.200、0.250 g/L的花色苷提取液,于25 ℃、100 r/min的振荡器中振荡4 h,抽滤,测定滤液中花色苷的质量浓度,计算吸附率,以确定最佳上样质量浓度。
(4)上样液pH值对吸附率的影响:精确称取5份XDA-8型大孔树脂各0.5 g,置于具塞锥形瓶中,分别加入pH=1~5、质量浓度为0.100 g/L花色苷溶液各20 mL,于25 ℃、100 r/min的恒温振荡器中振荡4 h,抽滤,测定滤液中花色苷的质量浓度,计算吸附率,以确定最佳上样pH值。
大孔树脂的动态吸附—解吸试验。
(1)上样流速的试验分析:称取4份等量的预处理后的大孔树脂分别湿法装柱,装柱体积为36 mL,去离子水平衡4柱体积后,按不同流速分别将pH=2、质量浓度为0.100 g/L的花色苷溶液通入树脂柱,流出液每10 mL收集一管并测定花色苷质量浓度,当达到泄漏点时停止进样,考察不同上样流速对树脂吸附效果的影响。
吸附量=(上样质量浓度×上样体积-流出液质量浓度×流出液体积)/树脂质量。
(3)
(2)洗脱流速的试验分析:称取3份预处理后的大孔树脂分别湿法装柱,装柱体积为36 mL,去离子水平衡4柱体积后,均按2柱体积/h的流速向层析柱中通入pH=2、质量浓度0.100 g/L的花色苷溶液300 mL,然后分别以不同的流速用去离子水冲洗4柱体积,30%、50%、70%、90%乙醇溶液各冲洗4柱体积,分步收集乙醇洗脱部分的流出液,按公式(4)、(5)计算花色苷的回收率和纯度,将各洗脱梯度的回收率累计加和得到不同洗脱流速下的累计回收率,综合分析花色苷的纯度、回收率和累计回收率3项指标,确定不同洗脱流速对花色苷纯化的影响。
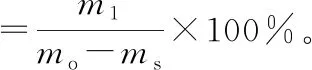
(4)

(5)
式中:m1为洗脱液中花色苷的总质量(mg);mo为通入树脂柱中的花色苷总质量(mg);ms为水洗液中花色苷总质量(mg);C为花色苷质量浓度(g/L);V为花色苷溶液体积(mL);md为花色苷冻干粉的质量(mg)。
1.3 桤叶唐棣花色苷的成分鉴定
采用超高效液相色谱串联三重四极杆质谱联用技术对纯化样品1进行分析鉴定。
UPLC条件:设备为WATERS UPLC ACQUITY。色谱柱为ACQUITY UPLC BEHC18色谱柱(100 mm×2.1 mm,1.7 μm);柱温50 ℃;流动相为0.2%甲酸水溶液(A)—甲醇(B),A为80%,B为20%;进样量为20 μL;流速为0.25 mL/min;检测波长为520 nm。
质谱条件:设备为MICROMASS Quattro Premier XE。电喷雾离子源,质谱采用正离子扫描方式,质量扫描范围质核比为50~500,毛细管电压3.10 kV,离子源温度110 ℃,干燥气温度380 ℃。
1.4 抗氧化能力的测定
分别检测了纯化样品1的还原能力(普鲁士蓝法[18]),DPPH自由基清除能力(比色法[19])和·OH自由基清除能力(邻二氮菲-Fe2+法[20])。
1.5 抑菌能力的测定
以大肠杆菌、金黄色葡萄球菌、枯草杆菌为供试菌株,将活化后的菌株配制成体积为105~106CFU/mL的菌悬液[21],采用滤纸片法[22]测定质量浓度为1.000、0.500、0.250、0.125 g/L的纯化样品1水溶液对各菌株的抑菌圈大小,采用二倍稀释法[23]测定纯化样品1对各菌株的最低抑菌浓度(MIC)。
2 结果与分析
2.1 桤叶唐棣花色苷的分离纯化
2.1.1 大孔树脂的静态吸附—解吸试验
大孔树脂的筛选结果。相同试验条件下,10种树脂对桤叶唐棣花色苷的吸附、解吸效果见表1所示。

表1 不同大孔树脂对花色苷的吸附率和解吸率
大孔树脂的极性是影响其吸附性的重要因素,如果树脂与化合物的极性越接近,二者间所产生的范德华力和氢键作用越强,大孔树脂对待纯化物的选择性吸附性能越强,分离效果越好,但若化合物与树脂形成死吸附,又会很难被洗脱下来,因此,分别选择了极性HB-16、XDA-8,中等极性XDA-1600、HB-1600、HP2MGL,弱极性AB-8、XAD-7HP、LSA-10和非极性X-5、D-101共10种大孔树脂,同时考察各树脂对样品的吸附与解吸情况。由表1可以看出,不同类型的树脂对花色苷的吸附程度不同,吸附率最高的是XDA-8型树脂,为(85.2±1.63)%,其次是树脂HB-16,为(82.1±1.75)%;而从各种树脂的解吸情况来看,树脂XDA-7HP和HP2MGL解吸效果最好,解吸率分别为(81.3±2.16)%和(78.3±1.29)%,但两种树脂对桤叶唐棣花色苷的吸附能力较差,无法达到理想的分离效果,而HB-16型树脂的解吸率仅次于二者,为(77.7±1.57)%,XDA-8再次之,解吸率为(75.8±1.66)%。综合考虑,筛选出XDA-8型和HB-16型两种大孔树脂进行吸附时间的试验分析。
吸附时间对吸附率的影响。时间对两种大孔树脂吸附效果的影响见表2所示。从表2可以看出,XDA-8型大孔树脂对桤叶唐棣花色苷的吸附饱和速率相对较快,在吸附4 h后基本达到平衡,吸附率为(84.7±1.92)%,之后再延长时间,吸附率基本保持不变,分析其原因,可能是由于XDA-8型大孔树脂具有高比表面活性,且所含的酯基基团与桤叶唐棣花色苷中的酚羟基极易形成氢健,因而表现出较好的吸附性能;而HB-16型大孔树脂随着时间的延长,吸附率逐渐增大,吸附8 h后仍有继续增加的趋势,吸附平衡耗时较长,分离纯化效率低,不适合于生产实际应用。因此,优选出XDA-8型大孔树脂作为分离纯化桤叶唐棣花色苷的最佳树脂。

表2 吸附时间对树脂吸附效果的影响
上样质量浓度对吸附率的影响。XDA-8型大孔树脂对桤叶唐棣花色苷的吸附效果还受样品质量浓度的影响。在花色苷质量浓度0.05~0.25 g/L内,随着质量浓度的增加,其在XDA-8型大孔树脂上的吸附率先增大后减小。当桤叶唐棣花色苷质量浓度为0.100 g/L时,XDA-8型大孔树脂吸附率达到最大值,为(85.9±2.01)%,之后再继续增加样品浓度,树脂吸附率不升反降,这是由于上样质量浓度过高时,达到吸附饱和的树脂无法继续吸附样液中过量的花色苷,致使吸附率迅速下降,而且样品质量浓度越高,所含杂质也越多,容易堵塞树脂孔径,导致吸附效果不佳。因此,确定适宜的上样质量浓度为0.100 g/L。
上样pH值对吸附率的影响。pH值的变化会导致花色苷的溶解性和极性发生改变,而在酸性环境中,花色苷中的酚羟基电离减少,使其多以分子形式存在,稳定性好[24],更有利于XDA-8型大孔树脂对其吸附。通过试验分析发现,在pH=1~5内,随着pH值的增加,桤叶唐棣花色苷在XDA-8型大孔树脂上的吸附率先增加后减小。当花色苷溶液pH=2.0时,吸附率最高,为(87.3±2.11)%。因此,确定适宜的上样pH值为2.0。
2.1.2 大孔树脂的动态吸附—解吸试验
上样流速的试验结果。树脂纯化过程中,当流出液质量浓度为上样液质量浓度10%左右时,认为树脂的吸附量已达到饱和,此时称为泄露点。从表3可以看出,上样流速1柱体积/h的泄露点出现最晚,当流出液体积为(370±2.1)mL时树脂吸附达到饱和,吸附量为(26.24±0.39)mg/g,虽然吸附效果是所有试验组中最好的,但上柱用了(612±3.5)min,耗时过长,是2柱体积/h的2.7倍,吸附量却仅比2柱体积/h多20.88%,而吸附时间越长越易出现死吸附现象,影响后面大孔树脂的洗脱[25];上样流速2柱体积/h的吸附量仅次于1柱体积/h,为(20.76±0.27)mg/g,上柱时间(225±1.3)min<4 h,是3柱体积/h的1.8倍,但吸附量比3柱体积/h高出51.11%;上样流速3柱体积/h和4柱体积/h的漏点出现较早,但吸附量皆较低,分别为10.15±0.44、8.39±0.34,可见过快的上样速度会使花色苷未被充分吸附就流出了层析柱,达不到较好的吸附分离效果。综合考虑纯化效率和树脂吸附饱和等方面的因素,选择适宜的上样流速为2柱体积/h。

表3 不同上样流速对树脂吸附效果的影响
洗脱流速的试验结果。由表4可知,在流速4柱体积/h条件下,70%乙醇洗脱梯度所得花色苷纯度最高,为40.48%,但该梯度花色苷回收率较低,仅为8.12%,无实际应用价值,所以不能作为最佳洗脱条件;而流速3柱体积/h、50%乙醇洗脱梯度所得的花色苷纯度是39.55%,回收率为40.13%,花色苷的纯度和回收率都较好,且该洗脱流速的花色苷累计回收率为91.16%,是所有流速中最高的。因此,本实验选用3柱体积/h的流速作为最佳洗脱流速。
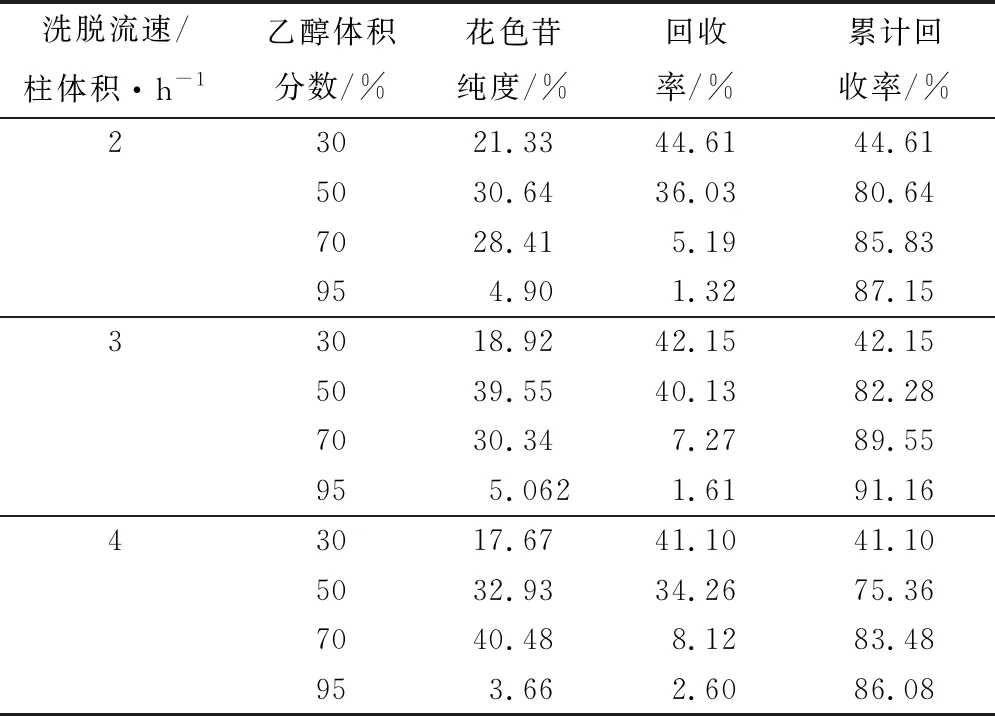
表4 不同洗脱流速的影响
2.1.3 桤叶唐棣花色苷纯化物的制备
将预处理后的XDA-8型大孔树脂湿法装柱,去离子水平衡4柱体积后,将pH=2、质量浓度为0.100 g/L的花色苷溶液按2柱体积/h的流速通入大孔树脂柱,待流出液达到泄露点时停止进样,以3柱体积/h的流速用去离子水冲洗4柱体积,30%、50%、70%、90%乙醇溶液各冲洗4柱体积,分步收集各梯度的洗脱液,将50%乙醇洗脱部分在低于40 ℃条件下旋转蒸发除去乙醇,浓缩液冷冻干燥24 h,制得纯化样品1。
2.2 超高效液相色谱三重四极杆质谱联用结果
纯化样品1在520 nm处的液相色谱图如图2所示。在520 nm检测波长下,纯化样品1主要含有3种组分,出峰时间集中在8~16 min内,其中保留时间在8.92和15.82 min为纯化样品1的两种主要组分,保留时间在11.12 min的组分含量相对较少。3种组分的质谱图见图3所示。
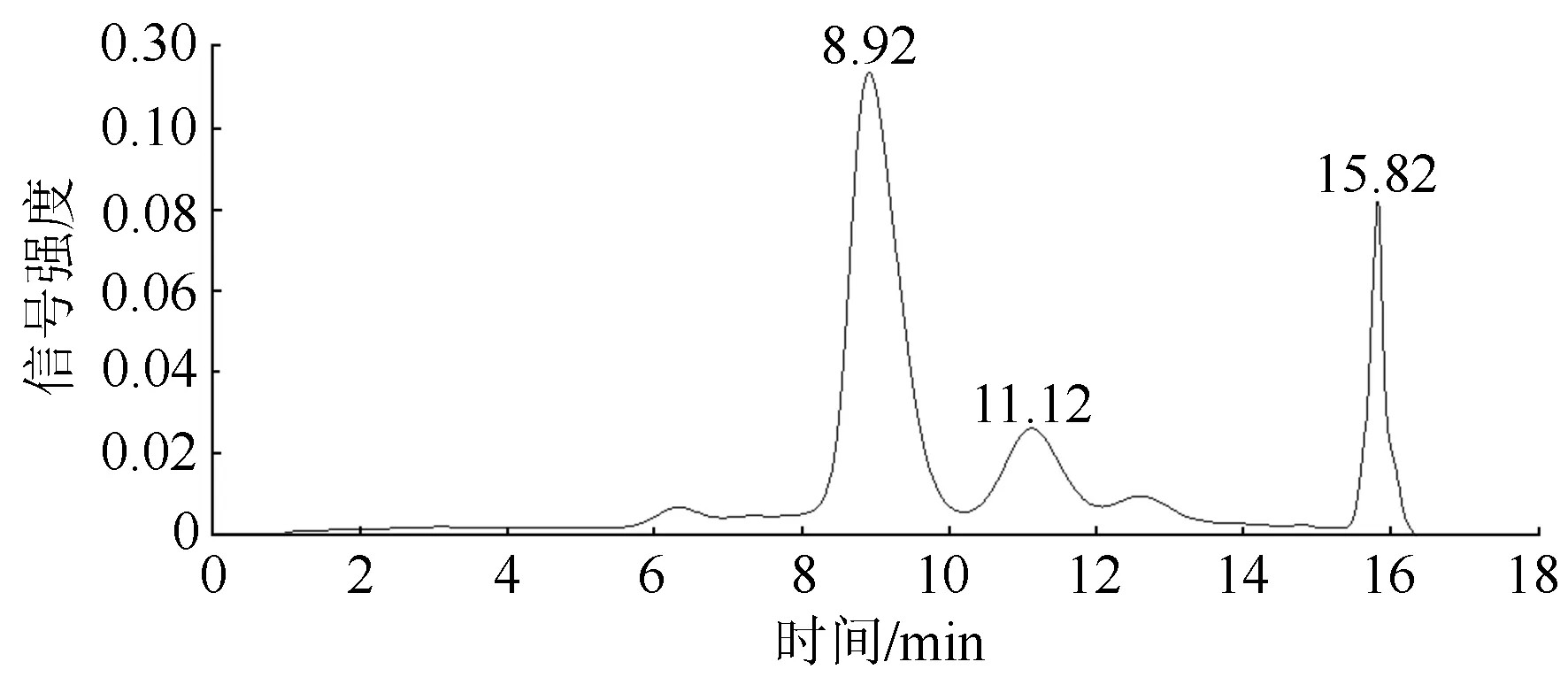
图2 纯化样品在520 nm处的色谱图
由图3可知,保留时间8.92 min组分的质谱图中,检测到了矢车菊色素的特征离子质核比287[26],且其母离子质核比449.4与子离子质核比287相差162,是失去1分子葡萄糖苷的相对分子量,由此初步推断此化合物为矢车菊素-3-O-葡萄糖苷[27];保留时间11.12 min组分的母离子质核比465.4,在能量碰撞下失去1分子葡萄糖苷得到子离子质核比303.2[M-162]+,而质核比303.2为飞燕草素的特征离子,依此初步推断此化合物为飞燕草素-3-葡萄糖苷[28];保留时间15.82 min组分的子离子质核比331.3是锦葵素的特征离子,与母离子质核比493.4相差162,说明母离子在能量碰撞下脱去了1分子葡萄糖苷,因此初步推测此化合物为锦葵素-3-葡萄糖苷[26]。
2.3 桤叶唐棣花色苷的抗氧化活性
2.3.1 还原能力
由表5可知,在测定质量浓度范围内(5~15 mg/L),纯化后的桤叶唐棣花色苷还原能力远高于同质量浓度下的维生素C,且还原能力与质量浓度呈明显的量效关系,即随着质量浓度的增大,还原能力也随着增强。分析原因可能是因为桤叶唐棣花色苷纯化样品中矢车菊素-3-葡萄糖苷质量分数最高,而矢车菊素B环含有2个羟基,故具有较强的抗氧化活性[29]。
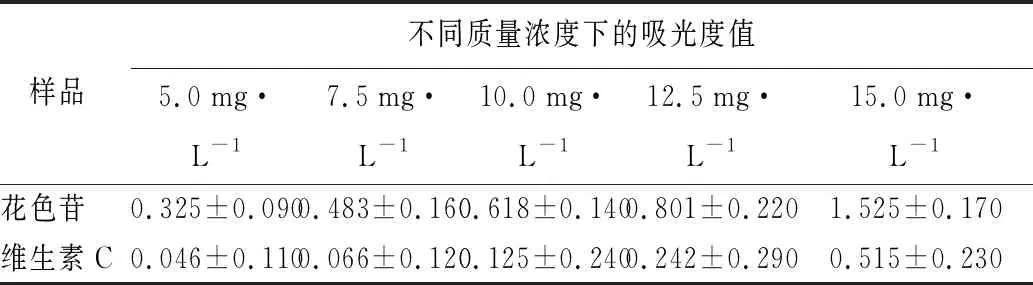
表5 纯化样品的还原能力
2.3.2 DPPH·的清除能力
由表6可以看出,在测定质量浓度5~100 mg/L范围内,花色苷清除DPPH·的能力要远高于同质量浓度的维生素C。当花色苷质量浓度小于25 mg/L时,随着花色苷浓度的增加,DPPH·清除率随之急剧增大;当花色苷质量浓度大于25 mg/L时,DPPH·清除率仍随花色苷质量浓度的增加而增大,但增加趋势趋于缓,当质量浓度为100 mg/L时,DPPH·清除率可达到(97.4±2.04)%。
2.3.3 ·OH的清除能力
在氧自由基中,·OH最为活泼,能够迅速破坏生物体细胞内的DNA等物质,因此危害极大。由表7可以看出,桤叶唐棣花色苷具有较强的清除·OH能力,·OH清除率要高于同质量浓度的Vc,在测定质量浓度范围内(5~50 mg/L),随花色苷质量浓度增加,其清除·OH能力逐渐增大,在花色苷质量浓度为50 mg/L时,·OH清除率可达到(95.6±1.74)%。
2.4 桤叶唐棣花色苷的抑菌活性
2.4.1 桤叶唐棣花色苷的抑菌圈
纯化后的桤叶唐棣花色苷的抑菌活性见表8所示。

表8 桤叶唐棣花色苷对3种供试菌的抑菌圈大小
从表8可以看出,纯化后的桤叶唐棣花色苷对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌均有一定的抑制作用,由抑菌圈直径大小可分析出其对金黄色葡萄球菌的抑制能力最强,大肠杆菌次之,对枯草芽孢杆菌的抑制能力相对较弱。在测定质量浓度范围内(0.125~1.000 g/L),抑菌效果随着花色苷质量浓度的增加而增大,当花色苷质量浓度为1 g/L时,对3种供试菌株的抑菌圈直径均达到最大值,其中对大肠杆菌的抑菌圈直径为(15.2±0.15)mm,对枯草芽孢杆菌的抑菌圈直径为(14.9±0.12)mm,对金黄色葡萄球菌的抑菌圈直径为(16.7±0.19)mm。
2.4.2 桤叶唐棣花色苷的最低抑菌质量浓度(MIC)
从表9可以看出,纯化后的桤叶唐棣花色苷对金黄色葡萄球菌的最低抑菌浓度为0.125 g/L,对大肠杆菌的最低抑菌浓度为0.250 g/L,对枯草芽孢杆菌的最低抑菌浓度为0.500 g/L。虽然针对不同的菌种,桤叶唐棣花色苷纯化物的抑制效果略有不同,但均可起到抑制作用,大肠杆菌属于革兰氏阴性菌,枯草芽孢杆菌与金黄色葡萄球菌属于革兰氏阳性菌,说明桤叶唐棣花色苷对细菌具有一定的抑制作用。

表9 桤叶唐棣花色苷对3种供试菌的最低抑菌质量浓度
3 结论
利用XDA-8型大孔树脂分离纯化了桤叶唐棣花色苷,确定最佳的纯化工艺条件为:将pH=2、质量浓度为0.100 g/L的花色苷溶液按2柱体积/h的流速通入XDA-8型大孔树脂柱,待树脂吸附饱和后,先通入去离子水冲洗4柱体积,然后按3柱体积/h的流速分别用30%、50%、70%、90%乙醇溶液各冲洗4柱体积,分步收集各梯度的洗脱液。其中50%乙醇洗脱部分的花色苷纯度可达到39.55%,经分析检测,鉴定出其主要成分为矢车菊素-3-O-葡萄糖苷、飞燕草素-3-葡萄糖苷和锦葵素-3-葡萄糖苷。通过抗氧化试验,确定桤叶唐棣花色苷纯化物具有较好的抗氧化性,其还原能力、清除DPPH自由基和OH自由基能力均优于同质量浓度的维生素C。而经过抑菌性实验,发现桤叶唐棣花色苷对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌皆可起到一定的抑菌效果。本研究结果能为桤叶唐棣花色苷的产品开发提供理论依据,具有一定的研究价值及意义。今后可以利用更精细的分离手段对桤叶唐棣花色苷组分进行精制,结合UPLC-MS和NMR等检测手段进行结构解析,开展更深入的研究。
