共同性外斜视家系和散发患者突变基因分析
2021-02-08公慧敏周占宇刘桂香
公慧敏 周占宇 刘桂香
作者单位:1青岛市市立医院眼科中心 266011;2青岛大学附属医院眼科 266003
斜视是一种眼外肌运动平衡功能失调性疾病,分为共同性斜视和非共同性斜视。其中共同性外斜视最为多见,尤其在亚洲地区患病率为1%[1,2],严重影响患者视力、双眼立体视功能[3]。共同性外斜视的病因涉及到遗传与环境等多个因素。斜视的遗传性早在希波克拉底时代就开始被学者们关注,近年来许多国内外学者进行了大量基因水平的研究,发现了一些可能的敏感位点,但至今仍然缺乏精确的基因定位[4]。随着各种测序技术的进步,特别是全外显子组测序(Whole-exome sequencing,WES)技术的兴起,为共同性外斜视致病基因的研究提供了契机。WES是一种利用序列捕获技术将全基因组外显子捕获并富集,然后进行高通量测序的基因组分析方法。它是一种更高效的测序策略,能够直接发现与蛋白质功能变异相关的遗传变异,大大促进了新致病基因的发现,并且相对于全基因组测序成本更低,目前已经广泛应用于寻找与各种复杂疾病相关的致病基因和易感基因的研究中。
本研究对一个共同性外斜视家系的6位成员外周血DNA进行全外显子组测序,通过生物信息学数据分析,筛选共同性外斜视可能的致病基因,针对筛选出的突变基因设计引物,使用Sanger测序在散发患者中验证突变。以期为共同性外斜视致病基因的研究,乃至为预防及治疗疾病提供理论依据,进而为提高孕期胎儿的诊断水平、及早排查出可能携带有致病基因的患儿,以及早期对致病基因进行干预,从而为提高人口素质、优生优育的目标提供思路。
1 对象与方法
1.1 对象
实验研究。本研究选取一个3代6人的共同性外斜视家系,家系中先证者为7岁女童,其与其母亲均为恒定性外斜视患者,其余家庭成员均无斜视。家系图见图1,2例患者临床资料见表1。另外选取共同性外斜视散发患者180例,其中男80例,女100例,年龄3岁10个月~64(27.9±1.6)岁。其中间歇性外斜视患者113例,恒定性外斜视患者67例。150例正常对照者,其中男70例,女80例,年龄4~60(29.8±1.8)岁。

图1.共同性外斜视家系图谱□:正常男性;○:正常女性;●:女性患者;:先证者(女)Figure 1.The family tree of the comitant exotropia pedigree.□:Normal male; ○:Normal female; ●:Female patient;:Proband(Female).
共同性外斜视诊断由青岛大学附属医院眼科2名副主任以上专业医师共同作出。研究中所有对象(不满18岁的成员,由其法定监护人)签署知情同意书。本研究的所有对象均来自中国山东省青岛市,均为中国汉族人群。本研究经青岛大学附属医院伦理委员会批准(批号:QYFY WZLL 25717)。本研究遵循赫尔辛基宣言。
1.2 方法
1.2.1 基因组DNA提取 抽取家系成员外周血5~6 ml,使用中国天根生化科技有限公司DNA提取盒获得样本DNA。
1.2.2 全外显子组测序 取2 μg基因组DNA,使用Bioruptor将其机械打断,使片段主带在200 bp附近,回收150~250 bp的DNA片段,对其进行末端修复及磷酸化,3'端加A尾后连接测序接头,纯化连接产物后进行PCR扩增富集,将扩增后的产物纯化得到DNA预文库。取一定量预文库与Sureselect Human All Exon v5外显子捕获试剂盒中的探针做杂交,之后使用带链霉素的磁珠捕获基因上的外显子。将未杂交上的片段洗脱掉,将杂交产物回收后行PCR扩增富集,回收扩增产物即为终文库。对文库进行质控,对合格的外显子序列使用Illumina Hiseq 4000测序仪测序,得到初始数据(外显子测序流程见图2)。

表1.共同性外斜视家系中2例患者基本资料Table 1.The basic information of the two patients in the concomitant exotropia pedigree
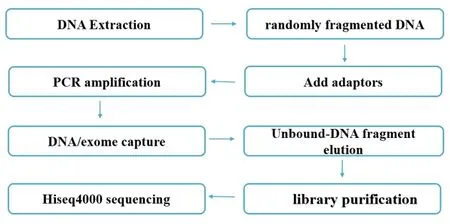
图2.外显子测序流程示意图Figure 2.The flow diagram of exome sequencing.
1.2.3 生物信息分析 用SeqPrep和Sickle对外显子测序所得原始数据进行质控。用Bwa软件将质控后数据比对到参考基因组hg19上,得到Bam格式的原始比对结果。对结果使用Samtools排序。Picard标记重复Reads生成最终Bam文件。利用重复标记过的比对结果进行覆盖度、测序深度和外显子区域捕获率的统计。GATK软件预测SNV和Indel。过滤掉单核苷酸变异数据库dbSNP138和千人基因组工程数据库1000 genome中的高频(MAF>0.01)位点,保留低频变异位点。家系分析筛选,保留与疾病共分离的变异位点。使用Oncotator v1.5.3.0,Annovar,SIFT和Polyphen-2等工具对筛选的位点进行功能注释,保留至少2个以上软件评估为有害(Damaging)的位点(流程见图3)。
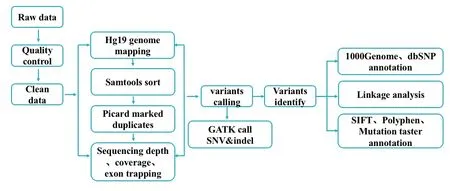
图3.生物信息数据分析基本流程Figure 3.The flow diagram of the bioinformatics analysis.
1.2.4 Sanger测序 针对外显子测序筛选到的候选基因PAX3对纳入本研究的所有成员进行Sanger测序。首先利用Primer 3.0在线软件设计PCR引物对:F 5'-TGTGGTCTCTGTCCCAAGATGTA-3',R 5'-GGAGGAAAATAAAAAGCAAAGAAC-3'。PCR扩增,制作测序模版,对纯化后的PCR产物进行测序反应,酒精法纯化测序反应产物,反应产物在ABI 3500型基因分析仪上进行测序分析。
2 结果
2.1 外显子测序及生物信息分析结果
外显子组测序的数据产出及数据统计表见表2。GATK软件预测突变,共发现525 787个单核苷酸突变位点。过滤掉1 000 G及dbSNP138数据库中的高频变异位点后得到1 340个变异位点,通过家系分析保留与疾病共分离的变异位点得到328个变异位点,多种注释工具对所得变异进行功能注释,最终得到23个候选基因(注释结果见表3)。按照2015年版《美国医学遗传学标准和指南》[5]对突变位点的有害性进行评估,搜索文献分析变异与共同性外斜视疾病的相关性,最终认为PAX3基因的c.G434T突变(p.R145L)可能是致病突变。这一突变位于PAX3基因高度保守的PD结构域。
2.2 Sanger测序结果
家系中2例患者均携带PAX3基因的c.434G>T杂合错义突变,家系正常成员均未检测到此突变,突变在家系中与疾病共分离。180例散发患者中检测到27例患者发生PAX3c.434G>T突变。在150例与家系无血缘关系的正常对照组中,均未发现此突变。正常人及患者Sanger测序图见图4。
3 讨论
斜视的家族遗传性早在希波克拉底时代就已经被注意到[6],近年来国内外的许多学者也致力于共同性外斜视遗传学的病因研究。在临床研究中发现,约30%的斜视患者有阳性家族史[7],普通人群中斜视的患病率为3%,而斜视患者子女的患病率高至13%[8],斜视患者的同卵双胞胎的患病率高达73%。各种族的患病率也明显不同,白种人患病率较高为2.7%,而非洲人为0.6%[9],以上研究充分证实了斜视的遗传基础。
近年来,为了寻找共同性外斜视的致病基因,国内外学者对共同性外斜视家系进行了研究,提出了一些敏感位点。日本学者以55个共同性外斜视家系为研究对象,使用全基因MOD评分法分析,发现了染色体4q28.3和7q31.2为敏感位点,并且有来源于父亲和母亲的遗传现象[10]。Zhang和Matsuo[11]对日本的共同性外斜视家系进行基因学分析,筛选出MGST2和WNT2为可能的敏感基因。刘桂香等[12]
选择共同性外斜视家系进行研究,发现了ARIX基因突变,ARIX基因位于染色体1lql3上,由3个外显子组成,编码1个同源结构域翻译因子,对于脑干运动神经元亚群的生存和传代起到重要作用,并可能参与交感神经兴奋和眼位控制,因此认为它的突变可能导致斜视发生,但未在广泛的人群中进行验证。但随后也有学者又对一个家族性共同性外斜视家系研究,并没有发现患者有ARIX基因的突变[13]。

表2.共同性外斜视家系外显子测序原始数据及统计结果Figure 2.The raw data and statistical results of exome sequencing in concomitant exotropia pedigree

表3.共同性外斜视家系候选基因位点及主要注释结果Figure 3.The candidate gene sites and main annotated results in the concomitant exotropia pedigree

图4.PAX3基因c.434G>T错义突变Sanger测序图A:正常人Sanger测序结果序列;B:先证者G434T突变Sanger测序结果序列。红色箭头所指为正常位点,蓝色箭头所指为突变位点Figure 4.Sanger sequencing of c.434G>T missense mutation in PAX3 gene.A:Sanger sequencing results of normal people.B:Sanger sequencing results of the proband.The red arrow indicates the normal site and the blue arrow indicates the mutation site.
因此,迄今为止,确定共同性外斜视的致病基因仍然面临巨大的挑战。外显子测序技术的广泛应用为寻找共同性外斜视的致病基因提供了契机。本研究选取了一个3代6人的共同性外斜视家系进行病因学研究,取家系成员外周血进行全外显子组测序后,对读取的变异进行生物学数据分析,过滤掉dbSNP138及1000 genome数据库中的高频率(MAF>0.01)变异,保留罕见的低频变异。去除在家系测序样本中与疾病不共分离的变异,保留共分离变异位点。对多个数据库进行过滤,保留外显子区的非同义突变,参照2015年版《美国医学遗传学标准和指南》并结合文献对变异进行判定。最终认为PAX3基因的c.434G>T可能是共同性外斜视致病相关突变。PAX基因是一个进化上较为保守的基因家族,普遍存在于自然界各物种中。PAX3作为PAX基因家族中的一员,是一种在胚胎发育过程中调控各组织器官分化的重要转录调控因子[14,15]。PAX3蛋白通过与下游靶基因的DNA片段结合并激活靶基因的转录[16]来行使其转录调控功能。
人类PAX3基因于细胞核中表达,位于2号染色体(2q36.1),共含有8个外显子,全长99 110 bp,编码的蛋白质含有479个氨基酸,相对分子量为52 968 Da。PAX3蛋白有3个重要的功能结构域,分别为:配对盒结构域(Paired box domain,PD,34~161位氨基酸)、同源异型类结构域(Homeobox domain,HD,220~277位氨基酸)、高度保守的锌肽序列和富含丝氨酸-苏氨酸-脯氨酸的转录激活区域(Transcription activation domain,TA,278~479位氨基酸)[17-19],PD是PAX3重要的功能结构域,PAX3即通过PD识别并结合下游靶基因的DNA序列,从而激活靶基因的转录[20],PD结构域除行使与下游靶基因DNA结合的功能外,同时还可以促进PAX3蛋白与其他蛋白的相互作用,因此PD结构域的功能几乎可以影响PAX3蛋白的全部功能,发生在此区域的变异可能会严重影响蛋白功能。本研究的外显子测序发现的PAX3基因c.G434T突变是一杂合错义突变,其434位上的碱基G变为碱基T,这一突变正是位于PAX3保守的PD结构域中。新发突变保留了PAX3各结构域的完整性,因此推测其突变蛋白R145L与野生型PAX3蛋白具有相同的亚细胞定位。突变蛋白R145L,其145位带正电的极性精氨酸变为了非极性的亮氨酸,推测氨基酸极性的改变可能会引起蛋白质二级结构的变化,进一步影响蛋白的功能。基因功能预测软件Polyphen2等也预测到此突变很可能影响了蛋白质的结构和功能,是有害突变,但具体影响的程度还需进一步实验验证。
PAX3基因是生肌调控中重要的上游基因[21],它在骨骼肌的形成过程中发挥了不可替代的作用[22,23]。有研究表明,当生肌前体细胞移行到肌芽等目的地并且表达肌肉分化因子、进一步开始分化的时候,PAX3的表达开始下调[24]。如果PAX3的表达水平仍然继续维持在原水平,生肌前体细胞的分化将被阻止,而不能达到完全分化状态[25]。PAX3基因缺失时,骨骼肌的发生、发育将被阻止[26-29]。有学者运用cDNA微阵分析导入了PAX3基因的NIH3T3细胞的基因表达谱,来进一步阐明PAX3在骨骼肌发生中的作用,研究发现PAX3基因激活了大量转录因子如MYOK、MYOG、SIX1、SLUG与IGF2及其受体IGFBP5,而这些因子均是与骨骼肌发生密切相关的基因[30-32]。此外,Kozawa等[33]发现来自转基因小鼠的成肌细胞表达PAX3/FOXO1蛋白就不能完成成肌分化。这些发现均表明PAX3基因与骨骼肌的发生和功能密切相关。眼外肌属于骨骼肌,它的发生发育也应受到PAX3的调控,结合我们的发现推测PAX3基因的突变可能导致蛋白质功能变化,眼外肌的发生或者发育过程因此受阻,这可能是参与斜视发生的因素之一。
全外显子组测序筛选出的除PAX3之外的22个候选基因将是我们下一步深入研究的对象。虽然我们发现PAX3基因c.G434T突变可能是共同性外斜视的致病突变之一,但PAX3基因突变的具体致病机制,突变所导致的蛋白表达及功能变化、突变对下游因子的影响等仍然需要进一步的探索。
利益冲突申明本研究无任何利益冲突
作者贡献声明公慧敏:收集数据,参与选题、设计及资料的分析和解释;撰写论文;根据编辑部的修改意见进行修改。周占宇:参与选题、设计和修改论文的结果、结论。刘桂香:参与选题、设计、资料的分析和解释,修改论文中关键性结果结论,根据编辑部的修改意见进行核修
