槲皮素对猪肠上皮细胞利用蛋白质的作用机制
2021-02-07姚佳颖毛彦军王杉杉应琳琳
姚佳颖 毛彦军 王杉杉 卢 涵 王 博 应琳琳 李 垚
(东北农业大学动物科学技术学院,哈尔滨150030)
饲料蛋白质利用率低已成为世界各国养猪业普遍存在的问题,不仅浪费蛋白质资源,还会因为过多氮排泄造成环境污染,添加饲料添加剂是提高饲料蛋白质利用的有效措施之一。本课题组前期研究证明,沙棘黄酮可提高肉鸡和蛋鸡蛋白质利用率[1],同时发现提高肉鸡蛋白质利用率与槲皮素激活雷帕霉素靶蛋白(target of rapamycin,TOR)信号通路有关[2]。而槲皮素是沙棘黄酮的主要成分,具有抗菌、消炎、抗病毒、抗氧化、免疫调节等多种活性[3-5]。此外,槲皮素还可以促进畜禽对其他营养物质的利用[2,6-7],这些结果均表明,饲粮添加黄酮类化合物是提高饲料蛋白质利用率的有效途径。然而关于槲皮素影响饲料蛋白质利用的机制研究尚不完善,特别是槲皮素对猪利用饲料蛋白质的作用机制研究仍属空白。因此,本研究以猪肠上皮细胞作为模型,研究槲皮素对猪肠上皮细胞利用蛋白质的作用机制,旨在为槲皮素在养猪生产中的应用提供科学依据。
1 材料与方法
1.1 试验仪器及材料
ELITE-300PLUS型基础电泳仪电源(美国Wealtec);5415C型高速冷冻离心机(德国Eppendorf);UV-2540分光光度计(日本SHIMAZDU);NanoDrop超微量紫外-可见光分光光度计(美国ThermoFisher);Yrdimes SW07D0567蛋白印迹仪(美国Wealtec);Li-COR Odyssey凝胶成像分析系统(美国Li-COR);ABI Prism 7500型实时荧光定量PCR仪(德国Roche)。
猪肠上皮细胞由中国科学院亚热带生态研究所印遇龙院士惠赠;DMEM/F12培养液购自Invitrogen公司;无支原体胎牛血清购自Gibco公司;槲皮素(纯度≥97%)、二甲基亚砜(DMSO)、双抗、磷酸盐缓冲液(PBS)皆购自美国Sigma公司;反转录试剂盒与荧光定量试剂盒皆购自中国大连TaKaRa公司;十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳试剂盒、全蛋白抽提试剂盒和Western blot检测试剂盒皆购自中国南京凯基生物科技发展有限公司;其他相关试验试剂均为国产分析纯。
1.2 试验方法
1.2.1 细胞培养
将复苏后的猪肠上皮细胞按1×105个/瓶接种于含有89% DMEM/F12、10%胎原血清和1%双抗培养液的25 mL培养瓶中,之后将细胞培养瓶置于二氧化碳恒温密闭式培养箱(37 ℃,饱和湿度、体积分数为5%)中进行连续传代培养。培养液每隔2 d更换1次,以确保细胞维持对数生长。收集对数生长期的细胞并消化分离后,按1×106个/mL的浓度以每孔2 mL接种到6孔板。将经过48 h培养的细胞分为6组,试验组分别添加含0.1、0.2、0.4、0.8、1.6 mg/L槲皮素的DMSO溶液,对照组添加0.2% DMSO,每组重复6孔。处理72 h后收集细胞以进行RNA的提取和蛋白质含量的测定。
1.2.2 蛋白质含量的测定
槲皮素处理72 h后,弃掉培养液并用PBS溶液清洗待测细胞2次。每孔加入200 μL放射免疫沉淀(RIPA)裂解液,离心(10 000 r/min,3 min)后取上清液。采用二喹啉甲酸(BSA)法,按照牛血清白蛋白试剂盒的说明制作标准曲线。将待测样品与工作液按100 μL/孔先后加入96孔板中,每个样品平行3次。立即混匀,于37 ℃水浴60 min后再冷却至室温,然后用酶标仪在562 nm处测定样品的吸光度,并根据标准曲线计算出样品的蛋白质含量。
1.2.3 实时荧光定量PCR检测
试验使用Trizol试剂提取受试细胞的总RNA,并用NanoDrop超微量紫外-可见光分光光度计测定提取的总RNA浓度和A260 nm/A280 nm的比值。RNA的完整性用1.2%琼脂糖变性凝胶电泳检测,确保出现5S、18S和28S rRNA这3条亮带。用0.1%焦碳酸二乙酯水调整所有样品的RNA浓度至200 ng/μL。按照反转录试剂盒说明将样品总RNA反转录为模板cDNA。使用ABI 7500荧光定量PCR仪和荧光定量试剂盒进行实时荧光定量PCR检测。内参基因为甘油醛-3-磷酸脱氢酶(GAPDH),试验采用2-ΔΔCt法计算目的基因mRNA的相对表达量。上海生工生物工程股份有限公司设计并合成所有引物,引物序列见表1和表2。
1.2.4 Western blot检测
用冰冷PBS溶液清洗细胞2次后移至预冷的离心管中,于冰上加入含有蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟(PMSF)混合物的冰冷裂解缓冲液。样品在4 ℃摇床振荡15 min后,12 000 r/min,4 ℃离心15 min,取得上清液即为全蛋白抽提物。取30 μg蛋白质样品,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转移至硝酸纤维素(NC)膜,将膜置于平皿中,5%脱脂奶粉封闭液进行封闭,封闭结束后用Tris-HCl缓冲液(TBST)清洗3次。将膜移至含有一抗的平皿中,置于4 ℃摇床振荡孵育过夜。次日,弃去一抗,经TBST清洗后加入用封闭液按1∶8 000比例稀释的二抗,室温振荡反应2 h,结束后用TBST清洗3次,按照电子化学发光法(ECL)试剂盒的说明书进行检测。GAPDH为内参。
1.3 数据统计分析
试验数据的单因素方差分析与Duncan氏多重比较检验由SPSS 20.0软件完成。Western blot检测结果的灰度分析使用Gel-Pro Analyzer 4软件完成,GraphPad Prism 5软件完成试验结果的柱状图绘制。试验结果用平均值±标准误表示,P<0.05为差异显著,P<0.01为差异极显著。
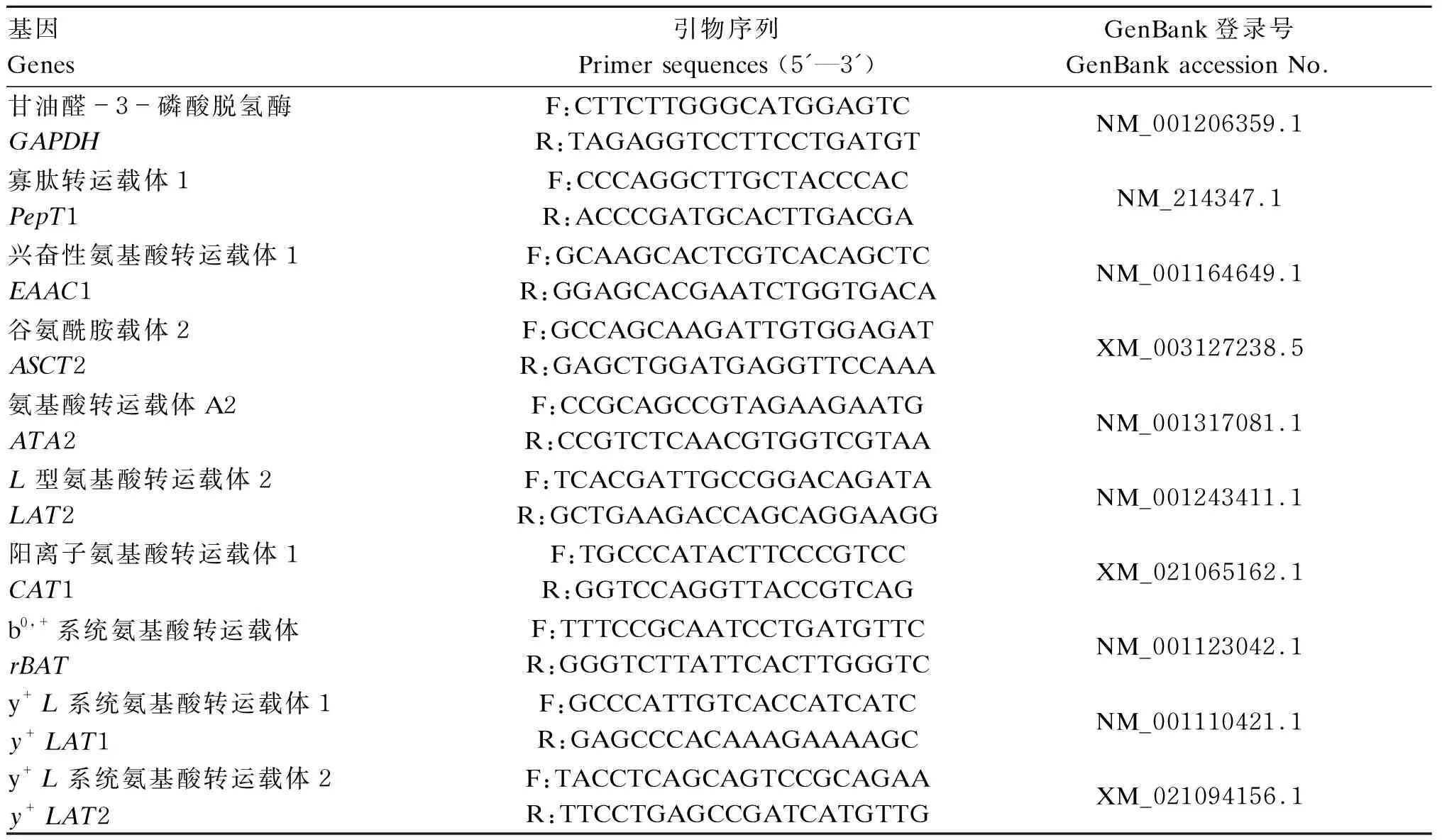
表1 氨基酸和小肽转运载体引物序列

表2 哺乳动物雷帕霉素靶蛋白信号通路相关信号分子的引物序列
2 结果与分析
2.1 槲皮素对猪肠上皮细胞蛋白质含量的影响
由表3可知,与对照组相比,0.4和0.8 mg/L槲皮素均极显著增加猪肠上皮细胞中蛋白质的含量(P<0.01)。
2.2 槲皮素对猪肠上皮细胞氨基酸和小肽转运载体mRNA相对表达量的影响
由表4可知,与对照组相比,1.6 mg/L槲皮素极显著提高细胞中兴奋性氨基酸转运载体1(EAAC1)、谷氨酰胺载体2(ASCT2)、氨基酸转运载体A2(ATA2)、L型氨基酸转运载体2(LAT2)、酸转运载体1(CAT1)、b0,+系统氨基酸转运载体(rBAT)、y+L系统氨基酸转运载体1(y+LAT1)、y+L系统氨基酸转运载体2(y+LAT2)和寡肽转运载体1(PepT1)mRNA相对表达量(P<0.01)。
2.3 槲皮素对猪肠上皮细胞mTOR信号通路相关基因mRNA相对表达量的影响
由表5可知,与对照组相比,0.4 mg/L槲皮素极显著降低结节性硬化复合物1(TSC1)和真核细胞翻译起始因子4A(eIF4A)mRNA相对表达量(P<0.01);0.8 mg/L可极显著增加猪肠上皮细胞mTOR和核糖体蛋白S6(RPS6)mRNA相对表达量并极显著降低TSC1 mRNA相对表达量(P<0.01);1.6 mg/L槲皮素极显著增加猪肠上皮细胞中mTOR、真核起始因子4E结合蛋白1(4E-BP1)、真核细胞翻译起始因子4E(eIF4E)、eIF4A、真核细胞翻译起始因子4B(eIF4B)和RPS6 mRNA相对表达量(P<0.01)。

表3 槲皮素对猪肠上皮细胞蛋白质含量的影响
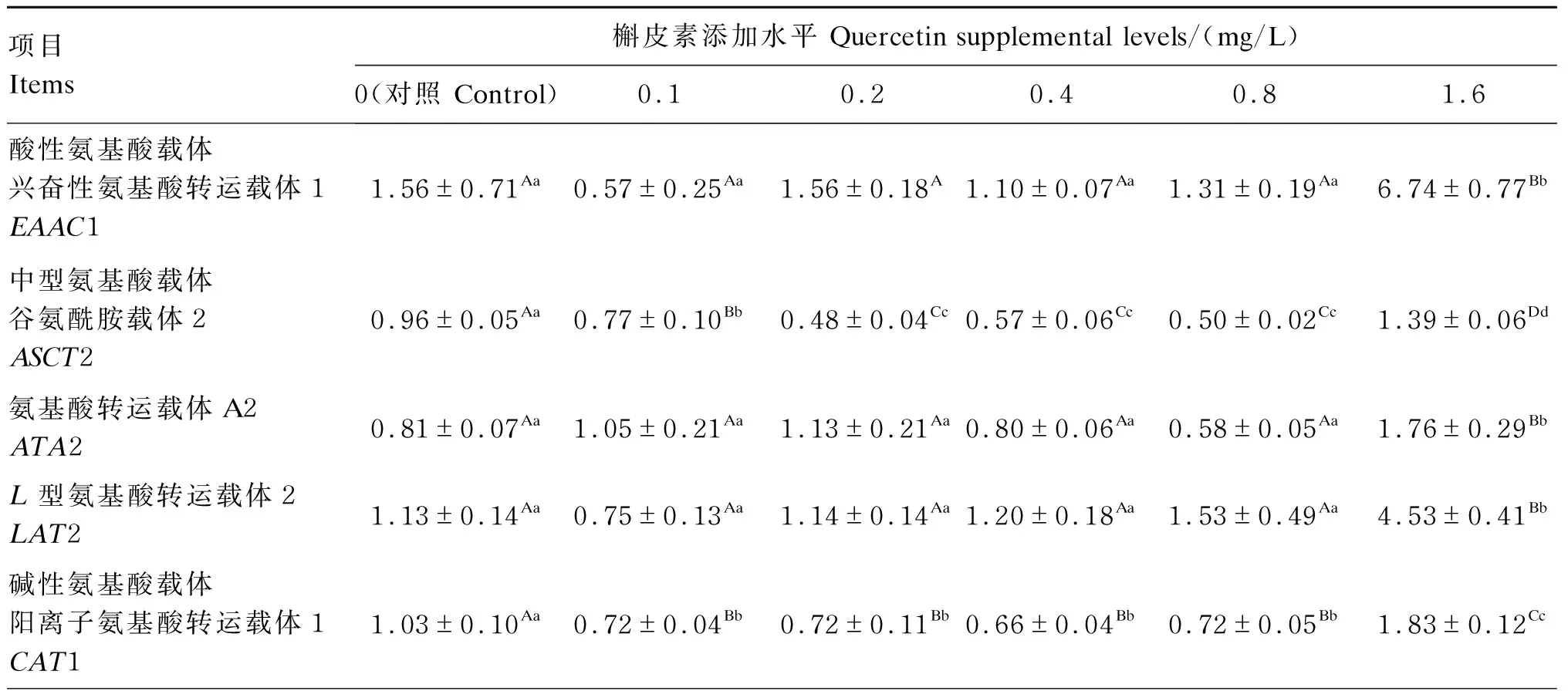
表4 槲皮素对猪肠上皮细胞氨基酸和小肽转运载体mRNA相对表达量的影响
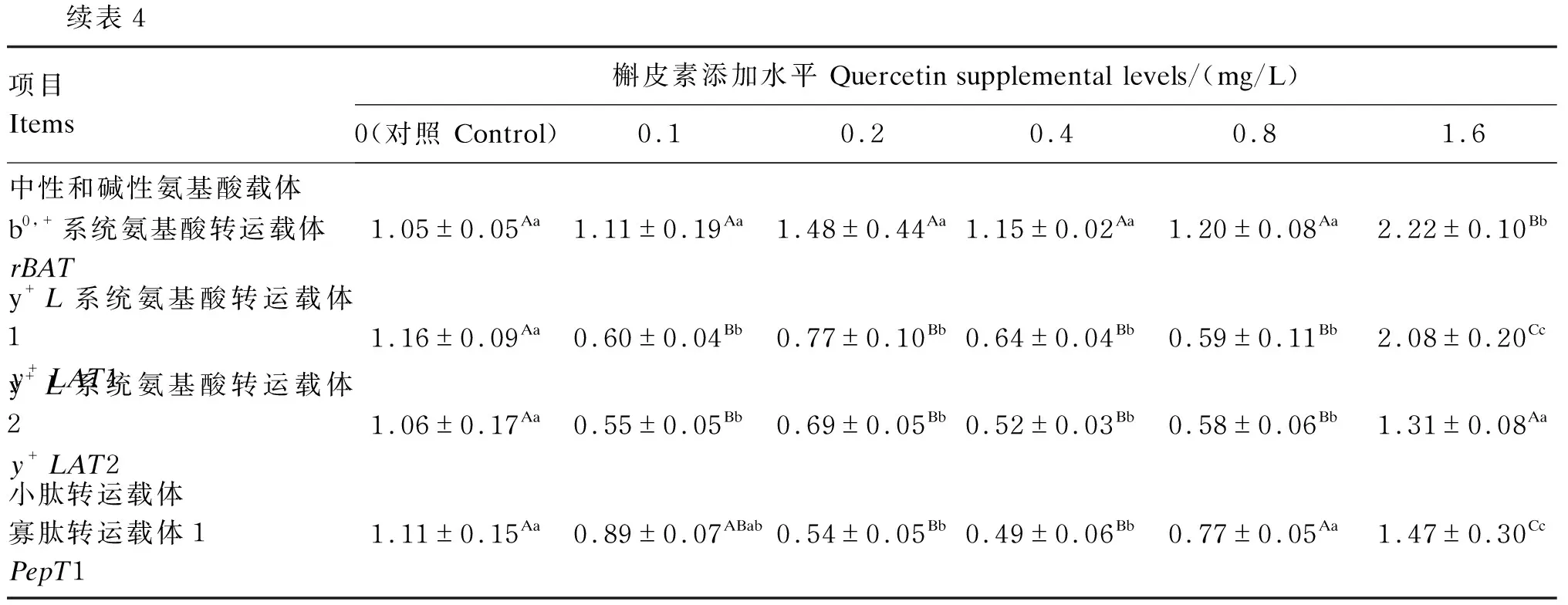
续表4项目Items槲皮素添加水平 Quercetin supplemental levels/(mg/L)0(对照 Control)0.10.20.40.81.6中性和碱性氨基酸载体b0,+系统氨基酸转运载体rBAT1.05±0.05Aa1.11±0.19Aa1.48±0.44Aa1.15±0.02Aa1.20±0.08Aa2.22±0.10Bby+L系统氨基酸转运载体1y+LAT11.16±0.09Aa0.60±0.04Bb0.77±0.10Bb0.64±0.04Bb0.59±0.11Bb2.08±0.20Ccy+L系统氨基酸转运载体2y+LAT21.06±0.17Aa0.55±0.05Bb0.69±0.05Bb0.52±0.03Bb0.58±0.06Bb1.31±0.08Aa小肽转运载体寡肽转运载体1PepT11.11±0.15Aa0.89±0.07ABab0.54±0.05Bb0.49±0.06Bb0.77±0.05Aa1.47±0.30Cc

表5 槲皮素对猪肠上皮细胞mTOR信号通路相关基因mRNA相对表达量的影响
为验证槲皮素处理对猪肠上皮细胞mTOR信号通路相关基因表达的影响,采用Western blot法检测mTOR、eIF4E、4E-BP1和eIF4A蛋白表达量。此外,根据槲皮素处理后细胞中mTOR信号通路相关基因的mRNA相对表达量结果,选择0.1和1.6 mg/L槲皮素进行检测。由图1可知,与对照组相比,0.1和1.6 mg/L槲皮素可极显著提高细胞中mTOR、eIF4E和eIF4A蛋白表达量(P<0.01),并极显著降低4E-BP1蛋白表达量(P<0.01)。
3 讨 论
3.1 槲皮素对猪肠上皮细胞蛋白质含量的影响
蛋白质是构成动物机体的关键物质,在机体的各项生命活动中都发挥重要作用。目前,蛋白质资源短缺和过量的氮排泄问题使得提高畜禽对蛋白质的利用变得更加迫切。开发更加有效的饲料添加剂如黄酮类物质,是解决这一问题的好办法。饲粮添加大豆黄酮和柑橘黄酮可以提高肉鸡胸肌蛋白质含量[8]。富含黄酮类物质的银杏叶提取物和连翘提取物提高了爱拔益加肉鸡的粗蛋白质表观代谢率[9-10]。本课题组前期研究发现,槲皮素可以提高爱拔益加肉鸡的粗蛋白质表观代谢率并增加胸肌、腿肌蛋白质沉积,这可能与槲皮素提高了肉鸡消化道蛋白酶的活性及激活TOR信号通路有关[2]。本试验发现,槲皮素提高了猪肠上皮细胞中蛋白质含量,提示槲皮素可能与其他黄酮类物质相同,也具有提高畜禽对蛋白质利用率的作用。
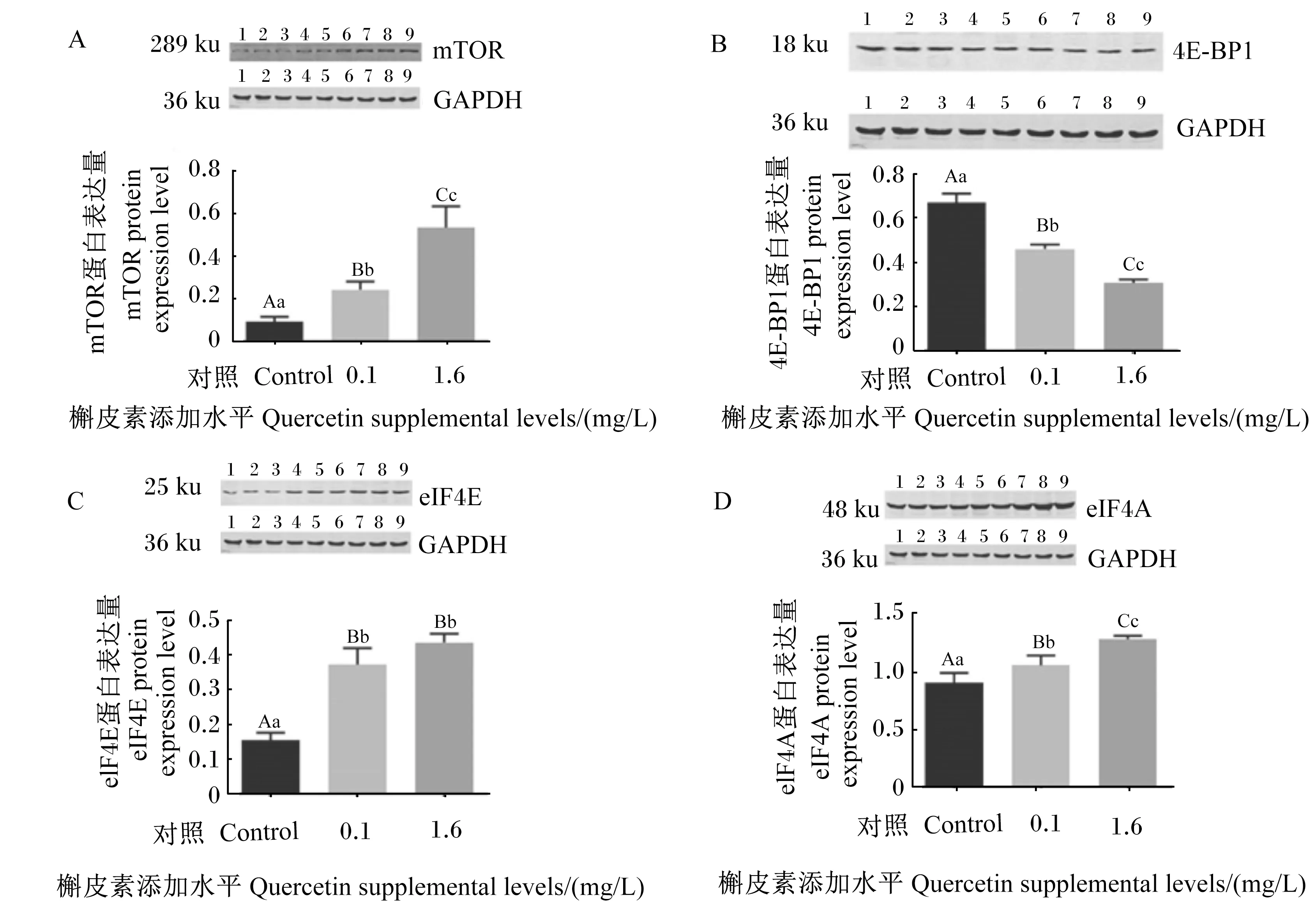
mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;4E-BP1:真核起始因子4E结合蛋白1 eukaryotic initiation factor 4E binding protein 1;eIF4E:真核细胞翻译起始因子4E eukaryotic translation initiation factor 4E; eIF4A:真核细胞翻译起始因子4A eukaryotic translation initiation factor 4A;GAPDH:甘油醛-3-磷酸脱氢酶 glyceraldehyde-3-phosphate dehydrogenase。
3.2 槲皮素对猪肠上皮细胞氨基酸和小肽转运载体mRNA相对表达量的影响
氨基酸转运载体在感应机体肠腔中氨基酸的流动、调节游离氨基酸穿过肠细胞顶端和刷状缘膜的运动、以及细胞内氨基酸池和下游信号中起着不可或缺的作用[11-12]。依据氨基酸的底物特异性将氨基酸转运载体分为中性系统、碱性系统、酸性系统、亚胺-甘氨酸系统和β-氨基酸系统[12-13]。转运载体的基因表达可作为小肠生长和吸收能力的指标[12,14-15]。EAAC1是一种对谷氨酸具有高亲和力的钠依赖性氨基酸转运载体[16],当断奶仔猪回肠EAAC1基因表达降低时,回肠谷氨酸含量相应降低[17]。ATA2、ASCT2和LAT2是中性氨基酸转运载体,在肠腔内,ASCT2可吸收丙氨酸、天冬酰胺、半胱氨酸、苏氨酸、丝氨酸与谷氨酰胺等大部分的中性氨基酸;ATA2对部分中性氨基酸有广泛的亲和力,能够吸收蛋氨酸、脯氨酸、丝氨酸等中性氨基酸;而LAT2主要对芳香族氨基酸和支链氨基酸进行转运。CAT1属于碱性氨基酸转运载体,能够转运鸟氨酸、赖氨酸等碱性氨基酸。rBAT、y+LAT1和y+LAT2对中性氨基酸和碱性氨基酸具有广泛的亲和力。小肽与氨基酸的吸收机制不同,两者相互独立,互不干扰,因此,小肽能够降低常见吸收位点针对游离氨基酸竞争吸收的拮抗作用以加速氨基酸吸收与蛋白质合成[18]。PepT1主要在肠上皮细胞表达,是肠上皮细胞吸收小肽的主要载体,能够将具有2~5个氨基酸残基的小肽转运到肠腔内,而且转运二肽的速度最快[19]。黄酮类物质虽能促进氨基酸的吸收[20],但对氨基酸及小肽转运载体作用的研究却鲜见报道。在本研究中,槲皮素促进了猪肠上皮细胞中氨基酸转运载体EAAC1、ASCT2、ATA2、LAT2、CAT1、rBAT、y+LAT1、y+LAT2和小肽转运载体PepT1 mRNA相对表达量,表明槲皮素能经由上调氨基酸及小肽转运载体的表达来增强猪肠上皮细胞对氨基酸和小肽的吸收。
3.3 槲皮素对猪肠上皮细胞mTOR信号通路相关基因mRNA相对表达量及蛋白表达量的影响
氨基酸、能量和生长因子能够有效激活mTOR信号通路[21],mTOR信号通路的靶点可调节肠上皮细胞中的氨基酸转运蛋白,促进氨基酸的吸收和利用,还可通过调控肠上皮细胞中的氨基酸转运载体参与调节氨基酸的吸收和利用[22-23]。S6K1和4E-BP1是mTOR信号通路下游最重要的2个信号分子。正常情况下,mTOR信号通路可通过调节S6K1和4E-BP1等下游信号通路蛋白的磷酸化状态传递机体营养状况等信号,进而调控细胞内核糖体发生、蛋白质合成等过程[24]。研究发现,甘氨酸能够通过调控mTOR信号通路来促进新生猪肠上皮细胞的生长和增殖[25];谷氨酰胺可激活猪小肠细胞mTOR信号通路并调控S6K1和4E-BP1表达以增加细胞内蛋白质合成且抑制蛋白质降解[26]。mTOR信号通路能够调节4E-BP1的磷酸化水平以影响翻译起始复合物的功能。TSC是mTOR复合物的重要上游调节因子。若TSC1/2二聚体的磷酸化被激活,则mTOR复合物1(mTORC1)的活性被抑制;当TSC1/2二聚体的磷酸化被抑制时,mTORC1的活性被增强,因此通路的信号被传递到下游[27]。本研究中,槲皮素降低了TSC1 mRNA相对表达量,意味着槲皮素处理可能导致TSC1蛋白被翻译的数量减少,从而抑制TSC1/2二聚体的磷酸化,使得mTORC1活性增强,有利于信号传至下游。mTORC1被激活后,4E-BP1被磷酸化并与eIF4E分离[28]。随着游离eIF4E的增加,可与eIF4A和eIF4G合成eIF4F复合物,促进帽依赖式翻译。在本研究中,槲皮素上调了4E-BP1 mRNA相对表达量,这意味着槲皮素处理可能导致更多的4E-BP1蛋白被翻译;此外,槲皮素降低了非磷酸化4E-BP1蛋白的表达,提示槲皮素增加了磷酸化4E-BP1蛋白的表达,从而增加了游离eIF4E的数量;而且本研究中,槲皮素增加了eIF4EmRNA相对表达量和蛋白表达量,进一步说明槲皮素通过调节4E-BP1的磷酸化状态促进帽依赖式翻译过程。mTOR信号通路还能够通过调节S6K1的磷酸化水平调控核糖体蛋白和翻译调节蛋白的合成以及蛋白质翻译过程中肽链的延伸[2]。活化的S6K1可促进eIF4B的磷酸化,并通过eIF4G和eIF4A形成eIF4F复合物,从而促进帽依赖式翻译。真核细胞延伸因子2激酶(eEF2K)能够促进真核细胞延伸因子2(eEF2)磷酸化来弱化eEF2与和核糖体的结合,从而阻碍肽链的延伸。然而活化后的S6K1可抑制eEF2K的表达以实现促进细胞内蛋白质翻译过程中肽链延伸的目的。此外,当eEF2K活性被抑制时,核糖体蛋白RPS6的磷酸化增强,继而促进一些末端嘧啶基因的翻译,从而影响蛋白质的翻译过程。本研究中,槲皮素提高了猪肠上皮细胞mTOR、4E-BP1、RPS6、eIF4E、eIF4B和eIF4AmRNA相对表达量,并降低了TSC1 mRNA相对表达量。此外,槲皮素还降低了4E-BP1蛋白表达量,并提高了eIF4E、eIF4B和eIF4A蛋白表达量。本课题组以往的研究发现,槲皮素还可上调S6K1和eEF2 mRNA相对表达量,并下调eEF2KmRNA相对表达量[4]。由此可见,槲皮素可通过激活mTOR信号通路并调节部分信号通路基因的表达来促进猪肠上皮细胞对蛋白质的利用。
4 结 论
① 经槲皮素处理过的猪肠上皮细胞中蛋白质的含量提高。
② 槲皮素促进了猪肠上皮细胞氨基酸和小肽转运载体基因的mRNA表达。
③ 槲皮素可调控猪肠上皮细胞mTOR信号通路部分基因的mRNA及蛋白表达。
