玉米赤霉烯酮对青年母猪子宫发育、生长激素分泌及其受体分布与表达的影响
2021-02-07吴峰洋杨新宇陈宝江
吴峰洋 崔 嘉 杨新宇 陈宝江,2*
(1.河北农业大学动物科技学院,保定071000;2.河北省牛羊胚胎技术创新中心,保定071000)
玉米赤霉烯酮(ZEA)是主要由镰刀菌菌株产生的,具有类雌激素活性和多种毒性作用的代谢产物,是猪饲粮中最常见的霉菌毒素之一。中国气候复杂多样,领土辽阔广大,谷物在田间生长、收获加工以及运输和贮存过程中都容易受到ZEA的污染[1]。王国强[2]对从全国12个省市收集的饲料样品进行检测,发现ZEA阳性检出率为92.59%,ZEA在阳性样品中的中值为172.2 μg/kg,平均值为332.2 μg/kg,最高值为3 123.8 μg/kg,高于《饲料卫生标准》(GB 13078—2017)的部分限量要求。子宫是重要的繁殖器官,子宫的生长发育及功能状态直接影响母猪繁殖潜力的发挥[3]。生长激素受体(GHR)是一种单链跨膜糖蛋白,可通过与生长激素特异性结合,以自分泌或旁分泌的方式发挥生长调节作用[4]。已有研究表明,ZEA可以促进母猪子宫的发育,但是通过GHR调节子宫发育的报道较少。因此,本试验以对ZEA较敏感的青年母猪为对象,研究ZEA对子宫发育、生长激素(GH)分泌及GHR分布与表达的影响,为探讨ZEA繁殖毒性机理提供参考。
1 材料与方法
1.1 试验材料
ZEA购自Triplebond公司(加拿大),纯度保证值≥98%。
1.2 试验设计及饲粮
选择胎次和体重[(23.20±0.68) kg]相近的长×大二元青年母猪48头,随机分为4组,每组12个重复,每个重复1头。对照组(CON组)饲喂基础饲粮,试验组(T1、T2、T3组)分别饲喂在基础饲粮中添加200、800、1 600 μg/kg ZEA的试验饲粮。预试期7 d,正试期40 d。试验前对猪舍进行清洁和消毒,母猪采用分栏饲养,自由采食和饮水,常规饲养管理。
青年母猪饲喂玉米-豆粕型饲粮,不添加抗生素及脱霉剂。基础饲粮参照《猪饲养标准》(NY/T 65—2004)进行配制,其组成及营养水平见表1。
饲粮于试验开始前配制完成,经酶联免疫吸附测定(ELISA)法检测,各组饲粮中呕吐毒素(DON)、伏马毒素(FB)和黄曲霉毒素B1(AFB1)含量均符合《饲料卫生标准》(GB 13078—2017)的限量要求,ZEA的含量分别为52.37、241.60、825.20和1 634.46 μg/kg。ZEA、DON和AFB1试剂盒购自深圳芬德生物技术有限公司,FB试剂盒购自上海酶联生物科技有限公司。
1.3 测定指标与方法
1.3.1 血清及组织指标
于正试期结束后,试验母猪空腹12 h,然后每组随机选择8头进行前腔静脉采血,每头采集15 mL,将血液注入离心管内倾斜静置,待血凝后3 000 r/min离心10 min,分离血清。每组随机选取4头试验母猪进行屠宰,取子宫组织样品,血清及部分组织于-80 ℃条件下冷冻保存待测。采用ELISA法测定血清及子宫组织中GH及ZEA含量,试剂盒购自上海酶联生物科技有限公司,按说明书指示进行操作。

表1 基础饲粮组成及营养水平(风干基础)
1.3.2 生长性能及子宫指数
试验开始时称量各组母猪的体重获得初始体重,试验结束时再次称量获得终末体重,并根据试验天数计算获得平均日增重(ADG)。统计试验期间的各组母猪的采食量,计算获得平均日采食量(ADFI)和料重比(F/G)。宰前称量青年母猪宰前活重,宰后称量子宫组织重计算器官指数。
子宫指数(g/kg)=子宫鲜重(g)/宰前活重(kg)。
1.3.3 子宫组织形态观察
取子宫新鲜组织于10%中性甲醛固定液中固定,经脱水,透明,浸蜡,包埋,切片处理后用苏木素-伊红染液染色,经脱水,透明,中性树胶封固后使用显微摄像系统进行切片观察和图像采集。
1.3.4 子宫组织基因相对表达量
根据GenBank中已报道的猪的甘油醛-3-磷酸脱氢酶(GAPDH)、生长激素受体(GHR)、Janus蛋白酪氨酸激酶2(JAK2)和信号转导与转录激活因子3(STAT3)基因序列,和前人文献中已发表的引物序列,使用Primer 6.0软件设计相应特异性引物,引物由生工生物工程(上海)股份有限公司合成(表2)。

表2 实时荧光定量PCR反应引物序列
将子宫样品取出50~100 mg,提取总RNA,具体操作按Trizol试剂盒(Invitrogen公司)说明进行,用RNA浓度仪(ThermoNanoDrop Lite)检测RNA浓度。用反转录试剂盒(Vazyme公司,R323-01,20 μL反应体系)进行反转录,具体操作说明书指示进行。按荧光定量试剂盒(Vazyme公司,Q111-02,20 μL反应体系)具体操作按说明书指示进行。扩增条件为:95 ℃预变性5 min;循环反应95 ℃ 10 s,60 ℃ 30 s,40个循环;熔解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。每个样品作3个重复,目标基因表达情况:mRNA相对表达量=2-△△Ct。
1.3.5 免疫组织化学法检测
取子宫新鲜组织迅速于4%多聚甲醛固定液中固定,经脱水、修剪、包埋、切片、染色、封片后,使用显微摄像系统进行切片观察和图像采集。
1.3.6 蛋白质印迹法检测
取子宫组织提取总蛋白,经样品蛋白质浓度测定(BCA法)、样品测定、蛋白质变性、上样、电泳、转膜、封闭、孵育抗体、显影、定影后统计结果。
1.4 数据统计分析
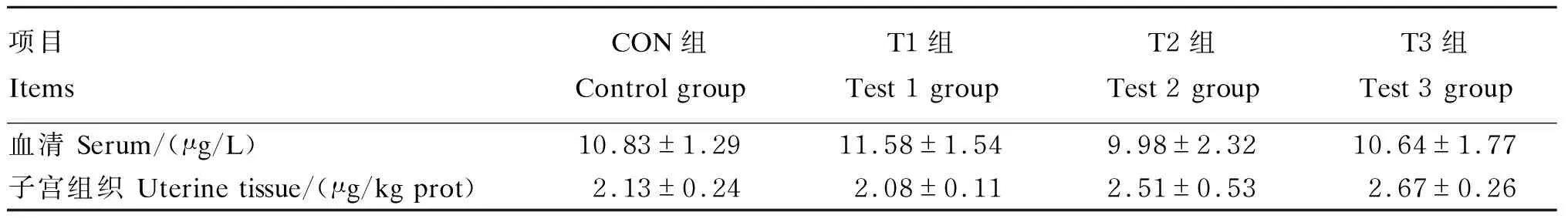
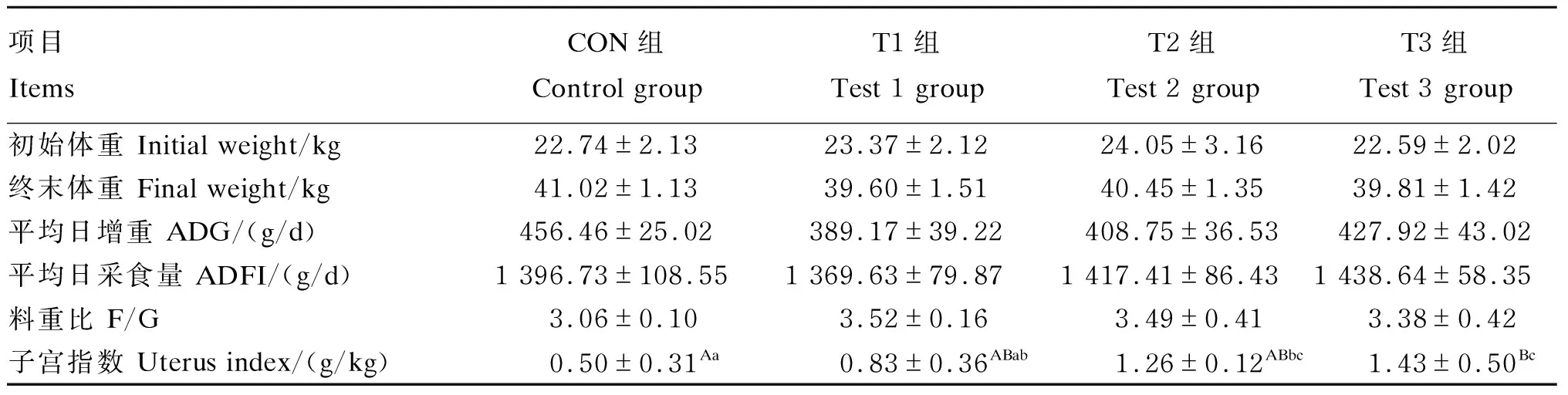
使用Excel 2016和SPSS 20.0软件进行数据统计分析,用one-way ANOVA检验各组数据间显著性差异,用Duncan氏法进行多重比较,P<0.05为差异显著,P<0.01为差异极显著,0.05 由表3可知,各组间血清及子宫组织中GH含量均无显著差异(P>0.05)。 表3 ZEA对青年母猪血清和子宫组织GH含量的影响 由表4可知,各组间子宫组织中ZEA含量均无显著差异(P>0.05),与CON组相比,T2和T3组均升高,分别升高了7.96%和10.40%。 表4 ZEA对青年母猪子宫组织中ZEA含量的影响 由表5可知,各组间初始体重、终末体重、ADG、ADFI及F/G均无显著差异(P>0.05)。与 CON组相比,T2组青年母猪的子宫指数显著升高(P<0.05),T3组极显著升高(P<0.01),分别升高了152%和186%。 表5 ZEA对青年母猪生长性能及子宫指数的影响 由图1可知,CON组子宫内膜、肌层和外膜结构较为清晰;子宫内膜上皮细胞矮柱状,排列较规则,未见明显变性坏死或增生;子宫内膜固有层基质细胞排列较紧密,多量子宫腺分布,子宫腺结构正常,未见明显扩张,毛细血管较丰富。与CON组相比,T1组子宫肌层和内膜增厚,固有层近上皮区域细胞排列较稀疏,少量淋巴细胞散在浸润。T2和T3组子宫肌层和内膜增厚,子宫腺数量增多,毛细血管增多,局部固有层内有细胞灶性浸润,以淋巴细胞为主,部分上皮细胞变性坏死,见坏死细胞胞质空泡化,胞核固缩。上述结果表明,ZEA可以使子宫肌层和内膜增厚,腺体数量增多,毛细血管增多,使子宫发育异常。ZEA还可以使子宫产生炎性反应(淋巴细胞浸润)及上皮细胞变性坏死,且随ZEA剂量增大,损伤作用增强。 由图2可知,与CON组相比,T2和T3组子宫GHRmRNA相对表达量以及T2组JAK2 mRNA相对表达量均显著升高(P<0.05),STAT3 mRNA相对表达量各组间无显著差异(P>0.05)。 由表6可知,各组间母猪子宫组织GHR的平均光密度值没有显著差异(P>0.05),但T2和T3组均高于CON组,其中T3组有升高的趋势(P=0.08)。 图3可知,GHR的免疫阳性物质主要分布于子宫的血管、基质细胞、子宫腺、固有层和肌层细胞的细胞质及细胞间质中,阳性细胞呈黄色或棕黄色。ZEA对GHR在青年母猪子宫中的分布与定位无明显的影响,但各试验组中随着子宫肌层和内膜增厚,子宫腺数量增多,毛细血管增多,免疫阳性物质分布进一步增多,免疫阳性强度进一步增大。由此可见,ZEA可以使青年母猪子宫内GHR免疫阳性物质分布增多,免疫阳性强度增大,来促进子宫的发育。 图CON-1、T1-1、T2-1、T3-1与图CON-2、T1-2、T2-2、T3-2分别为CON组与各试验组在100与400倍下获得的子宫组织视野。图中绿色箭头指示淋巴细胞,黄色箭头指示炎细胞灶性浸润,红色箭头指示上皮细胞坏死。100和400倍下的比例尺分别为:100和10 μm。 由图4和图5可知,各组间青年母猪子宫组织的GHR蛋白表达量没有显著差异(P>0.05),但各试验组灰度值均高于CON组,其中T2组有升高的趋势(P=0.09)。 GHR:生长激素受体 growth hormone receptor;JAK2:Janus蛋白酪氨酸激酶2 Janus activated kinase 2;STAT3:信号转导与转录激活因子3 signal transducer and activator of transcriptions 3。 GH是由垂体分泌的肽类激素,具有促进蛋白质合成、影响脂肪和矿物质代谢等生物功能,对子宫的生长发育具有重要的调节作用[8]。研究表明,ZEA及其代谢产物可以影响垂体的功能状态,继而改变GH的分泌来影响骨骼和器官的发育。Thomas等[9]报道,玉米赤霉醇可以通过影响羊垂体转录因子Pit-1、生长激素释放激素受体以及GHmRNA的表达来促进GH的分泌。但本试验中,各组青年母猪血清和子宫组织中GH含量均无显著差异,说明ZEA处理对青年母猪的GH分泌没有显著影响,结果差异可能和试验动物及试验材料的差异有关。Olivares等[10]也发现玉米赤霉醇对羔羊血清的GH含量没有显著影响。 表6 ZEA对青年母猪子宫GHR平均光密度的影响 图CON-1、T1-1、T2-1、T3-1与图CON-2、T1-2、T2-2、T3-2分别为对照组与各试验组在400倍下获得的子宫组织的2个视野。图中ML表示肌层,UG表示子宫腺,LP表示固有层,LE表示腔上皮。图中比例尺均为40 μm。 图4 ZEA对青年母猪子宫GHR蛋白表达量的影响 图5 ZEA对青年母猪子宫GHR蛋白灰度值的影响 ZEA具有类雌激素活性和多种毒性作用,母猪摄入ZEA后经胃肠吸收后,可在子宫、肝脏、肾脏等组织中沉积[11],发挥毒性作用,ZEA导致的子宫疾病及机能障碍与之有关。本试验中,各组青年母猪子宫组织中ZEA含量未出现显著差异,可能和试验时间相对较短有关。Gajecka等[11]饲喂母猪被ZEA污染的饲粮持续1年,发现子宫组织中ZEA的含量显著升高。本试验中,T2和T3组青年母猪子宫ZEA含量较CON组均提高7%以上,可见ZEA沉积量与饲粮添加量有一定的正相关性,这可能是ZEA导致子宫异常发育的原因之一。 本试验中ZEA对青年母猪的生长性能无显著影响。Fu等[12]饲喂母猪被ZEA污染的饲粮持续21 d,也发现对ADG、ADFI和F/G均无显著影响。这可能和消化系统不是ZEA毒性作用的主要靶器官有关。这说明ZEA对生长性能的影响不是造成子宫异常发育的主要原因。 ZEA对子宫组织生长发育的促进作用已有报道,如周敏等[13]在小母猪的饲粮中添加0.5、1.0和1.5 mg/kg ZEA,发现ZEA可使子宫内膜和肌层显著增厚,腺体数量显著增多,腺体密度显著增大,使子宫发育异常。本试验中,各试验组青年母猪的子宫指数均高于或显著高于CON组,且经组织学观察发现,试验组青年母猪子宫组织出现肌层和内膜增厚、腺体增多、毛细血管增多等变化。本试验中,ZEA处理对青年母猪的ADG、ADFI以及F/G均无显著影响,结合血清和子宫组织中GH含量的变化,说明影响生长性能及调节GH分泌可能不是ZEA促进青年母猪子宫发育的主要作用途径。ZEA可以通过调控子宫内生长发育相关基因及蛋白的表达来使子宫发育异常,如ZEA可以使母猪子宫内增殖细胞核抗原表达量升高,并激活转化生长因子-β1(TGF-β1)/Smad蛋白3(Smad3)信号通路[14]。组织学观察还发现ZEA可以使青年母猪子宫出现炎性反应和上皮细胞变性坏死。这与ZEA能通过c-Jun氨基末端激酶(JNK)信号通路引起炎症反应及损伤,以及ZEA能诱导机体产生过量的活性氧引起氧化应激及损伤有关[15-16]。 GH在组织和细胞水平发挥作用,需要与靶细胞膜表面的GHR结合使GHR二聚体化,激活JAK2后使GHR胞内结构与及自身酪氨酸残基磷酸化,进一步激活STAT3,诱导蛋白质因子磷酸化,产生级联放大效应,将生物信号传导到细胞内引发生物效应,参与调节子宫组织的生长发育等生理过程[16-17]。组织中GHR的含量及功能影响GH生物效应的发挥,如GHR基因突变可使男童体内的GH的生物效应降低,导致男童身材矮小[18]。JAK2及STAT3是JAK-STAT信号通路中的重要基因,在细胞的生长和增殖过程中发挥重要的调节作用。Feng等[19]报道,GH可通过GHR-JAK2-STAT3途径促进人子宫内膜腺细胞的增殖,如果使用GHR抑制剂AG490,则GHR、JAK2和STAT3基因表达下调,GH生物效应降低,细胞增殖速率降低。 本试验中,各试验组青年母猪子宫组织GHR、JAK2和STAT3 mRNA相对表达量均高于或显著高于CON组,说明ZEA可能通过上调GHRmRNA相对表达量,提高GH与GHR的结合率,并激活下游JAK-STAT信号通路,使JAK2和SATA3 mRNA相对表达量上调,增强了GH的生物效应。GH可以通过GHR-JAK-STAT途径促进子宫内膜细胞和子宫内膜腺细胞等细胞的增殖和血管的生成,使子宫指数出现极显著升高,子宫肌层和内膜增厚,子宫腺和毛细血管数量增多,子宫发育异常[19-20]。Zhou等[21]在断奶母猪饲粮中添加1 mg/kg的ZEA,也发现子宫指数显著增大,子宫内膜变厚,GHRmRNA相对表达量显著升高。 在实时荧光定量PCR的基础上进一步进行了免疫组织化学和Western blot检测,发现ZEA可以使青年母猪子宫内GHR免疫阳性物质分布增多,免疫阳性强度增大,并且T2组GHR蛋白灰度值有升高的趋势。这说明ZEA可能通过上调GHR蛋白的表达水平,增强GH的生物作用,来促进子宫的发育。Wathes等[22]报道,GHR可以促进牛子宫发育。而子宫发育加快可能会增加子宫发育不全、早衰、功能异常和子宫肌瘤等疾病的患病风险,降低青年母猪的繁殖潜力[23]。Zhou等[21]在断奶母猪的饲喂试验中发现,1 mg/kg的ZEA可以使子宫GHR蛋白表达量显著升高。戴美玲[6]报道,饲喂断奶仔猪1.04 mg/kg的ZEA可以促进卵巢发育并使GHRmRNA的表达量及蛋白免疫阳性强度增大,这与本试验结果一致。 ZEA具有类雌激素活性可以特异性的与雌激素受体结合调控靶基因和蛋白质的转录与合成,产生生殖毒性作用,使母猪子宫组织发育异常,子宫细胞凋亡,子宫机能下降,是母猪繁殖性能降低的重要原因之一,持续危害着养猪业的发展[24-26]。本试验的结果表明,ZEA对GH的分泌无显著影响,但可以通过调控GHR、JAK2和STAT3 mRNA相对表达和蛋白的表达来增强GH的生物效应,导致子宫异常发育,是ZEA生殖毒性作用的途径之一。同时,T2和T3组青年母猪子宫还出现淋巴细胞浸润以及上皮细胞坏死等病理变化。子宫异常发育及出现病理变化,将增加子宫发育不全、早衰、功能异常以及多种疾病的患病风险,导致母猪的繁殖性能降低[23]。如Zhao等[27]在断奶雌鼠的的饲喂试验中发现,40 mg/kg的ZEA可以使雌鼠子宫发育异常,子宫机能降低,受精减少,胚胎运输和植入前发育延迟,胚胎着床中断,繁殖性能下降。高文博[28]在后备母猪饲粮中添加1 mg/kg的ZEA也发现,子宫发育异常并产生氧化应激损伤。此外,GH通过结合GHR激活下游JAK-STAT信号通路除了参与调节动物的生长发育外,还参与代谢、生殖系统、心血管以及消化系统等多种生理和病理过程的调节[29]。ZEA通过此途径发挥子宫毒性作用,影响青年母猪的繁殖性能。 ZEA对青年母猪的生长性能以及血清和子宫GH和ZEA的含量均无显著影响,但是可通过升高GHR、JAK2和STAT3 mRNA相对表达量、增强GHR的免疫阳性、升高蛋白表达量来增强GH的生物效应,使子宫发育异常,导致子宫指数出现极显著升高,子宫肌层和内膜增厚,子宫腺和毛细血管数量增多。2 结果与分析
2.1 ZEA对青年母猪血清和子宫组织GH含量的影响
2.2 ZEA对青年母猪子宫组织中ZEA含量的影响

2.3 ZEA对青年母猪生长性能及子宫指数的影响
2.4 ZEA对青年母猪子宫结构形态的影响
2.5 ZEA对青年母猪子宫组织GHR、JAK2、STAT3 mRNA相对表达量的影响
2.6 ZEA对青年母猪子宫组织GHR免疫阳性分布的影响

2.7 ZEA对青年母猪子宫GHR蛋白表达量的影响

3 讨 论
3.1 ZEA对青年母猪血清和子宫GH及ZEA含量的影响




3.2 ZEA对青年母猪生长性能及子宫指数和组织形态的影响
3.3 ZEA对青年母猪子宫组织GHR、JAK2、STAT3 mRNA相对表达量的影响
3.4 ZEA对青年母猪子宫组织GHR蛋白阳性分布及表达的影响
3.5 ZEA对青年母猪繁殖性能的影响
4 结 论
