符合内镜下切除绝对适应证的早期胃癌非治愈性切除的危险因素分析*
2021-02-07李贞娟周炳喜李晓芳李修岭杨玉秀
李贞娟,丁 辉,周炳喜,李晓芳,李修岭,杨玉秀
(河南省人民医院/郑州大学人民医院/河南大学临床医学院消化内科,郑州 450003)
早期胃癌(early gastric cancer,EGC)是指仅局限于胃黏膜层或黏膜下层,不论有无淋巴结转移的胃癌。目前,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已成为治疗EGC的首选方法[1]。《中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)》[2]将ESD治疗的适应证分为绝对适应证和相对适应证。多种方法如窄带成像技术、放大内镜、超声内镜等可帮助术前评估病变的浸润深度和分化程度[3]。遗憾的是,术前评估的准确性并非100%,部分病变最终切除后病理评估仍为非治愈性切除。因此,有必要对非治愈性切除的危险因素进行分析,以指导临床更加谨慎地选择内镜下切除EGC病例。
1 资料与方法
1.1 一般资料
选取2014年1月至2018年12月本院内镜中心术前符合内镜切除适应证并接受ESD治疗的EGC患者278例,包含283个病灶。纳入标准:(1)EGC内镜下治疗的绝对适应证[2],即病变最大径小于或等于2 cm、未合并溃疡的分化型黏膜内癌;(2)病变均经ESD治疗且被成功剥离;(3)术后病理诊断为高级别上皮内瘤变或EGC;(4)病例资料完整。排除标准:(1)病变最大径大于2.0 cm者;(2)病变合并溃疡者;(3)术后病理证实为未分化型者;(4)病例资料不完整者。排除112例,包含117个病灶。最终纳入166例,包含166个病灶。166例患者术前均无内镜下手术禁忌证,术前充分告知患者ESD的相关风险,所有患者签署知情同意书。根据病变内镜下切除后病理评估结果将患者分为治愈性切除组(n=144)和非治愈性切除组(n=22),均为浸润深度超过黏膜下浅层(SM1)的病变,无侧切缘阳性,无脉管浸润。本研究经本院伦理委员会审核通过,所有受试者均知情同意。
1.2 方法
1.2.1仪器与试剂
GIF-Q260J电子胃镜、注射针、Dual刀、IT-2刀、三角刀、止血钳(日本Olympus公司),金属夹(南京微创医学科技股份有限公司),高频电切装置及APC300氩离子凝固器(德国ERBE公司);生理盐水、亚甲蓝、1∶1000 0肾上腺素等药品。
1.2.2术前准备
对术前活检提示为EGC的病变再次进行内镜窄带成像技术(NBI)检查,放大观察评估病变性质及浸润深度等。行CT检查了解病变侵犯深度及有无局部和远处淋巴结转移,必要时可采用超声内镜检查了解肿瘤局部侵犯及淋巴结转移情况。术前常规抽血检查并进行麻醉评估排除麻醉禁忌证。长期服用抗血小板药物及抗凝药物的患者,应在心血管内科医师指导下,术前停服该类药物1周。患者术前禁食8 h及以上,禁水2 h及以上。
1.2.3ESD操作步骤
所有操作均由具有5年以上ESD操作经验的医师完成。(1)标记:常规入镜后分别在白光及NBI下仔细观察病变,再次确定病变部位、性质及范围。用dual刀在距离病变周围约0.5 cm处对病变进行环周标记。(2)黏膜下注射:用注射针于病变标记点外侧黏膜下注射肾上腺素生理盐水+亚甲蓝溶液,使病变充分抬举。(3)切开及剥离:在透明帽辅助下,用dual刀沿病变标记点外侧切开病变边缘后,结合IT-2刀或三角刀黏膜下注射肾上腺素生理盐水+亚甲蓝溶液,同时对病变进行逐渐剥离,直至病变被完整剥离,剥离过程中如有出血,先用生理盐水冲洗,寻找出血点,然后采用电刀、止血钳等对出血点进行充分止血。(4)创面处理:病变完整剥离后将病变取出。用止血钳对血管断端及裸露血管进行严密止血。
1.2.4标本处理
将病变用大头针固定于平板上,测量病变大小,并将其用甲醛溶液固定,连同病理申请单送病理检查。
1.2.5术后处理
术后患者给予禁食、禁饮3~5 d,常规静脉抑酸、止血、补液及营养支持治疗。密切观察患者生命体征及有无穿孔、发热、腹痛等并发症。术后第3、6、12、24个月进行随访,复查胃镜或CT了解有无局部复发、残留及远处转移等。
1.3 观察指标
1.3.1内镜下指标
病变内镜下大体形态按照巴黎分型[4]进行分类。可分为3型:隆起型(0-Ⅰ)、表浅型(0-Ⅱ)和凹陷型(0-Ⅲ);其中表浅型又可分为3种亚型:表浅隆起型(0-Ⅱa)、表浅平坦型(0-Ⅱb)和表浅凹陷型(0-Ⅱc);肿瘤在胃内的位置分为胃上部、胃中部和胃下部3个部分;记录病变最大径。
1.3.2病理学指标
肿瘤侵犯深度为肿瘤浸润最深处,需在电子显微镜下测量肿瘤组织侵袭到黏膜下层(submucosa,SM)浸润最深处距黏膜肌的深度。如果测量深度小于500 μm,则记录为SM1,若浸润深度大于或等于500 μm,记录为SM2[5]。治愈性切除[6]:病灶整块切除,垂直切缘与水平切缘阴性、浸润深度不超过SM1及脉管无肿瘤细胞浸润。非治愈性切除:除治愈性切除以外的EGC的内镜下切除。胃癌的病理组织学类型根据日本胃癌研究会1998年修订的第13版胃癌规约[7],将胃癌分为一般型和特殊型。一般型包括乳头状腺癌、管状腺癌(高分化型、中分化型)、低分化腺癌(实性型、非实性型)、印戒细胞癌和黏膜腺癌;特殊类型包括鳞腺癌、鳞癌、类癌和其他不能分类的癌。
1.4 统计学处理

2 结 果
2.1 EGC患者一般资料及临床病理特征
166例EGC患者,男114例(68.7%),女52例(31.3%),男女比例为2.19∶1.00,发病年龄28~76岁,平均(53.11±12.30)岁。病变位置位于胃上部、中部和下部,分别为23例(13.8%)、54例(32.5%)和89例(53.6%);内镜下大体类型为Ⅱa+Ⅱc或Ⅱc+Ⅱa者50例(30.1%),其他类型116例(69.9%);整块切除153例(92.2%),分块切除13例(7.8%);病变最大径平均为(1.38±0.40)cm;病变最大径大于或等于1.5 cm者32例(19.3%),<1.5 cm者134例(80.7%);浸润深度为黏膜层(M)、SM1、SM2者分别为146例(88.0%)、9例(5.4%)和11例(6.6%);病变分化程度为高分化者141例(84.9%)、中分化者25例(15.1%);术中并发症发生出血38例(22.9%)、穿孔2例(1.2%)。
2.2 两组临床病理特征比较
两组在病变大体类型、病变最大径、病变分化程度、是否整块切除上比较,差异有统计学意义(P<0.05);两组在性别、年龄、病变位置比较,差异无统计学意义(P>0.05)。治愈性切除组浸润深度全部为M层,而非治愈性切除组浸润深度为M、SM1和SM2者分别为2例(9.1%)、9例(40.9%)和11例(50.0%),见表1。
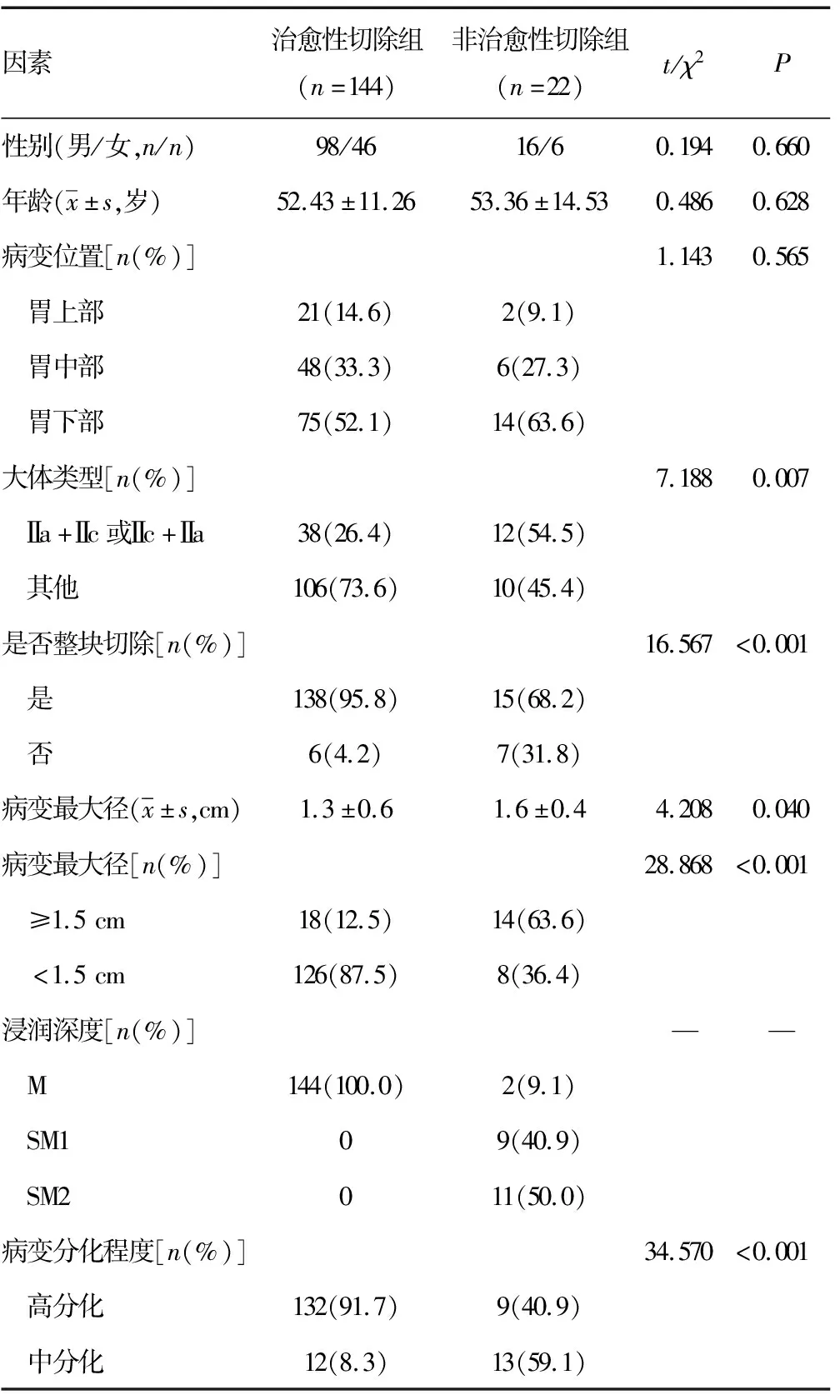
表1 两组临床病理特征比较
2.3 非治愈性切除影响因素的多因素logistic回归分析
为消除各单个因素间的交互作用和混杂影响,以是否治愈性切除作为因变量(是=1,否=0),将治愈性切除组与非治愈性切除组对比差异有统计学意义的变量及结合专业知识可能影响非治愈性切除的变量作为自变量纳入多因素分析,包括病变位置、病变大体类型、是否整块切除、病变最大径、病变分化程度5个自变量。结果显示,符合内镜下切除绝对适应证的EGC发生非治愈性切除与病变大体形态为Ⅱa+Ⅱc或Ⅱc+Ⅱa(OR=0.367,P=0.026)、病变最大径大于或等于1.5 cm(OR=0.080,P=0.004)和病变分化程度为中分化(OR=0.530,P=0.036)有关,而与病变位置(OR=1.357,P=0.543)、是否整块切除(OR=0.972,P=0.063)无关,见表2。

表2 非治愈性切除影响因素的多因素logistic回归分析
3 讨 论
随着ESD技术的发展,其治疗EGC的适应证不断地调整、扩大[8-9]。其相对适应证[2]包括:(1)病变最大径大于2 cm,无溃疡的分化型黏膜内癌;(2)病变最大径小于或等于3 cm,有溃疡的分化型黏膜内癌;(3)病变最大径小于或等于2 cm,无溃疡的未分化型黏膜内癌;(4)病变最大径小于或等于3 cm,无溃疡的分化型浅层黏膜下癌;(5)除外以上条件的EGC,伴有一般情况差、外科手术禁忌证或拒绝外科手术者可视为ESD相对适应证。对于一些术前无法确定浸润深度的病变,目前认为可行诊断性切除以达到准确评估的目的[10-12]。但是,无论哪种类型的EGC,治愈性切除仍是评判ESD治疗效果的金标准。尤其是对于被认为是ESD绝对适应证的EGC,仍有一部分病变未达到治愈性切除,本研究重点分析了这类病变非治愈性切除的危险因素。
本研究发现,病变的大体形态,尤其是Ⅱa+Ⅱc或Ⅱc+Ⅱa型的病变是发生非治愈性切除的独立危险因素之一。国外有研究显示,非平坦型的病变是EGC发生SM浸润及淋巴结转移的危险因素[13],这与本研究结果有一定的一致性,可能与EGC的发生特点有关。无论是Ⅱa+Ⅱc型还是Ⅱc+Ⅱa型,Ⅱc型多与病变的浸润性生长有关[14]。另外,就病变分化程度而言,中分化是非治愈性切除的独立危险因素之一。有研究显示,一些伴有低分化成分的混合型EGC是发生黏膜下层浸润和淋巴结转移的危险因素,而中分化则常与混合型EGC相关[15-16]。本研究纳入的中分化病变均为中分化为主的混合型病变。然而,在这些病变中,只有5例内镜下活检时病理诊断为包含中分化的混合型病变,其余均为中分化的病变,但有部分病变提示存在黏膜下层的浸润。因此,术前活检病理及术前精查评估不能完全排除病变黏膜下层浸润的可能。本研究显示,非治愈性切除的第3个独立危险因素为病变最大径大于或等于1.5 cm。而病变的位置与非治愈性切除无明显相关性。钱斌等[6]分析了影响EGC内镜治愈性切除的危险因素,结果显示病灶最大径大于3.0 cm、伴有溃疡形成是影响EGC内镜下治愈性切除的危险因素。该文章纳入的患者为绝对适应证和扩大适应证的病例,和本研究纳入的病例范围不同。是否整块切除在单因素分析时显示两组间存在明显差异,提示分块切除可能是影响非治愈性切除的危险因素,但经多因素分析去除相关混杂因素后,分块切除并不是非治愈性切除的独立危险因素。其原因可能为本研究所纳入的病变最大径较小(≤2.0 cm),较病变最大径大者操作相对简单,整块切除率高。因此,即使为分块切除,基底切缘和侧切缘仍为阴性,不影响非治愈性切除率。本研究选择符合内镜下切除绝对适应证的EGC病例进行危险因素分析,旨在为内镜医生进行EGC的内镜下治疗时提供一定的参考,切勿把EGC绝对适应证和治愈性切除画等号,对每例患者的选择均应慎重[17]。
本研究有一定的局限性。首先,本研究样本量较小且为单中心研究;其次,本研究为回顾性分析,无法对患者进行长期的随访观察,进一步了解患者的生存情况;再次,本研究所纳入的影响因素不够全面,可能对危险因素的判断有一定影响,尤其是前面提到的可能作为危险因素的分块切除。因此,本研究所得结论尚需大样本多中心前瞻性研究进一步论证。
综上所述,本研究针对目前ESD治疗的绝对适应证的病变发生非治愈性切除的危险因素进行分析,结果显示,病变大体形态为Ⅱa+Ⅱc或Ⅱc+Ⅱa、病变最大径大于或等于1.5 cm和病变分化程度为中分化是符合内镜下切除绝对适应证的EGC非治愈性切除的独立危险因素。因此,术前进行充分的评估,严格把握内镜下治疗的适应证,并充分参照上述3个危险因素,将有助于更准确地把握内镜下切除的病例选择,从而提高治愈性切除率。
