组蛋白修饰变化参与曲古抑菌素A缓解的烟草烟雾暴露所致小鼠子宫损伤过程
2021-02-07丛艳飞丁晶晶王莉莉
娄 毅 ,丛艳飞 ,丁晶晶 ,李 芳 ,王莉莉
(1.中国医科大学基础医学院医学遗传学教研室,辽宁 沈阳 110122;2.中国医科大学附属盛京医院实验研究中心,辽宁 本溪 117000)
中国是世界上最大的烟草生产和消费国,2002 年中国女性居民主动吸烟率为3.1%,被动吸烟率高达54.6%[1]。烟草烟雾(cigarette smoke,CS)中含有多环芳香烃(PAHs)、苯并芘(BaP)、尼古丁、生物碱和重金属等 4 000 多种有害化学物质[2]。研究发现,吸烟会使处于育龄期的女性生育力下降[3],口服尼古丁会导致大鼠子宫腔上皮和腺上皮形态学改变[4],CS 暴露可导致子宫 MMP-9、CXCR4和ER的表达增加[5]。我们前期的研究表明,CS暴露通过激活组蛋白脱乙酰基酶1/2(histone deacetylase,HDAC),导致小鼠子宫肌层和子宫内膜变薄,腺体组织和间质细胞明显减少等组织形态学改变,TSA,HDAC的通用抑制剂,通过抑制 HDAC 1/2 和 mTOR 的激活,重新激活自噬,改善CS暴露引起的小鼠子宫组织形态学改变[6]。此外,我们还发现 P2RX7介导的细胞焦亡和凋亡参与了 TSA 缓解的CS 暴露所致的小鼠子宫损伤过程[7]。因此,进一步探究烟草烟雾暴露对女性生育能力影响的相关分子机制将为提高女性生育健康做出一定贡献。
环境毒素可以通过表观遗传学机制影响基因表达水平,进而影响个体的表型或者疾病的易感性[8]。表观遗传学修饰包括翻译后的组蛋白修饰,如组蛋白的乙酰化和甲基化修饰、DNA的甲基化修饰等,表观遗传修饰在转录调节中发挥重要作用[9-10]。组蛋白修饰水平变化和相关组蛋白修饰转移酶的变化和很多子宫疾病有关[11-14]。在子宫内膜异位症的异位内膜组织中发现全组蛋白 H3K4 和 H3K9 的低甲基化,说明组蛋白修饰异常在子宫内膜异位症的发病中发挥重要作用[11]。子宫内膜异位症患者的异位子宫内膜中 H3K27me3 阳性细胞百分比明显低于正常分泌型子宫内膜。此外,H3K27me3 的甲基转移酶 EZH2 在子宫内膜异位症上皮细胞中高水平表达。提示 H3K27me3 在子宫内膜异位症发病中的作用和 EZH2 可能作为该疾病的潜在治疗靶点[12]。以上结果表明,组蛋白修饰和相关转移酶的异常参与很多子宫疾病的发生发展,但组蛋白修饰和相关转移酶的变化是否参与了烟草烟雾暴露对子宫的毒理作用和 TSA 的缓解过程,目前尚不清楚。
1 材料与方法
1.1 材料
1.1.1实验动物 60 日龄C57BL/6 ♀小鼠 36 只,体质量(20.0±0.5)g,购自辽宁长生生物技术有限公司,SCXK(辽)2015-0001。实验动物饲养在中国医科大学附属盛京医院动物中心 SPF 级动物饲养室,SYXK(辽)2017-0004,室温(22 ±3)℃,相对湿度(50±20)%。针对实验动物的所有操作流程关注动物福利,并通过中国医科大学附属盛京医院医学伦理委员会批准(2013PS06K;2019PS263K)。
1.1.2试剂 雄狮牌香烟(每支含 0.7 mg 尼古丁和 8 mg 焦油);组蛋白提取试剂盒(EPIGENTEK,批号:#OP-0006);TSA(Sigma;批号:T1952);免疫组化试剂盒(迈新,批号:KIT9921);一抗来源:GAPDH(康成生物;批号:KC-5G4,规格:100 μL);H3(ABclonal;批号:A2348);H3K4me1(ABclonal;批号:A2355);H3K4me2(ABclonal;批号:A2356);H3K4me3(ABclonal;批号:A2357);H3K9me1(ABclonal;批号:A2358);H3K9me2(ABclonal;批号:A2359);H3K9me3(ABclonal;批号:A2360);H3K27me3(ACTIVEMOTIF;批号:61017);GLP(R&D;批号:PP-B0422);G9ɑ(MILLIPORE;批号:#09-071);EZH2(CST;批号:5246S);羊抗兔二抗(Abbkine;批号:A23620);羊抗鼠二抗(Abbkine;批号:A25012)。
1.1.3实验仪器 Western blot垂直电泳系统(美国Hoffer公司);Western blot转膜系统(美国Bio-Rad公司);RM2235石蜡切片机(德国Leica公司);组织石蜡包埋机(湖北孝感阔海医疗公司);低温高速离心机(美国Thermo公司);-80 ℃ 超低温冰箱(美国Thermo公司);电子天平(美国G&G公司)QS-RO型全自动超纯水机(沈阳惠思纯水设备有限公司);生物净化工作台(中国苏净安泰公司);眼科剪刀、镊子等必备手术器械(江苏宠宝集团医疗器械有限公司)。
1.2 研究方法
1.2.1烟草烟雾暴露小鼠模型 将36只C57 BL/6 ♀小鼠按随机分组的方法分为对照组、CS 暴露组和 CS+TSA 组,每组 12 只,对每组内的小鼠进行编号,列表记录它们的初始体质量及状态。自制实验性 CS 暴露装置,CS 暴露方法参照本课题组前期实验[6-7]。CS 暴露组和 CS+TSA 组小鼠 CS 暴露时间为30 d,每天两次 CS 暴露,每次 CS 暴露给两支烟持续暴露 2 h,CS 暴露时间间隔为5 h。对照组小鼠吸入空气。药物 TSA(将 TSA 溶于DMSO,再用生理盐水将其配制成浓度为 1.98×10-5mol·L-1的溶液),按0.6 μg·g-1体质量的剂量,每2 d 1次,腹腔内注射给 CS+TSA 组小鼠。CS暴露30 d后,对处于发情期的雌性小鼠实施安乐死,并从每组中至少收集 5 个子宫组织用于进一步研究。
1.2.2HE 染色 各组小鼠的子宫组织用 4% 多聚甲醛固定 24 h,再经梯度酒精的洗涤与脱水以及二甲苯透明,浸在石蜡中进行组织包埋,以 4 μm 厚度连续切片,然后进行标准 HE 染色,中性树脂封片后置于光学显微镜下观察并拍照。
1.2.3Western blot 提取各组小鼠子宫组织总蛋白和组蛋白,具体操作步骤参照试剂盒说明书。然后将提取的各组子宫组织的蛋白进行 SDS-PAGE 电泳,分别用 GAPDH(1 ∶10 000);H3(1 ∶1 000);H3K4me1(1 ∶200);H3K4me2(1 ∶200);H3K4me3(1 ∶200);H3K9me1(1 ∶200);H3K9me2(1 ∶200);H3K9me3(1 ∶200);H3K27me3(1 ∶300);GLP(1 ∶400);G9ɑ(1 ∶400)和 EZH2(1 ∶200)抗体孵育。实验结束后用 Image-J 软件对光密度值进行定量检测,对不同分子量蛋白的表达情况进行分析。
1.3 统计学分析应用 GraphPad Prism 7.00 统计软件分析数据,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。
2 结果
2.1 TSA 抑制 CS 暴露导致的子宫组织结构改变CS 暴露后小鼠的子宫湿重降低,子宫肌层变薄、腺体和间质细胞数目减少,TSA 可以有效抑制 CS 暴露引起的小鼠子宫的上述形态学改变(见Fig 1)。以上 CS 暴露导致的子宫组织结构改变和TSA 对子宫损伤的改善和我们先前的研究结果一致[6]。

Fig 1 TSA relieved changes in uterine tissue morphology caused by CS exposureHE staining was used to observe the morphology of mouse uterus in the control group,CS exposed group and CS exposed+TSA group)
2.2 TSA 抑制 CS 暴露诱导的小鼠子宫组织组蛋白 H3K9me1 修饰水平变化采用 Western blot 技术检测了各组(对照组、CS 暴露组和 CS+TSA 组)小鼠子宫组织组蛋白中 H3K4me1、H3K4me2、H3K4me3、H3K9me1、H3K9me2、H3K9me3和H3K27me3总的修饰水平,结果表明,CS 暴露后小鼠子宫组织总 H3K9me1 表达水平明显升高,TSA有效抑制了 CS 暴露诱导的小鼠子宫组织 H3K9me1 的表达。此外,CS 暴露后小鼠子宫组织总 H3K27me3 表达水平明显升高,TSA进一步激活了小鼠子宫组织总 H3K27me3 表达水平。其他检测的组蛋白总的修饰水平在各鼠子宫组织中的改变差异无统计学意义(见Fig 2)。因此,结果表明 H3K9me1 和 H3K27me3 组蛋白修饰水平变化参与烟草烟雾对小鼠子宫的损伤过程,且 H3K9me1 组蛋白修饰水平的变化在TSA 缓解的烟草烟雾暴露所致的小鼠子宫损伤过程中发挥重要作用。

Fig 2 Histone modifications involved in process of uterine injury alleviated by TSA in female mice induced by CS exposure (,n=3)Western blot results showed that TSA significantly inhibited global H3K9me1 modification and further aggravated H3K27me3 change induced by CS exposure.*P<0.05 vs control;#P<0.05 vs CS
2.3 组蛋白甲基转移酶在小鼠子宫组织中的表达H3K9me1 和 H3K27me3 组蛋白修饰水平变化参与 CS对小鼠子宫的损伤过程,为了探索组蛋白修饰水平改变的机制,我们进一步检测了各组小鼠子宫组织中组蛋白甲基转移酶 GLP(H3K9 甲基转移酶)、G9ɑ(H3K9 甲基转移酶)和EZH2(H3K27me3 甲基转移酶)的表达水平。结果发现:CS暴露后小鼠子宫组织 GLP 和 G9ɑ 表达水平增加,TSA抑制了 CS 暴露激活的小鼠子宫组织 GLP和G9ɑ的表达。此外,CS暴露后小鼠子宫组织中EZH2表达水平增加,应用TSA后进一步激活了CS暴露诱导的EZH2表达水平(见Fig 3)。我们的研究结果表明:组蛋白甲基转移酶(GLP、G9α、EZH2)表达水平的增加在烟草烟雾对小鼠子宫的损伤中发挥作用,GLP、G9α和TSA改善在CS暴露引起的子宫组织形态改变过程中起到一定的作用。
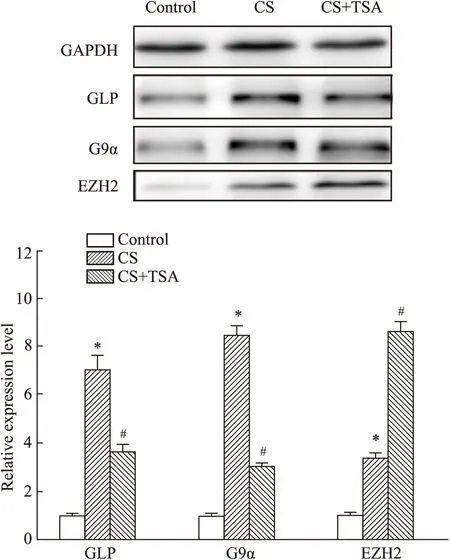
Fig 3 Histone methyltransferase involved in process of uterine injury alleviated by TSA in female mice induced by CS exposure (,n=3)TSA suppressed GLP and G9ɑ expression in mice uterine tissue induced by CS exposure,but further activated EZH2 increase.*P<0.05 vs control;#P<0.05 vs CS
3 讨论
本研究发现,CS暴露后小鼠的子宫腺体和间质细胞数目减少,TSA 可以有效抑制 CS 暴露引起的小鼠子宫的上述形态学改变。以上 CS 暴露导致的子宫组织结构改变和 TSA 对子宫损伤的改善和我们先前的研究结果一致[7]。研究发现 CS 中的有害物质可以导致肺上皮细胞中 DNA 甲基化和组蛋白修饰发生变化[13-15]。但是,在子宫组织中 CS 暴露能否通过改变组蛋白修饰参与其对子宫的毒理作用和 TSA 的缓解过程,目前尚不清楚。为进一步探究组蛋白修饰水平变化在 CS 暴露对小鼠子宫的毒理作用以及在 TSA 对子宫损伤的改善中的作用,我们采用 Western blot 技术检测了各组小鼠子宫组织组蛋白中H3K4me1、H3K4me2、H3K4me3、H3K9me1、H3K9me2、H3K9me3和H3K27me3总的修饰水平。结果表明:H3K9me1 和 H3K27me3 组蛋白修饰水平变化参与 CS 对小鼠子宫的损伤过程,且 H3K9me1 组蛋白修饰水平的变化在 TSA 缓解的 CS 暴露所致的小鼠子宫损伤过程中发挥重要作用。环境毒素可以通过表观遗传学机制影响基因表达水平。本研究发现 G9ɑ 和 GLP 调节的总 H3K9me1 组蛋白修饰水平变化参与 CS 对小鼠子宫的损伤和 TSA 的缓解过程。但是,H3K9me1 组蛋白修饰水平变化后影响了下游哪些基因的表达,目前尚不清楚。我们前期发现 CS 暴露能够通过激活小鼠子宫组织中 HDAC1/2、mTOR和P2RX7介导的细胞焦亡导致子宫肌层和子宫内膜变薄,而 TSA 可以抑制 HDAC1/2、mTOR和P2RX7的活化,缓解 CS 暴露引起的子宫组织形态改变[6-7]。CS 暴露和 TSA 处理后子宫组织中 HDAC1/2、mTOR 和 P2RX7表达水平的变化是否和 H3K9me1 组蛋白修饰水平变化有关,值得我们后续深入研究。
我们进一步检测了各组小鼠子宫组织中组蛋白甲基转移酶 GLP(H3K9 甲基转移酶)、G9α(H3K9 甲基转移酶)和EZH2(H3K27me3 甲基转移酶)的表达水平。CS 暴露后小鼠子宫组织GLP和G9α表达水平增加,TSA抑制了CS暴露激活的小鼠子宫组织 GLP和G9α的表达。此外,CS暴露后小鼠子宫组织中EZH2表达水平增加,应用TSA后进一步激活了CS暴露诱导的 EZH2表达水平。我们的研究结果表明:组蛋白甲基转移酶(GLP、G9α、EZH2)表达水平的增加在烟草烟雾对小鼠子宫的损伤中发挥作用。此外,GLP、G9α在TSA改善CS暴露引起的子宫组织形态改变过程中起到一定的作用。组蛋白甲基转移酶(GLP、G9α和EZH2)在子宫组织中的作用,目前很少文献报道。G9ɑ(H3K9甲基转移酶)在子宫内膜癌组织中表达升高,G9ɑ 通过抑制 E-cadherin 影响内膜癌的转移和进展。提示 G9ɑ 调节的表观遗传通路可能作为子宫内膜癌的潜在治疗靶点[16]。新生儿暴露于二乙雌酚可引起小鼠子宫癌,DES可明显降低 EZH2、组蛋白赖氨酸乙酰转移酶2A和组蛋白去乙酰化酶 HDAC1、HDAC2 和 HDAC3 的表达水平[17]。子宫组织中 EZH2 的表达水平和子宫的发育阶段和激素水平有关,EZH2 表达缺失可导致异常的子宫上皮增生、子宫肥大,表明 EZH2 在子宫发育和功能中起着至关重要的作用[18]。本研究中发现 CS 暴露后小鼠子宫组织组蛋白甲基转移酶 GLP、G9α和EZH2 表达水平增加,表明这些酶的激活和 CS 暴露对子宫组织的损伤有关。提示GLP、G9ɑ EZH2可能作为靶向治疗烟草烟雾暴露导致的女性生育能力受损的新的靶点。然而,TSA 进一步加剧烟草烟雾暴露激活的 EZH2 和 H3K27me3 修饰水平变化。提示:TSA对烟草烟雾暴露激活的 EZH2 和 H3K27me3 修饰水平没有缓解作用。
综上所述,组蛋白修饰变化参与 TSA 缓解的烟草烟雾暴露所致的小鼠子宫损伤过程。本研究为阐明表观遗传机制在烟草烟雾暴露导致的女性生育能力受损中提供了前期基础,为未来治疗吸烟引起的女性不孕提供了新的靶点和思路。
