烟草转录因子NtMYB4a响应干旱、低温和茉莉酸甲酯胁迫的功能分析
2021-02-07蒋悦罗倩姜超英孙光军聂琼
蒋悦,罗倩,姜超英,孙光军,聂琼,2*
(1贵州大学烟草学院,贵阳 550025;2贵州大学农学院,贵阳 550025;3贵州省烟草公司,贵阳 550081)
植物在生长发育的各个阶段都会受到各种生物或非生物胁迫的影响而导致减产。为了适应自然界中的各种胁迫,植物在长期的生存与进化中形成了一系列的应对措施,从分子、细胞、生理和生化水平做出适应性调整,以抵御和适应胁迫。如积累甜菜碱、脯氨酸等有益代谢产物来维持细胞内的渗透压平衡,诱导相关抗逆基因的表达,合成具有特殊功能的酶等来增强植物的抗逆性[1]。在植物抗逆应答过程中,转录因子起着关键的调控作用。当植物遭受干旱、低温、盐等非生物胁迫时,转录因子会在转录水平和代谢水平迅速做出响应,诱导和调控胁迫响应相关基因的表达[2]。MYB转录因子是植物体内最大的一类转录因子,大量研究表明其参与非生物胁迫的应答和调控。如过表达SbMYB15的烟草能够显著提高其对PEG模拟干旱和盐胁迫的耐性[3];MaMYBR1在香蕉参与响应低温、干旱和盐胁迫中起着重要的作用[4];在盐和热胁迫下,Os-MYB340在水稻叶和根中的表达量明显上调[5];过表达BpMYB4基因能让白桦在低温胁迫中产生具有一定的抵抗低温能力的物质[6];AtMYB49表达量的增加提高了拟南芥叶片中的Ca2+水平,增强了拟南芥抗氧化能力[7];在蓝莓愈伤组织中过表达Vc-MYB4a增强了其对盐、干旱、寒冷、冷冻和热胁迫的敏感性[8]。
脯氨酸是植物体内最重要的渗透调节物质之一,具有维持植物细胞膜结构稳定性和清除活性氧的作用[9]。在逆境条件下(热、冻、旱、盐碱、冷),植物体内脯氨酸的含量显著增加,而脯氨酸的含量在一定程度上反映了植物的抗逆性,抗旱性和抗寒性强的品种中往往积累较多的脯氨酸[10]。丙二醛是膜脂过氧化的产物之一,它的产生能加剧膜的损伤,其含量与植物的抗性呈负相关[11]。
烟草起源于雨量充沛的热带,对生态环境非常敏感,是我国重要的经济作物之一。发掘烟草中非生物胁迫相关的转录因子对通过分子生物学手段增强烟草的抗逆能力具有重要的意义。目前,有关烟草MYB转录因子参与非生物胁迫的研究较少。本研究以NtMYB4a过表达和CRISPR/Cas9敲除株系及其野生型烟株为材料,分析了干旱、低温和茉莉酸甲酯(MeJA)胁迫下NtMYB4a表达变化以及脯氨酸和丙二醛含量的差异,探讨了NtMYB4a对干旱、低温和MeJA胁迫的应答反应和可能参与的抗逆功能,为阐明NtMYB4a的功能和在植物抗逆基因工程中的应用提供依据。
1 材料与方法
1.1 试验材料
野生型GDH88烟株、NtMYB4a敲除烟株(K)和过表达烟株(O)为贵州大学烟草品质重点实验室保存。采用漂浮育苗的方式,将播种的育苗盘置于培养液中于28℃的光照培养箱中培养,待幼苗长至6片完整叶时选取长势一致的壮苗进行胁迫处理。分别将培养盘里的培养液换成50μM的MeJA溶液和20% PEG6000进行MeJA、模拟干旱处理;放入4℃的光照培养箱进行低温胁迫处理。对照为28℃光照培养箱中培养液培养的烟苗。每个处理20株,3次重复,分别取处理后0、1、3、6、12、24和48 h叶片,分为2份,用液氮速冻后保存于-80℃冰箱备用。
1.2 RNA提取与cDNA合成
以1.1所保存的叶片为材料,采用天根生化科技有限公司的RNAprep pure Plant Kit总RNA提取试剂盒(DP432)提取RNA,采用天根生化科技有限公司的FastKing一步法除基因组cDNA第一链合成预混试剂,合成cDNA第一链。
1.3 实时荧光定量PCR
以L25(Gen Bank登录号为L18908)为内参,通过实时荧光定量PCR(RT-qPCR)测定NtMYB4基因的相对表达量。根据其基因序列,采用Primer5软件设计NtMYB4(Gen Bank登录号为MN_178131)基因(F:5′-GAAGAAAACCAAAGGAAATGAG-3′,R:5′-GCTGCTGTCTGATGAAGAAAC-3′)和内参基因L25(F:5′-CCCCTCACCACAGAGTCTGC-3′,R:5′-AAGGGTGTTGTTGTCCTCAATCTT-3′)的引物。实时荧光定量PCR反应体系为:2×Talentl qPCR PreMix 12.5μL;正向引物(10μM)0.75μL;反向引物(10μM)0.75μL;cDNA模板2μL;RNasefree ddH2O 9μL,总量25μL。PCR反应程序:94℃预变性30 s,94℃变性5 s,55℃退火30 s,39个循环。每个反应重复3次,采用2-ΔΔCt法计算NtMYB4a的相对表达量。
1.4 脯氨酸和丙二醛的测定
采用酸性茚三酮法测定脯氨酸含量[12],采用硫代巴比妥酸法测定丙二醛含量[13]。
2 结果与分析
2.1 干旱(PEG)胁迫下NtMYB4a表达及脯氨酸和丙二醛含量变化
以野生型烟株为对照,干旱胁迫下,NtMYB4a在过表达和敲除突变体中的表达量变化如图1-A。敲除突变体中NtMYB4a的表达量在处理前显著低于对照,干旱处理后,其表达量呈缓慢上升的趋势,处理后1 h,表达量与对照相当,处理后48 h达到最大值,是对照的2.5倍;过表达突变体中NtMYB4a的表达量在处理前和处理后都极显著高于敲除突变体和野生型烟株,相对表达量在处理后6 h达到最大值,是对照的2 810倍。
以处理前(0 h)的叶片为对照,过表达、敲除突变体和野生型烟株中NtMYB4a表达量的变化如图1-B。PEG处理后,敲除突变体中NtMYB4a的表达量迅速升高,在处理后1 h时达到最大值,是处理前的5.76倍,之后迅速下降,到处理后3 h又平缓上升。野生型烟株中NtMYB4a表达量的变化趋势与敲除突变体一致。而过表达突变体中NtMYB4a的表达量在整个胁迫过程中没有显著变化。说明Nt-MYB4a的表达易受干旱胁迫的诱导,但过表达后干旱胁迫的影响变小。
干旱(PEG)胁迫处理下,过表达、敲除突变体和野生型烟株中丙二醛和脯氨酸含量的变化趋势一致(图1-C、1-D)。从图1-C可见,过表达、敲除突变体和野生型烟株中丙二醛含量都在处理后6 h达到最大值,之后缓慢下降。敲除突变体的丙二醛含量显著高于过表达和野生型烟株,过表达突变体略低于野生型烟株。从图1-D可见,过表达、敲除突变体和野生型烟株中脯氨酸含量均在处理1 h后随处理时间的延长呈现上升—下降—上升的趋势,处理后48 h达到最大值。
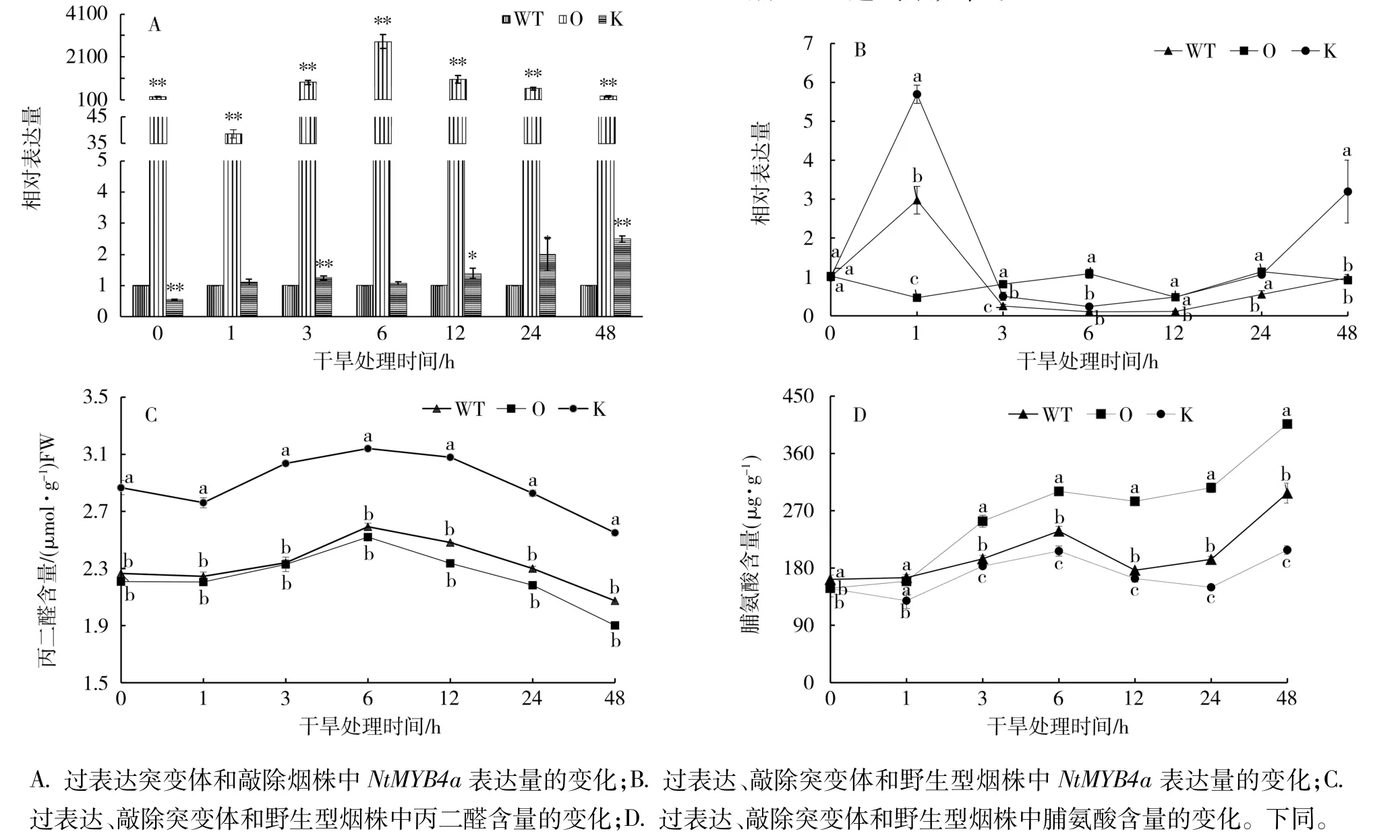
图1 NtMYB4a对干旱(PEG)胁迫的响应Fig.1 Response of NtMYB4a to drought(PEG)stress
2.2 MeJA胁迫下NtMYB4a表达及脯氨酸和丙二醛含量变化
以野生型烟株为对照,过表达和敲除突变体中NtMYB4a表达量的变化如图2-A。敲除突变体中NtMYB4a的表达在处理前低于对照,处理后呈现增加—降低—增加—降低的变化趋势,且在处理后12 h达到最大值,是对照的2.1倍。过表达突变体中NtMYB4a的表达量在处理前后都极显著高于敲除突变体和野生型烟株,在处理后6 h达到最大值,是对照的495倍。
以0 h的过表达、敲除突变体和野生型烟株为对照,过表达、敲除突变体和野生型烟株中Nt-MYB4a表达量的变化如图2-B。MeJA胁迫处理后,敲除突变体中NtMYB4a表达量1 h内持续升高,处理后6 h有所回落,之后再次上升,并在48 h表达量达到最大值,是对照的9.79倍,其变化趋势和野生型烟株一致。而过表达突变体中NtMYB4a表达量变化呈现平缓的趋势。说明NtMYB4a的表达容易受到MeJA胁迫的诱导,过表达后胁迫的影响变小。
MeJA胁迫处理下,过表达、敲除突变体和野生型烟株中丙二醛和脯氨酸含量的变化趋势一致(图2-C和2-D)。从图2-C可见,过表达、敲除突变体和野生型烟株中丙二醛含量在处理后6 h达到最小值,之后缓慢增加。从图2-D可见,过表达、敲除突变体和野生型烟株中脯氨酸含量随着胁迫时间的延长呈现增加—降低的趋势,都在处理后6 h达到最大值。
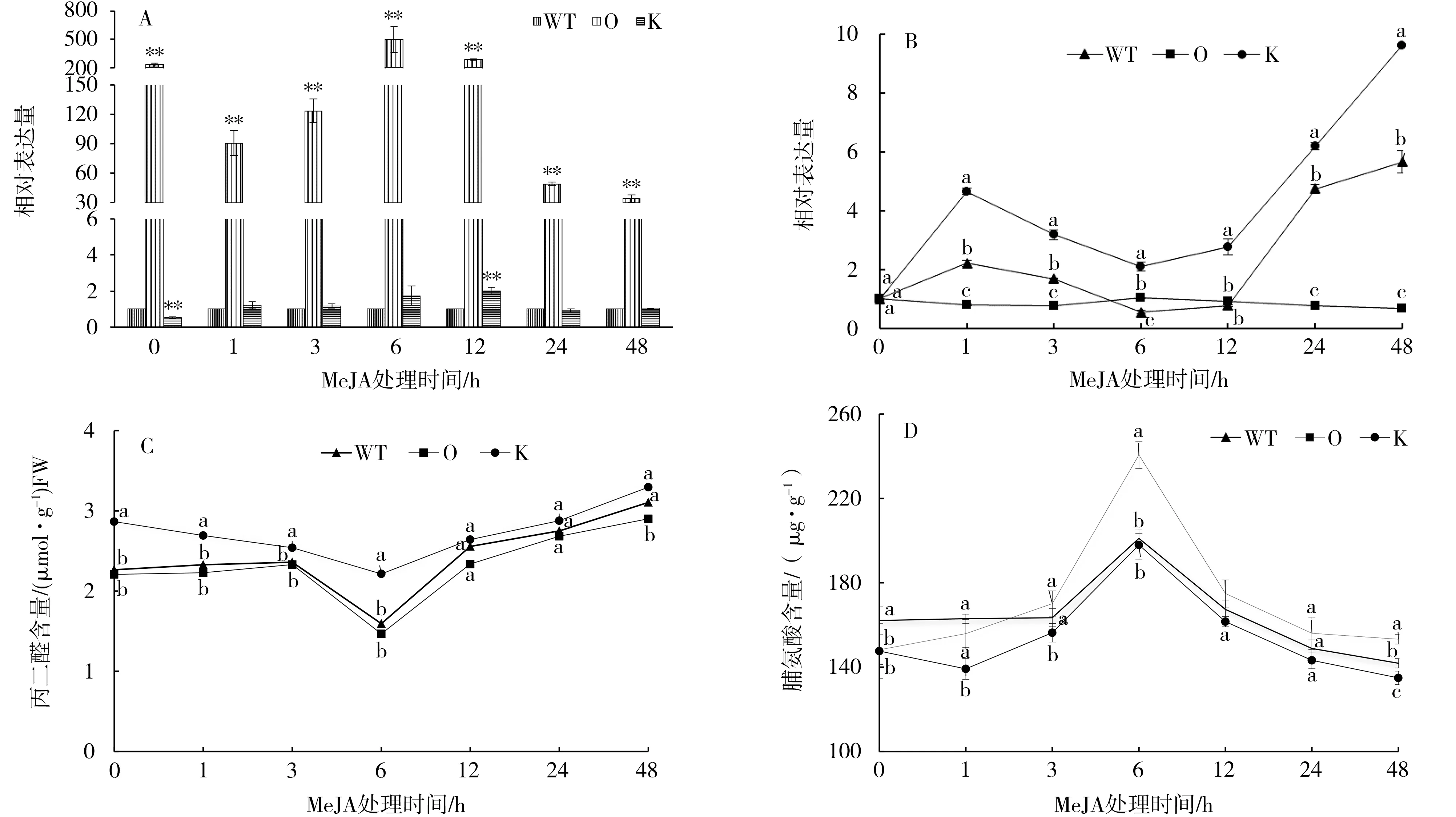
图2 NtMYB4a对MeJA胁迫的响应Fig.2 Response of NtMYB4a to MeJA stress
2.3 低温(4℃)胁迫下NtMYB4a表达及脯氨酸和丙二醛含量变化
以野生型烟株为对照,过表达和敲除突变体中NtMYB4a表达量的变化如图3-A。敲除突变体中NtMYB4a的表达量在处理前低于对照,处理后呈缓慢上升的趋势,处理后3 h与对照相当,在处理后12 h达到最大值,为对照的1.58倍:过表达突变体中NtMYB4a的表达量处理前后都显著高于敲除和野生型烟株,在处理前最高,为对照的235.6倍,处理后表达量降低。
以处理前(0 h)为对照,过表达、敲除突变体和野生型烟株中NtMYB4a表达量的变化如图3-B。低温处理后,敲除突变体中NtMYB4a的表达量迅速增加,在处理后6 h达到最大值,为对照的10.15倍,之后迅速下降,与野生型烟株中NtMYB4a表达量的变化趋势一致。而过表达突变体处理前后Nt-MYB4a的表达量无显著变化。说明NtMYB4a的表达易受低温胁迫的诱导,过表达后胁迫的影响变小。
低温胁迫处理下过表达、敲除突变体和野生型烟株丙二醛和脯氨酸含量的变化趋势不一致(图3-C和3-D)。从图3-C可见,敲除突变体丙二醛含量在处理后24 h时达到最大值,显著高于过表达突变体和野生型烟株,而过表达突变体丙二醛含量低于野生型烟株。从图3-D可见,过表达、敲除突变体和野生型烟株脯氨酸含量随着处理时间的延长均呈增加—降低—增加的趋势,均在处理后48 h达到最大值。

图3 NtMYB4a对低温胁迫的响应Fig.3 Response of NtMYB4a to low temperature stress
2.4 NtMYB4a启动子顺式作用元件分析
从NCBI(美国国家生物技术信息中心)烟草基因组数据库中获取NtMYB4a起始密码子上游2 000 bp的序列,利用Plant-CARE数据库对其顺式响应元件进行分析,发现NtMYB4a启动子含有多个作用元件(表1)。其中最多的是参与光反应的元件,如ATCT-motif、Box4、G-Box、MRE、MRE和TCTmotif;还含有赤霉素响应元件P-box、干旱诱导位点MBS、低温响应元件LTR、厌氧调节因子ARE、脱落酸反应元件ABRE、60K蛋白结合位点Unnamed-1、生长素响应元件TGA-element、防御和应激反应元件TC-rich repeats、茉莉酸甲酯(MeJA)反应顺式作用调节元件CGTCA-motif、启动子和增强子的共同顺式作用元件CAAT-box等。表明烟草NtMYB4a的表达可能受激素、光、低温、干旱、氧等调节。

表1 烟草NtMYB4a启动子序列分析结果Table 1 Tobacco NtMYB4a promoter sequence analysis
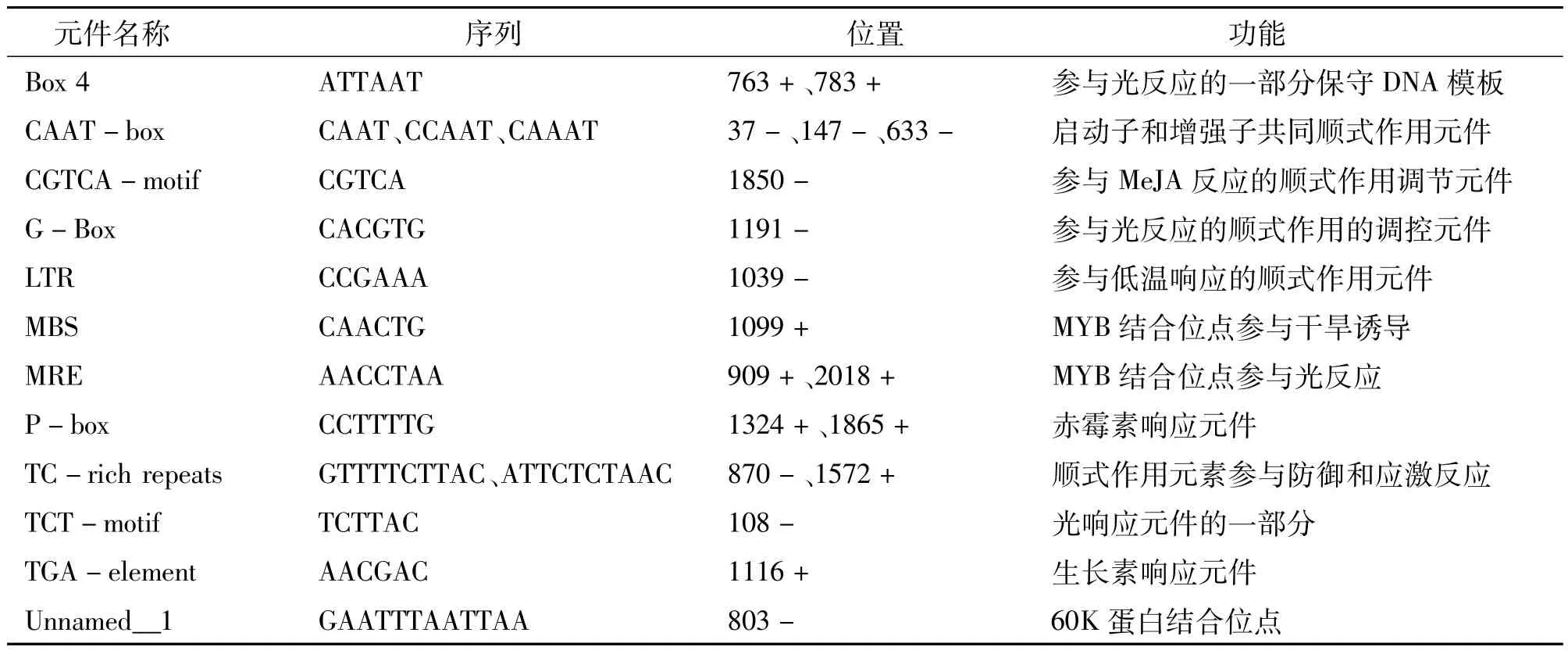
续表1
3 讨论
低温和干旱是作物在生长发育过程中最常见的非生物胁迫,对作物的产量和质量有很大的影响。植物受到胁迫时,外源MeJA能够激发防御基因的表达,从而诱导植物的化学防御。在所有的生物体内都存在转录因子,它通过控制靶基因的转录速率来完成生物体的不同代谢过程[14]。当生物遭受胁迫时,转录因子上的结构域就会与其他基序结合抑制或激活转录以响应内源或外源胁迫。研究表明,过量表达BpMYB4可明显增强渗透调节物质和保护酶系统在白桦树中的含量[16];在盐旱胁迫下,小麦Tamyb31基因在0.5 h就明显上调表达,说明其参与了早期盐旱胁迫信号的转导[15]。当植株遭受胁迫时,体内的渗透调节物质脯氨酸的积累量通常增多,使植株体内渗透势发生改变,从而提高植株的抗逆性[16]。一般低温胁迫下抗冻性强的品种脯氨酸的含量显著高于抗冻性弱的品种[17]。当胁迫持续加剧时,植物自身保护酶系统平衡就会被打破,而产生的大量活性氧离子加剧了对细胞膜的伤害,丙二醛(MDA)等自由基不断增加,对植物造成毒害作用。因此MDA可以用作间接预测植物抗逆性的指标[18]。
4 结论
本研究通过对烟草NtMYB4a基因在干旱、Me-JA和低温胁迫下的表达分析及对丙二醛和脯氨酸含量的测定,发现NtMYN4a在不同材料、不同胁迫处理下表达模式各不相同。过表达突变体中Nt-MYB4a表达量很高,在受到胁迫时反应迟钝,表达量变化不明显,且脯氨酸含量最高,丙二醛含量最低;而敲除突变体和野生型烟株中NtMYB4a表达量本身较低,在受到胁迫时极其敏感,其表达量变化波动大且变化趋势相似。但与野生型烟株相比,敲除突变体脯氨酸含量更低,丙二醛含量更高。在干旱、MeJA和低温胁迫下,敲除突变体中丙二醛含量高于过表达突变体和野生型烟株,脯氨酸含量低于过表达突变体和野生型烟株。随着处理时间的延长,敲除突变体NtMYB4a表达量上升,同时丙二醛含量呈现下降的趋势,而脯氨酸作为渗透调节物质则缓慢增加,说明NtMYB4a表达量的改变增强了烟株的抗逆性。进一步分析发现,NtMYB4a的启动子上有响应低温、干旱、MeJA及其他防御和应激反应元件。根据实验结果,推测NtMYB4a参与了烟草对低温、干旱、MeJA胁迫的应答,可对其在非生物胁迫中的功能及其在烟草抗逆基因工程中的应用进行进一步的研究。
