全国细菌耐药监测网2014—2019年血标本病原菌耐药性变迁
2021-02-06全国细菌耐药监测网
全国细菌耐药监测网
血流感染(bloodstream infection,BSI)是由各种病原微生物和/或毒素侵入血流所引起的血液感染,可引起病死率较高的严重的全身感染性疾病[1],尤其是多重耐药菌如耐碳青霉烯类革兰阴性杆菌等感染,病死率高,患者负担重[2],动态监测血流感染病原菌的分布及耐药趋势具有十分重要的临床意义。研究2014—2019年全国细菌耐药性监测网(China Antimicrobial Resistance Surveillance System, CARSS)血标本来源病原菌的分布和耐药性变化,可为临床治疗血流感染提供合理用药参考。
1 资料与方法
1.1 资料来源 2014年1月—2019年9月CARSS临床血标本分离病原菌资料,所有菌株均为患者血标本分离的非重复菌株。经系统自动审核和人工审核后,CARSS不同年度最终纳入数据分析的医院数分别为1 110、1 143、1 273、1 307、1 353、1 375所。

1.3 质量控制 按照CLSI要求进行质量控制,在试验条件稳定下每周施行一次常规质量控制程序。质控菌株包括大肠埃希菌 ATCC 25922、金黄色葡萄球菌 ATCC 29213、金黄色葡萄球菌 ATCC 25923、肺炎克雷伯菌 ATCC 700603、阴沟肠杆菌 ATCC 700323、铜绿假单胞菌 ATCC 27853、肺炎链球菌 ATCC 49619。
1.4 数据分析 应用WHONET软件进行数据分析,采用株数、百分率对数据进行描述。
2 结果
2.1 病原菌构成 2014—2019年血标本分离细菌1 599 273株,革兰阴性菌828 846株(51.8%),革兰阳性菌770 427株(48.2%)。病原菌分离率居首位的为大肠埃希菌(402 818株,25.2%),其次分别为表皮葡萄球菌(193 968株,12.1%)、肺炎克雷伯菌(162 613株,10.2%)、人葡萄球菌(136 396株,8.5%)和金黄色葡萄球菌(106 915株,6.7%)。非发酵菌中铜绿假单胞菌(43 565株,2.7%)和鲍曼不动杆菌(37 244株,2.3%)所占比例最高,但呈逐年下降趋势。革兰阳性球菌以表皮葡萄球菌和人葡萄球菌为主。血标本细菌分离居前10位的细菌见图1和表1。
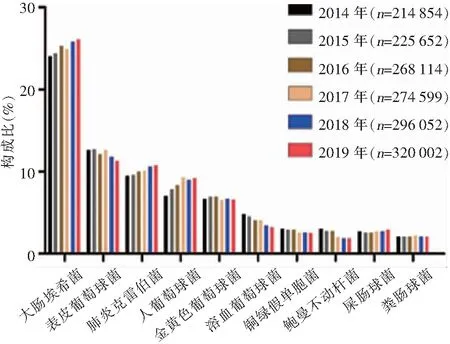
图1 2014—2019年CARSS血标本分离居前10位的细菌及构成比
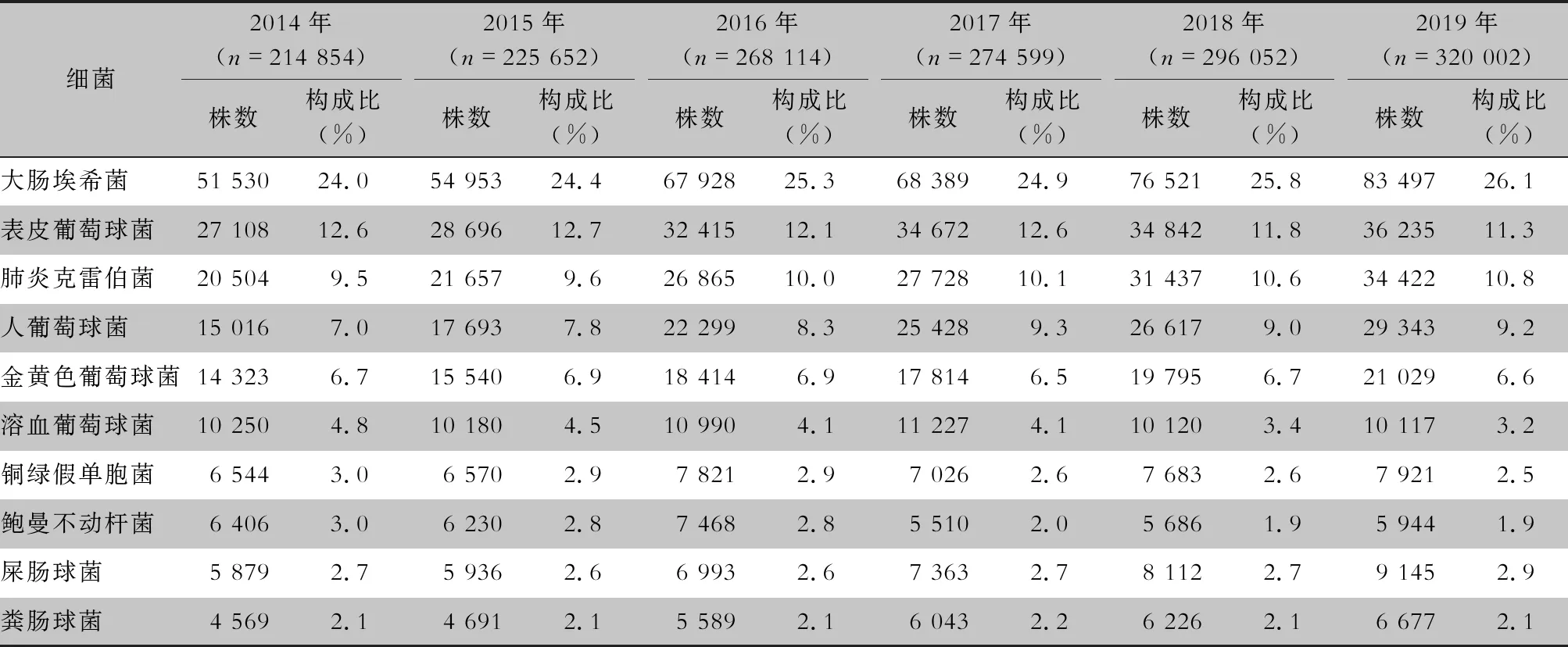
表1 2014—2019年CARSS血培养分离居前10位的菌种分布
2.2 病原菌耐药情况
2.2.1 革兰阴性菌耐药情况 血流感染中分离的大肠埃希菌对碳青霉烯类、阿米卡星、哌拉西林/他唑巴坦及2019年开始检测的替加环素持较高的体外抗菌活性,敏感率约90%;对亚胺培南的耐药率有所增高,对美罗培南的耐药率为0.8%~1.3%。肺炎克雷伯菌对碳青霉烯类、阿米卡星持较高的体外抗菌活性,敏感率约90%,但对亚胺培南、美罗培南的耐药率有所增高,耐药率为6.6%~11.7%。肺炎克雷伯菌整体耐药性高于大肠埃希菌。2014—2019年铜绿假单胞菌对亚胺培南、美罗培南的耐药率分别为13.0%~19.2%、10.8%~16.9%,对β-内酰胺类复合制剂、氨基糖苷类药物和喹诺酮类药物耐药率均为10%左右,且对氨基糖苷类药物和喹诺酮类药物耐药率呈逐年下降趋势,其中对阿米卡星耐药率由7.1%降至2.6%。鲍曼不动杆菌对亚胺培南、美罗培南的耐药率分别为45.9%~60.9%、46.8%~61.7%,对米诺环素的耐药率分别为14.6%~22.0%。见表2~5。
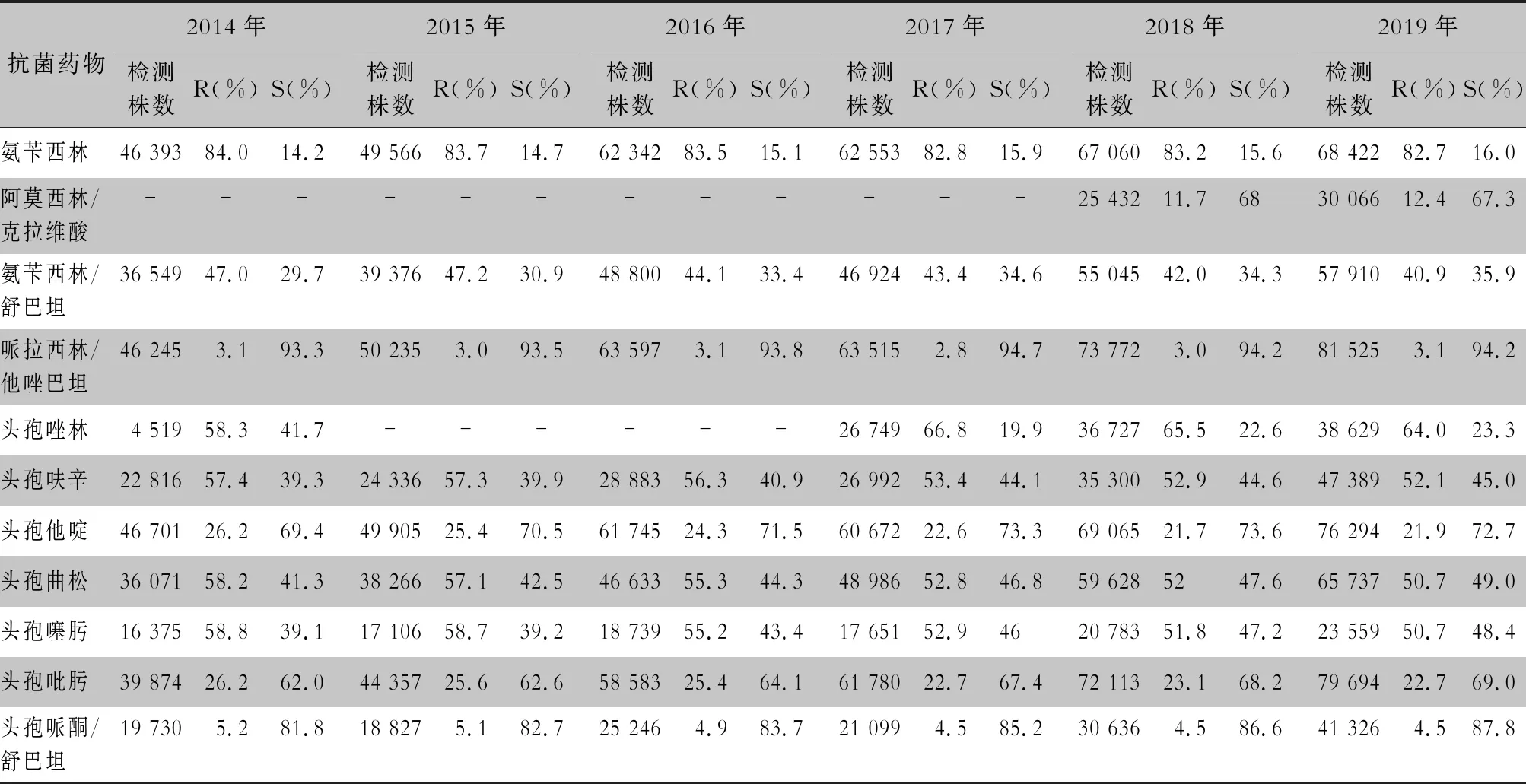
表2 2014—2019年CARSS血培养分离的大肠埃希菌对抗菌药物的药敏结果
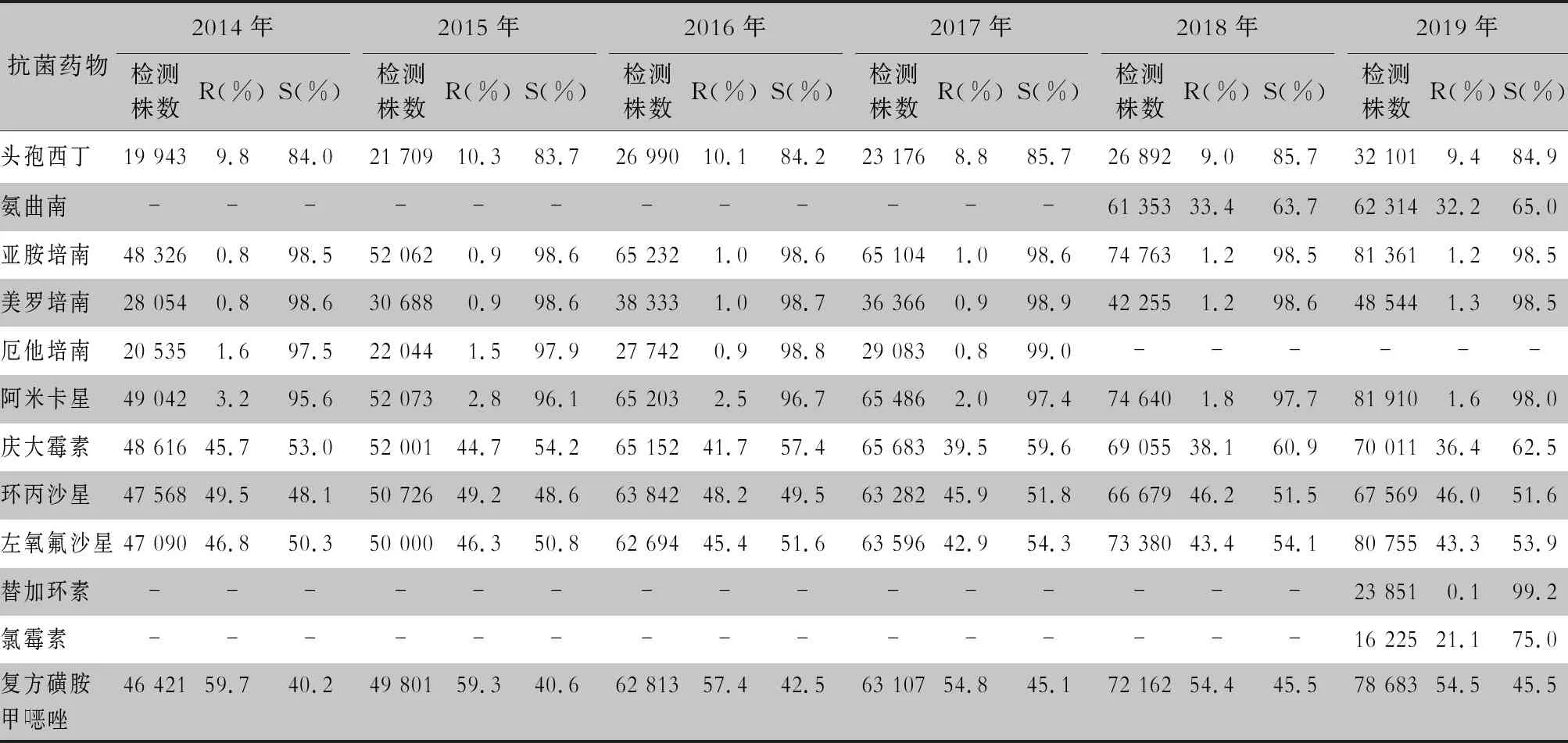
续表2 (Table 2, Continued)
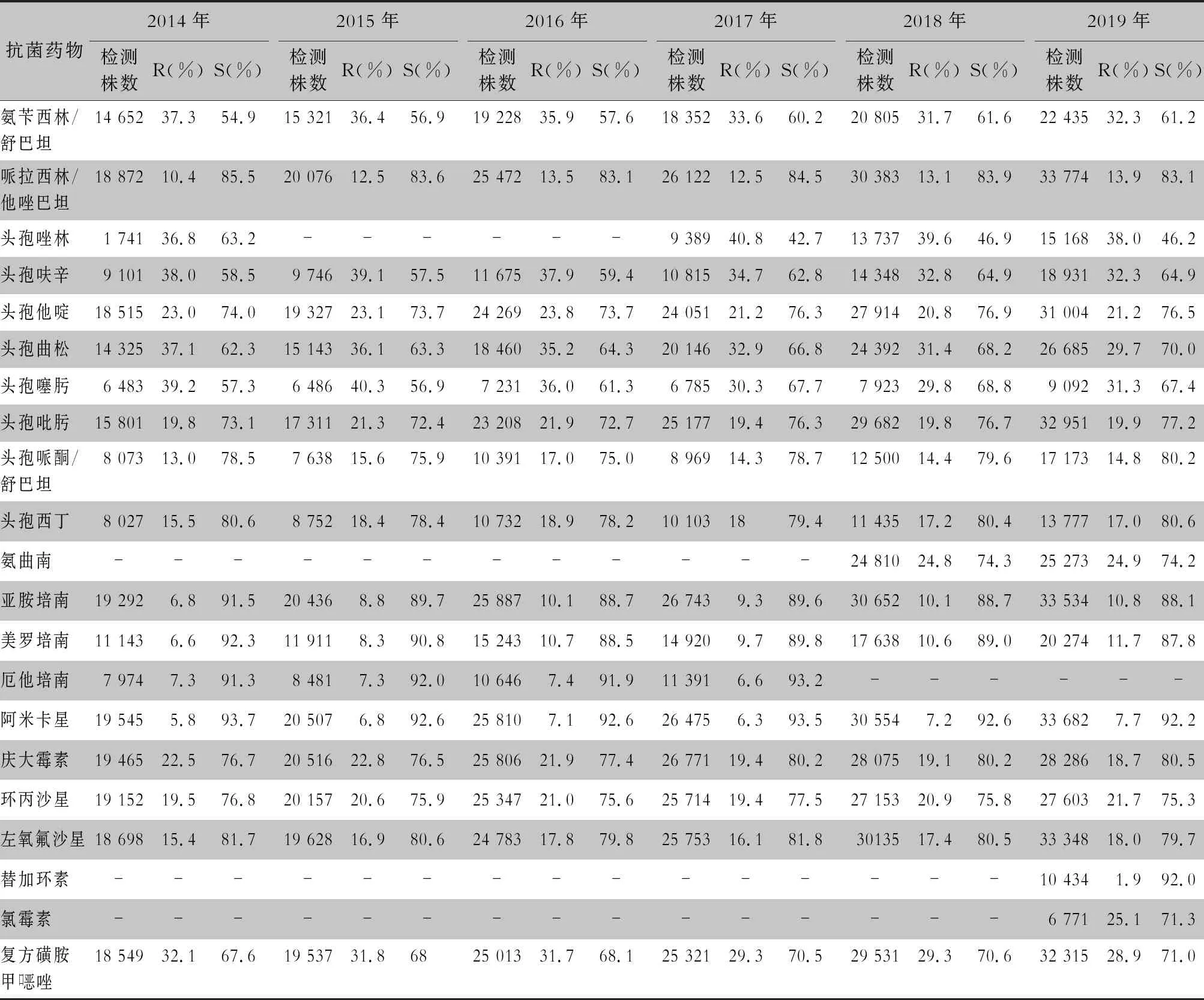
表3 2014—2019年CARSS血培养分离肺炎克雷伯菌对抗菌药物的药敏结果
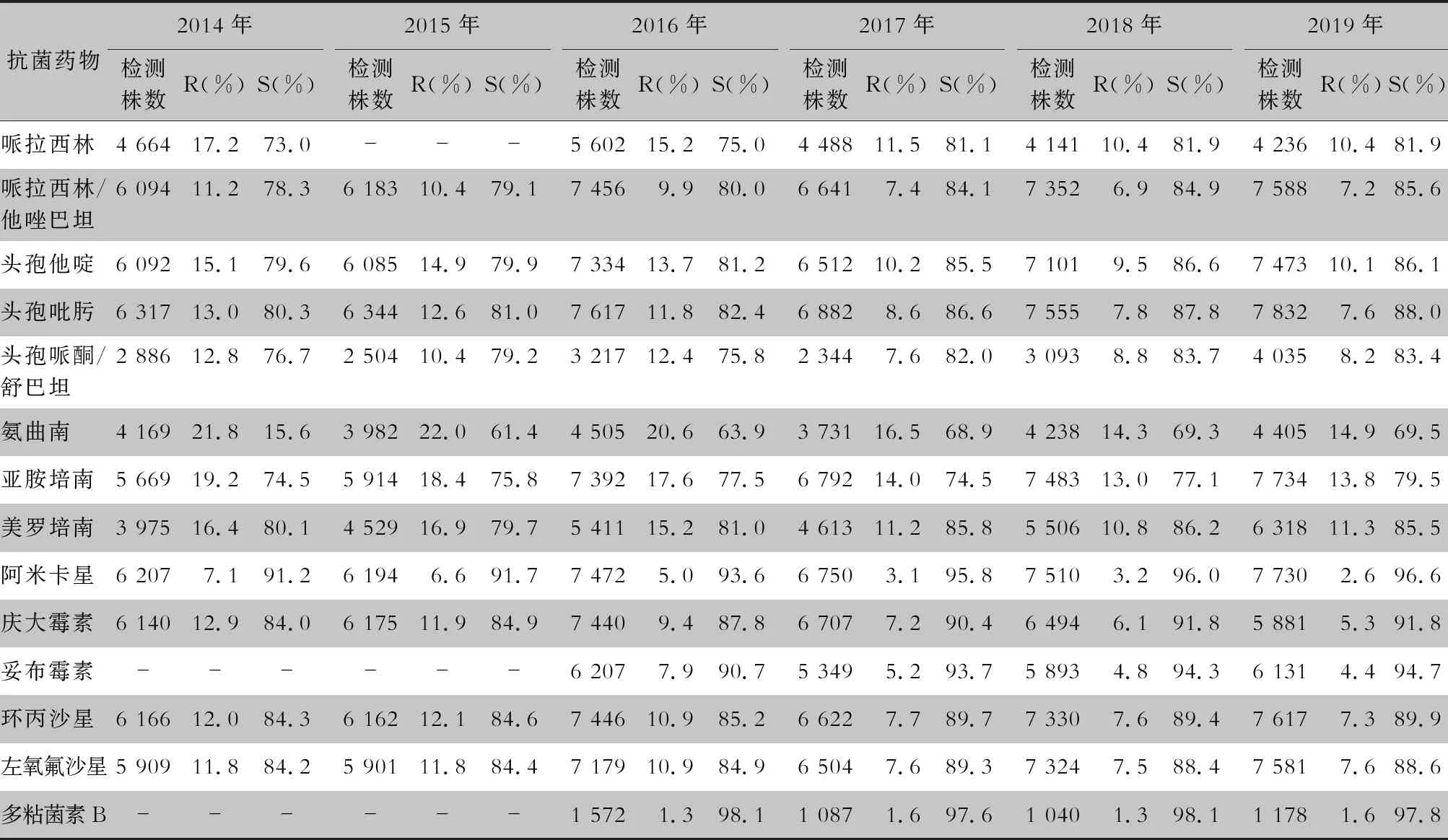
表4 2014—2019年CARSS血培养分离铜绿假单胞菌对抗菌药物的药敏结果
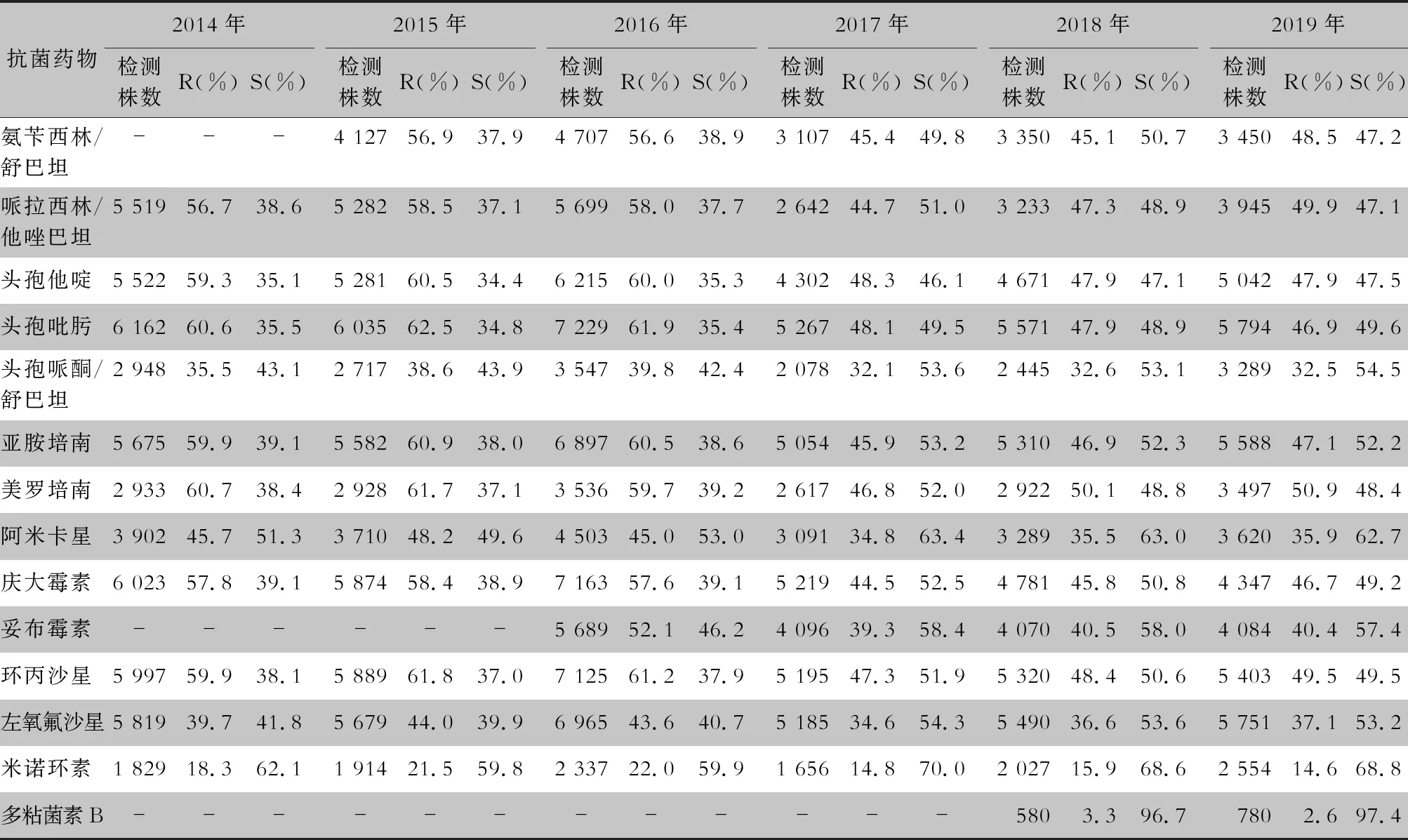
表5 2014—2019年CARSS血培养分离鲍曼不动杆菌对抗菌药物的药敏结果

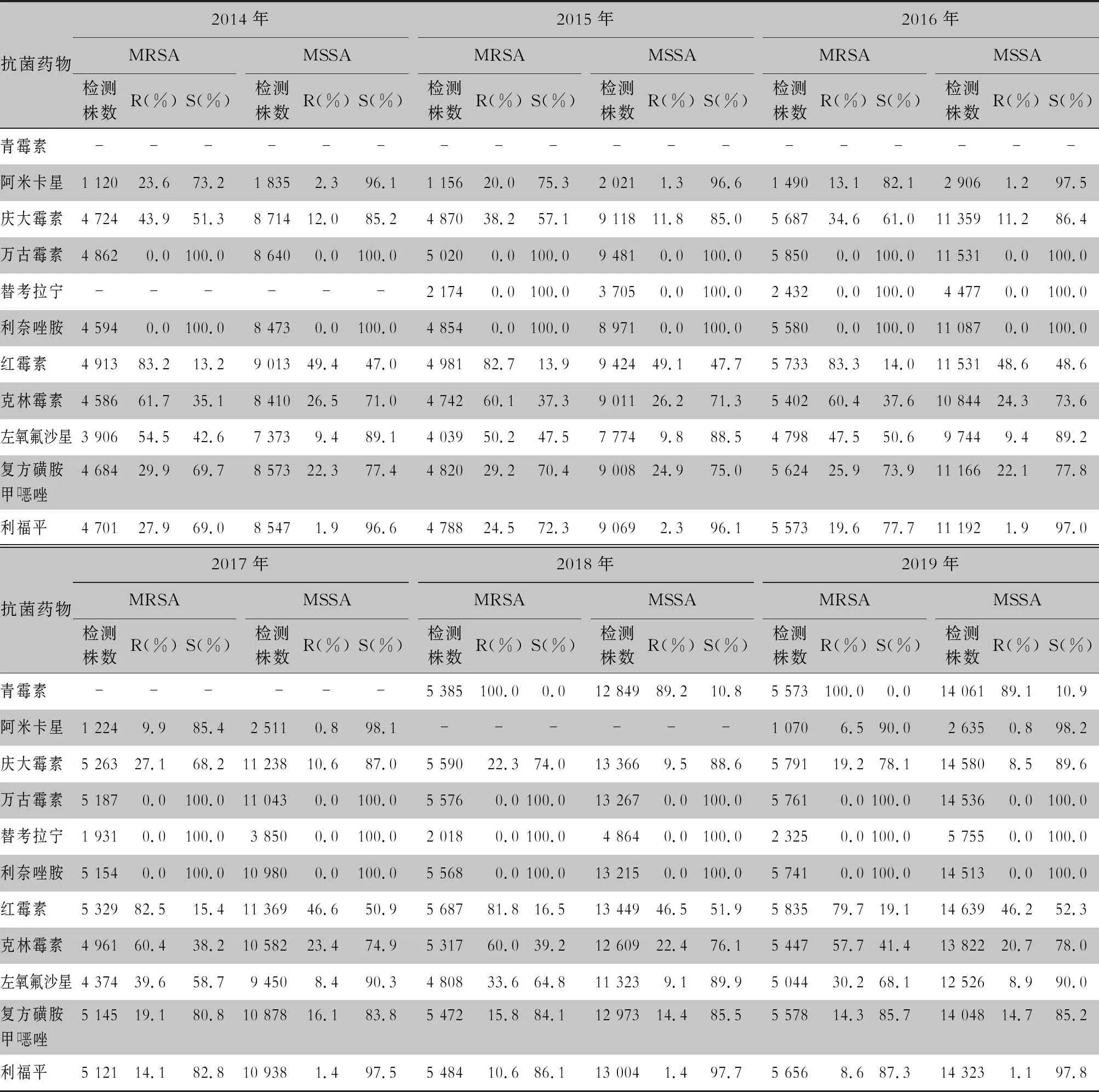
表6 2014—2019年CARSS血培养分离金黄色葡萄球菌对抗菌药物的药敏结果
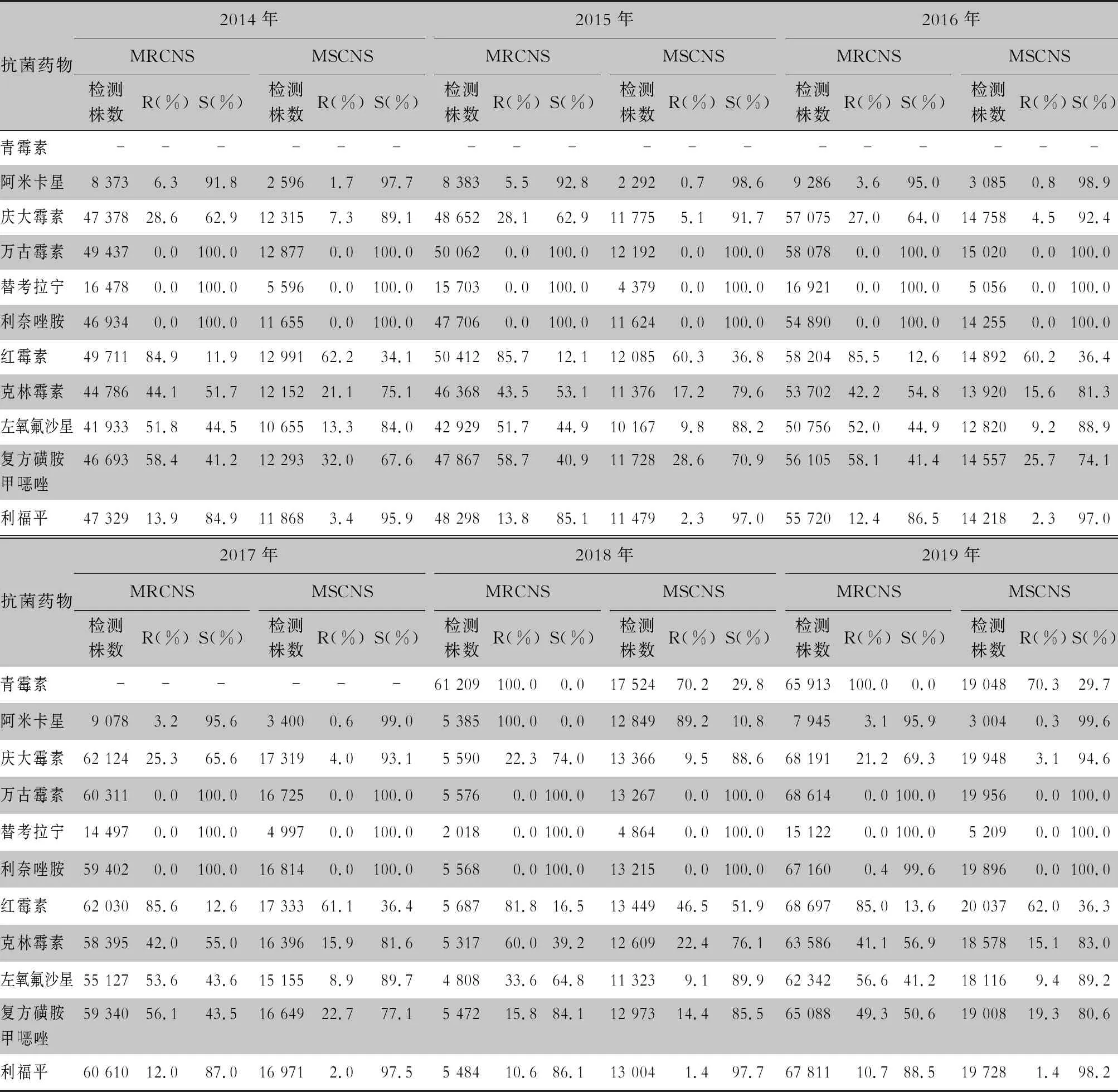
表7 2014—2019年CARSS血培养分离的凝固酶阴性葡萄球菌对抗菌药物的药敏结果
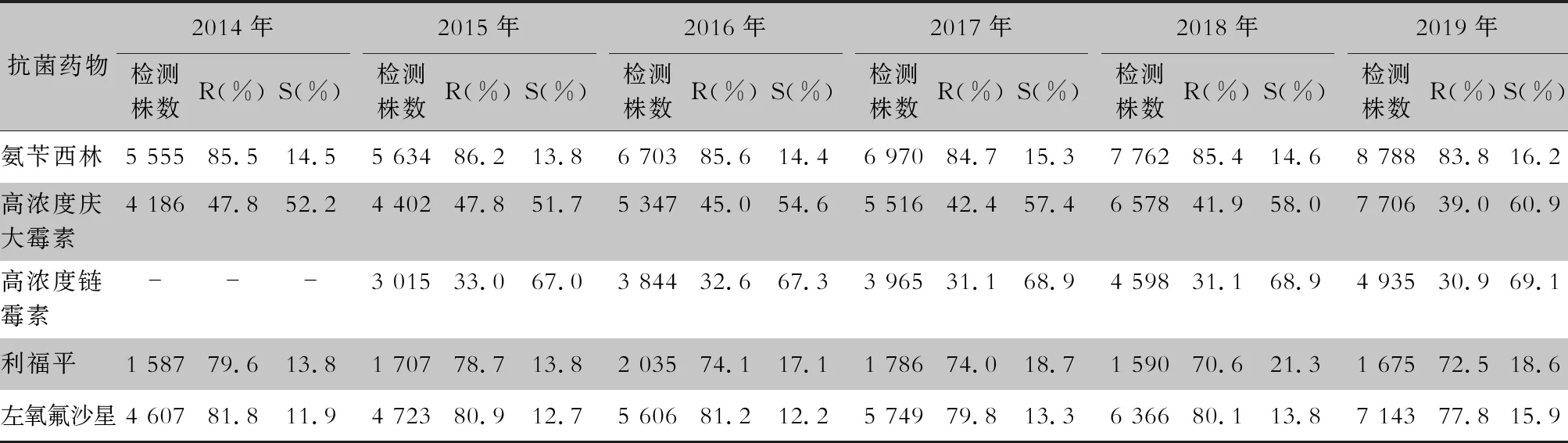
表8 2014—2019年CARSS血培养分离的屎肠球菌对抗菌药物的药敏结果
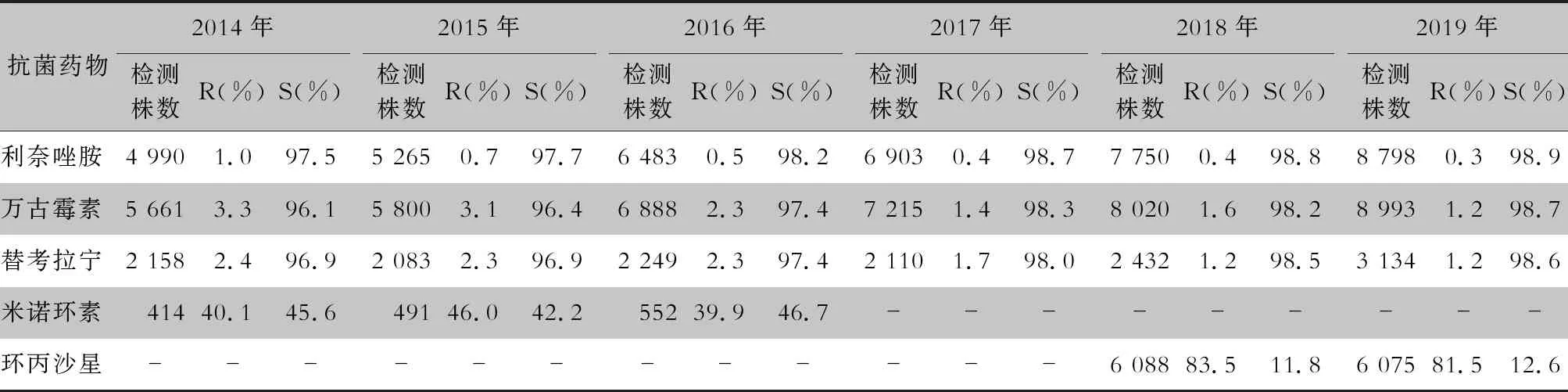
续表8 (Table 8, Continued)

表9 2014—2019年CARSS血培养分离的粪肠球菌对抗菌药物的药敏结果
3 讨论
本研究结果显示,我国2014—2019年血标本分离病原菌菌种构成无明显变化,大肠埃希菌、表皮葡萄球菌和肺炎克雷伯菌一直是居前3位的病原菌,与2013—2016年覆盖45个国家200多个医疗中心的SENTRY耐药监测项目[3](无我国数据)略有不同,其血标本病原菌分离居前3位的为大肠埃希菌、金黄色葡萄球菌和肺炎克雷伯菌。血标本病原菌中革兰阴性杆菌所占构成比一直高于革兰阳性球菌,其主要病原菌大肠埃希菌和肺炎克雷伯菌,对第一、二、三代头孢菌素具有较高的耐药率,且可通过质粒水平传播耐药性,临床治疗效果有限,致死率较高,已成为重大的公共卫生问题。
碳青霉烯类抗生素是治疗产超广谱β-内酰胺酶(ESBLs)多重耐药革兰阴性杆菌的一线用药,本研究中大肠埃希菌对碳青霉烯类抗生素耐药率为0.8%~1.6%,肺炎克雷伯菌对亚胺培南、美罗培南耐药率在6.6%~11.7%,均呈逐年上升趋势。全球耐碳青霉烯类肠杆菌目细菌(CRE)的主要耐药机制之一为产碳青霉烯酶(carbapenemase-producing Enterobacteriales, CPE),且易水平传播[4-5],提示临床一旦发生CRE感染,应上报医院感染并采取医院感染防控措施[6]。Yoon等[7]报道,韩国细菌耐药监测系统数据中血标本分离的CPE大肠埃希菌占0.2%,肺炎克雷伯菌占3.1%。我国CPE以KPC-2型酶为主要流行基因型,其次为NDM基因型,不同基因型其临床治疗策略及预后有所不同[8-9],推荐必要时检测CPE的基因型或酶型。头孢他啶/阿维巴坦、替加环素、粘菌素以及联合用药是治疗CRE等多重耐药菌的最后一道防线[10-13]。虽然本研究中没有替加环素完整的药敏结果,但已有多篇研究[8, 14-16]报道分离出替加环素不敏感的肺炎克雷伯菌和大肠埃希菌,其耐药机制与RND 外排泵表达上调相关。已分离出耐粘菌素的肠杆菌目细菌,并检测到可水平转移的粘菌素耐药基因mcr-1[17],以及同时携带碳青霉烯酶NDM 基因和mcr-1 基因的临床菌株[18],并且有越来越多的粘菌素耐药基因被检测出,如mcr-2、mcr-3、mcr-4、mcr-5、mcr-6、mcr-7、mcr-8、mcr-9[19-21],这将加剧当前临床抗菌药物使用窘迫的局面,同时也给抗菌药物使用管理提出了更高的要求。
血标本来源的非发酵菌以铜绿假单胞菌和鲍曼不动杆菌为主,连续6年CARSS监测数据显示,铜绿假单胞菌对各类抗菌药物的敏感性优于鲍曼不动杆菌,且6年来铜绿假单胞菌和鲍曼不动杆菌对临床常用抗菌药物的敏感性总体呈上升趋势,但由铜绿假单胞菌引起的血流感染其病死率及进展速度高于其他革兰阴性杆菌和金黄色葡萄球菌所致的血流感染[22-23],可能与铜绿假单胞菌毒力、药敏变化快及易形成生物膜有关。鲍曼不动杆菌的敏感性虽然总体呈上升趋势,但呈现多重耐药,仅多粘菌素B(2018—2019年数据)的敏感率大于95%,米诺环素的敏感率不超过70%,其余大多常见抗菌药物的敏感率低于60%,与2005—2014年CHINET不动杆菌属细菌耐药性监测数据基本一致[24]。尽管多粘菌素B的敏感率大于95%,但其毒副作用大,为临床抗感染治疗带来困难。为遏制我国鲍曼不动杆菌耐药性和感染的快速增长,2012年我国完成了《中国鲍曼不动杆菌感染诊治与防控专家共识》[25],推荐以替加环素为基础的联合用药治疗鲍曼不动杆菌引起的严重感染。

综上所述,我国2014—2019年血标本来源病原菌菌种构成无明显变化,大肠埃希菌、表皮葡萄球菌、肺炎克雷伯菌仍是血流感染最主要的病原菌。虽然本次纳入的均为血标本来源的病原菌,但并不一定都为病原菌,部分可能为污染菌,尤其是分离率居第二位的表皮葡萄球菌,提示应重视葡萄球菌感染,并不断提高血培养送检率和合格率。另外,常用抗菌药物的体外敏感率上下浮动幅度较小。但仍需对多重耐药菌,尤其是可以水平转移耐药性的菌株进行医院感染防控,减缓耐药性的发生,为临床合理用药保驾护航。
