农药与重金属复合污染的生态毒理学研究进展
2021-02-05杨永猛陶玉龙窦华山许加明卜元卿单正军
杨永猛, 陶玉龙, 窦华山, 许加明, 杨 彦,卜元卿, 单正军, 周 蓉*,
(1. 常州大学 环境与安全工程学院,江苏 常州 213164;2. 汕头广工大协同创新研究院,广东 汕头 515041;3. 生态环境部南京环境科学研究所,南京 210042;4. 呼伦贝尔市北方寒冷干旱地区内陆湖泊研究院,内蒙古 呼伦贝尔 021000;5. 南京林业大学 林学院 现代南方林业协同创新中心,南京 210037;6. 广东工业大学 环境健康与污染控制研究院,广州 510006)
0 引言
大量研究表明,生物实际生存的环境中往往同时并存着各类污染物,生物会受到不同污染物的危害,而且暴露于复合污染物中还可能会使得其中某些成分的毒性增强[1]。因此,复合污染的生态毒理学效应受到了越来越多的关注,已逐渐成为环境领域研究的热点。
重金属和农药是环境中普遍存在的两类重要污染源。重金属是最容易积累的有毒物质,很难在环境中降解,即使是低剂量的重金属残留也会造成严重的问题[2]。重金属污染通常来自于采矿、冶炼等工业和农业活动[3],以废渣、废气、废水等方式进入环境,在动、植物体内富集。在水生生态系统中,重金属具有生物蓄积性、毒性及持久性,对水生生态系统的自我净化能力造成了严重压力[4]。重金属还可以通过食物链转移到人体,从而对人体健康构成潜在威胁[5]。土壤中的重金属不可被生物降解,一旦进入土壤即可存在很长时间,甚至长达数千年[6]。农药种类繁多,常用的有杀菌剂、除草剂及杀虫剂等[7]。农药污染主要来源于农药施用后在自然界中的残留,原药及其降解产物会污染大气、水体和土壤,破坏生态环境。例如拟除虫菊酯类农药对鱼类和水生无脊椎动物等水生生物具有高毒性,因此其在水体中的残留引起了人们的广泛关注[8-9]。有机氯类农药和无机的含汞农药性质都较稳定,容易在环境和生物体内残留,导致包括人类在内的捕食者体内污染物浓度很高,严重影响人体和生态健康。另外,有机农药产品中也常含有重金属,例如Defarge 等[10]在多种草甘磷制剂中检测出了砷 (As)、铬 (Cr)、镍(Ni)、铅 (Pb) 和钴 (Co) 等重金属成分。Jayasumana等[11]也从12 种草甘膦制剂中检出了As,平均含量为1.9 mg/kg。因此,重金属也可能会随着农药一起进入环境中。
随着工业化进程加速,重金属和农药的大量及不合理使用,导致污染事件频发,又因重金属和部分农药如有机氯类农药能够在环境中长期存在并不断积累,在环境中循环,因而具有潜在的复合暴露风险,但二者间的相互作用究竟会对环境造成何种影响目前尚不明确。当前,科研工作者已对农药与重金属的相互作用进行了一定程度的研究,证明部分农药与重金属之间存在协同或拮抗作用,如毒死蜱 (chlorpyrifos) 与甲基汞复合暴露和单一暴露相比,在中等质量浓度水平下 (毒死蜱 0.049 μg/L,甲基汞 32.34 μg/L) 即可显著抑制端足虫 Hyalella azteca 乙酰胆碱酯酶 (AChE) 活性,表明毒死蜱和甲基汞二者间发生了协同作用[12]。与单一暴露相比,Cu2+和草甘膦 (glyphosate) 复合暴露显著降低了对赤子爱胜蚓的毒性,表明Cu2+和草甘膦二者间存在拮抗作用[13]。因此,研究重金属与农药的复合污染状况和毒理学效应具有重要的理论和现实意义。本文拟就此领域的相关研究进展进行综述,并就该领域未来的研究发展方向进行展望,以期为相关研究工作的开展提供思路和参考。
1 农药与重金属的污染现状
随着工农业的持续发展,重金属和农药成分通过人类活动不断进入环境当中,使得农药和重金属复合污染在各种环境介质中普遍存在。
1.1 农药与重金属对水体的污染
在水体和沉积物中,农药和重金属污染普遍存在 (表1)。Machado 等[14]在对巴西某河流的重金属和农药暴露进行健康风险评估时发现,其河水中重金属含量排前3 位的分别是锌 (Zn)、锰(Mn) 和铜 (Cu),同时铝 (Al)、镉 (Cd)、Cu、Mn、Pb 及Zn 含量也超过了美国环保局 (USEPA) 的基准值;农药莠去津 (atrazine) 的含量高于欧盟标准值,对人体健康存在一定风险,并且其风险在雨季还会有一定程度的增大。Polidoro 等[15]发现,美属萨摩亚地区沿海溪水中存在有机磷类农药和重金属共存的状况,对当地淡水和海洋环境造成了不良影响。Salvadó 等在西班牙东北部某湿地地表水中同时发现了拟除虫菊酯和重金属污染[16]。Dong 等在中国辽宁省大连市主要饮用水源地也检测发现了重金属和农药污染共存的现象[17]。邢春博[18]在对中国吉林省中部河流底泥进行潜在生态风险评估时发现,其汞 (Hg) 和Cd 的污染风险较大,同时发现底泥中有机氯类农药γ-六六六 (γ-BHC) 和异狄氏剂 (endrin) 的检出率较高,且风险值也较高。
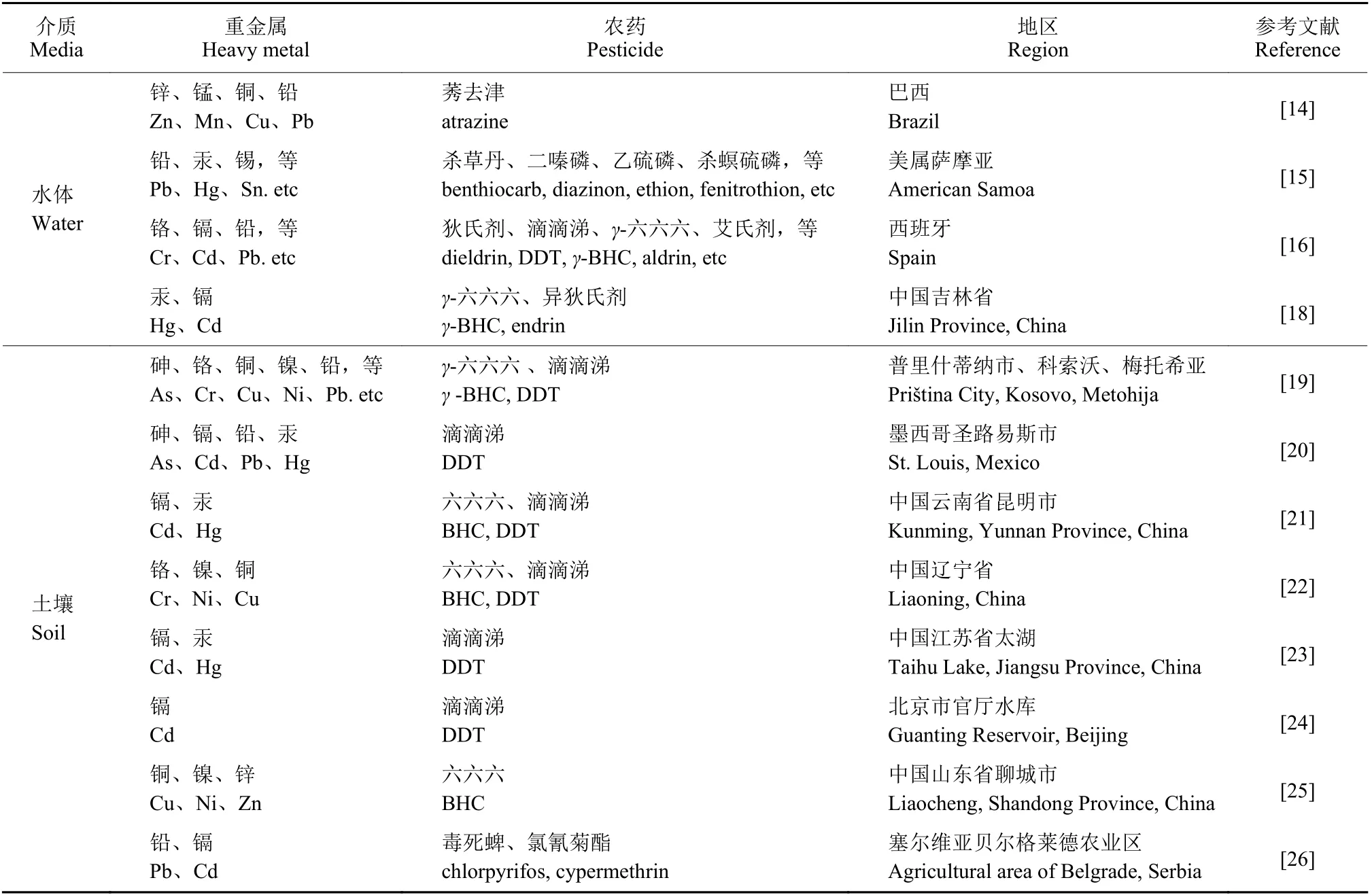
表1 部分农药与重金属的复合污染现状Table 1 The compound pollution status of some pesticides and heavy metals
1.2 农药与重金属对土壤的污染
人类活动还导致农药和重金属不断进入土壤环境中[27],与水体相比,农药和重金属污染在土壤环境中更为普遍,且由于土壤中各种组分相较于水体更加复杂,因而受到污染后也更难治理。此外,部分农药还可能会随着土壤水分的蒸发而直接蒸发,进入大气环境中[28],从而带来更多环境问题。2005 年至2013 年,中国生态环境部和自然资源部对全国土壤污染状况进行了调查,结果发现,土壤污染总超标率为16.1%,其中前3 位均为重金属,分别是Cd、As 和Cu,超标率分别为7.0%、2.7%和2.1%[29],农药六六六和滴滴涕 (DDT)超标率分别为0.5%和1.9%[30]。
重金属污染在土壤环境中普遍存在。王颜昊等[31]在对中国黄河三角洲表层土壤重金属污染进行调查时发现,其Cd 含量高于国家二级标准值,且重金属的空间分布呈现自西北向东南递减的趋势,同时土壤中的重金属还存在扩散风险。图雅日拉等[32]在对废弃冶炼厂重金属Cd 污染扩散问题进行研究后发现,废弃冶炼厂周边土壤存在不同程度的Cd 富集现象,Cd 含量在0.09~6.96 mg/kg之间,平均为1.18 mg/kg,高于当地土壤Cd 的背景值。旦增等[33]在对中国西藏自治区拉萨市生活垃圾卫生填埋场土壤中重金属含量进行调查时发现,拉萨市生活垃圾填埋场对周边土壤环境产生了一定程度的污染,其中Pb、Cr、Ni、Cd、As、Hg 及Zn 的含量均高于拉萨市土壤元素背景值,Cr 含量甚至高于建设用地土壤污染风险管控标准。
据报道,中国农药使用量居世界第一[34]。所施用的农药通常有80%~90%最终将通过各种方式进入土壤环境[35],而且由于历史原因,许多高毒农药如部分有机氯类农药长期存在于土壤环境中,短时间内很难完全消除[34,36]。联合国粮食及农业组织 (FAO) 调查显示,欧洲农业部门在过去50 年使用了3 000 多种不同类型的农药[37]。Toichuev等[38]发现,吉尔吉斯斯坦境内共掩埋了至少1 876 t农药,其中包括1 033 t 持久性有机农药,填埋场周围环境存在污染风险。魏雪芬等[39]在对中国甘肃省兰州市西固区土壤中有机氯类农药污染特征及风险进行评价时发现,在兰州西固区土壤中,α-六六六、β-六六六、滴滴涕等8 种有机氯类农药异构体的检出率均为100%,其中滴滴涕主要来源于农药生产企业的残留。
而在很多地区的土壤中,重金属和农药污染是同时存在的。Gulan 等[19]在科索沃首都普里什蒂纳市 (Priština City)、科索沃 (Kosovo) 和梅托希亚 (Metohija) 地区土壤中检出了几十年前已禁用的有机氯类农药和9 种重金属。Perez-Vazquez 等[20]在墨西哥圣路易斯波托西市 (San Luis Potosí) 土壤中检出了DDT 和重金属共存。陈建军等[21]研究发现,中国云南省昆明地区土壤中重金属Cd 和Hg超标率较高,土壤中残留农药则主要为六六六和DDT。黄五星等[22]研究发现,中国辽宁省烟草种植区土壤中含量较高的重金属为Cr、Ni 和Cu,但均未超过国家土壤环境质量一级标准值,农药六六六及DDT 含量也均未超标。Shen 等[23]在2005 年对中国江苏省太湖地区土壤进行环境质量评价时发现,该地区DDT、Cd 和Hg 存在复合污染风险。王铁宇等[24]研究发现,中国北京市延庆区官厅水库周边土壤重金属Cd 严重超标,高于土壤环境质量二级标准,农药残留则主要以DDT 为主,超过农药残留总量的90%。
在农田土壤当中,重金属和农药的复合污染也普遍存在。有研究显示,亚洲和欧洲大多数农田土壤每年至少使用1 次除草剂[40],给耕地带来了潜在的农药污染威胁。生态环境部和自然资源部2014 年全国土壤污染状况调查公报显示,中国耕地土壤点位超标率为19.4%,主要污染物为重金属 Cd、Ni、Cu、As、Hg、Pb 以及农药 DDT 和多环芳烃类[41]。Xu 等[42]在研究中国长江三角洲快速工业化地区——浙江省嘉兴市农田土壤重金属污染时发现,该地区存在Cu、Zn、Pb、Cr、Ni 及Cd 等污染风险,其中Hg 污染风险来源于工业排放和含Hg 农药的历史使用。樊倍希等[43]在研究火力发电厂对周边农田土壤重金属污染的影响时发现,中国山西省中部地区Cd、Cr、Cu、Hg、Mn、Ni、Pb 和Zn 的含量均超过该省土壤环境背景值,且电厂周边农田土壤中各种金属均有一定程度的累积。曹建荣等[25]在研究鲁西 (中国山东省西部) 粮食主产区耕地土壤重金属与农药污染状况时发现,污染程度较重的重金属为Cu、Ni 和Zn,农药为六六六。Aleksandra 等[37]研究发现,在波兰各采样点耕地土壤中均检测到了DDT,其主要来源于历史残留。此外,在墨西哥和美国重要农业区华雷斯山谷土壤中,有机氯类农药和重金属也均有检出[44]。
农田土壤中的重金属和农药污染还会造成二者在农产品中的残留问题。范静波[45]在调查中国山西省长治地区番茄中农药残留和重金属污染时发现,番茄样品中农药检出率为28.0%,超标率为3.7%;重金属检出率为94.0%,其中,Pb 为12.0%,Cd 为94.0%。Markovic等[26]在对塞尔维亚 (Serbia) Obrenovac 地区蔬菜产品进行检测时发现,其重金属Pb 和Cd 含量高于塞尔维亚国家法典所规定的最高水平,同时其毒死蜱和氯氰菊酯(cypermethrin) 等农药残留也存在污染风险。
2 农药与重金属复合污染的生态毒理效应
重金属和有机氯类等农药都具有持久性和生物累积性的特点,一旦进入环境后将长期存在,对环境和生物产生一定的影响。另一方面,金属又可通过催化农药的光解/水解反应,或通过影响微生物活性而影响农药的降解[46]。Rafique 等[47]研究发现,Cu2+和Fe2+会加快土壤中毒死蜱的光解速率,并且Cu2+比Fe2+对农药降解的影响更大。目前,针对农药与重金属之间是否存在协同、相加或拮抗作用,以及二者之间相互作用机制的研究还很有限,研究体系也不完善,但已有的研究表明,复合污染会在不同程度上改变单一污染物的环境行为与毒理效应。目前国内外已开展的重金属与农药复合污染暴露生态毒理学相关研究可归纳如图1 所示。
2.1 对土壤微生物的影响
土壤微生物是指生活在土壤中的细菌、真菌、放线菌、藻类、原生动物以及微小动物的总称[48]。土壤微生物在营养循环、维持土壤结构及降解农药等方面起着关键作用[49]。农药与重金属之间的协同和相加作用可能会对土壤微生物产生不利影响,如影响微生物群落,使土壤中微生物总量减少[50]等,进而改变土壤呼吸作用和酶活性,导致土壤质量下降。
2.1.1 对土壤微生物呼吸作用的影响 土壤中的呼吸作用对土壤生态系统有着重要的意义。土壤呼吸强度 (soil respiration) 是土壤对污染作出反应的一个重要指标,可用于表征土壤质量所受到的影响[51]。重金属和农药等污染物会改变土壤的呼吸作用,从而对环境造成一定影响。土壤中微生物的呼吸作用是土壤呼吸作用的主要组成部分,影响着土壤生态系统。有研究表明,重金属与农药污染都会影响土壤微生物的呼吸强度,且二者之间存在一定的相互作用。张惠文等[52]通过乙草胺 (acetochlor) 和Cu 离子单一和复合暴露12 d的试验,研究了乙草胺和Cu 离子复合暴露对土壤呼吸强度的影响,结果发现,该复合暴露对土壤呼吸强度的影响在3、6 和12 d 时表现为促进作用,在9 d 时则表现为抑制作用。Chen 等[53]的研究表明,莠去津和Pb 共同处理土壤7~14 d,与单一暴露相比,低浓度组 (莠去津2 mg/kg +Pb 300 mg/kg) 复合暴露对土壤呼吸强度有较强的激活作用,高浓度组 (莠去津10 mg/kg + Pb 600 mg/kg) 则表现为抑制作用。王金花等[54]对丁草胺和Cd 复合暴露的研究发现,在中国东北地区黑土中,丁草胺和Cd 对土壤呼吸强度的影响随着时间的延长呈现不同的变化规律:0~14 d 时表现为激活作用;14~28 d 时表现为抑制作用;28 d 后则抑制作用减轻,土壤呼吸强度逐渐恢复正常。
2.1.2 对土壤微生物酶活性的影响 土壤中的酶是土壤生化过程的重要组成部分和参与者,参与有机质分解和养分循环,还可用于判断土壤中发生的生物化学过程。王金花等[54]研究发现,与单一暴露相比,丁草胺和Cd 复合暴露对土壤脲酶活性和磷酸酯酶活性的抑制率高于单一物质暴露。程凤霞等[55]的研究也发现,土壤受到Cu 和草甘膦复合暴露时,对过氧化氢酶的影响大于单一物质暴露。因此,重金属与农药的复合污染可以改变土壤酶的活性,影响土壤的正常功能,从而直接或间接地威胁到人类本身。
综上可见,农药和重金属复合污染会对土壤微生物产生一定影响,主要表现为土壤呼吸作用和土壤酶活性的改变。农药和重金属复合污染对土壤微生物的影响不仅与污染物本身性质及其浓度有关,而且与重金属和农药之间的相互作用及受试的时间有关,与单一污染物暴露相比要复杂得多。另外,土壤中有机质的含量也会影响到污染物的生物利用性,从而影响到复合污染的毒性[56]。
2.2 对植物的影响
重金属和农药等污染物会对植物根际土壤酶活性产生影响,进而影响到植物的正常生长[57],同时还会改变土壤原有结构,使土壤发生板结等问题,直接或间接影响植物的生长[58]。此外,污染物还会随着食物链进入生态环境或人体,从而影响生态安全,甚至威胁到人体健康。
Liu 等[59]在研究草甘磷和Cu 对槐叶萍 Salvinia natans (L.) All 生长发育和抗氧化酶活性的影响时发现,低浓度的草甘膦和Cu 复合暴露对植物生长发育表现为拮抗作用,而较高浓度则呈现出协同作用。另外,该研究还发现,草甘膦和Cu 之间可以发生络合作用,这可能是低浓度下复合暴露表现出拮抗作用的原因之一,而随着浓度升高,甘草磷和Cu 之间的络合作用趋于饱和,复合暴露便呈现出协同作用。当甘草磷质量浓度 ≥ 5 mg/L,且Cu ≥ 1 mg/L 时,复合暴露可诱导植物体内过氧化氢酶水平显著升高,表明植物体内的抗氧化防御系统被激活,发生了氧化应激反应。Skiba等[60]研究发现,除草剂2,4-滴 (2,4-D) 和2 甲4 氯(MCPA) 诱导的应激反应会降低重金属在小麦组织中的迁移性,其原因可能是除草剂刺激小麦发生了强烈的氧化应激反应,抑制了小麦的新陈代谢,从而阻碍了重金属从根部向其他组织转移,最终导致小麦芽中的重金属累积量减少。同时,小麦根系会在2,4-滴和2 甲4 氯 的作用下分泌有机酸,造成根际酸化,使得周围土壤中重金属流动性增强。Jiang等[61]在评估土壤中除草剂环草隆(siduron) 和重金属的生态风险时发现,影响土壤中环草隆累积的主要因素是土壤有机质而不是土壤中的重金属;环草隆和土壤中多种重金属 (Cu、Cd、Pb、Zn) 复合暴露对黄瓜种子萌发的急性毒性试验结果表明,与环草隆单一暴露相比,复合暴露对黄瓜种子根系延伸的影响呈现显著的协同作用。在水环境中,Filimonova 等[62]研究了除草剂都阿合剂 (Primextra® Gold TZ) 和Cu 复合暴露对海洋初级生产者硅藻的影响,结果发现,二者复合暴露对硅藻生长具有明显的拮抗作用。
总之,重金属和农药对植物生长发育的影响与重金属和农药的种类及性质有关,与物质间的相互作用有关,如二者之间发生络合作用则会降低复合暴露对植物的毒性。此外,土壤有机质可以缓解重金属对植物的影响[61]。而土壤酸碱度可以改变重金属的迁移能力,土壤酸度升高,重金属迁移能力增强,从而可减少其在植物中的积累,减轻对植物的污染和损伤。
2.3 对动物的影响
无论是脊椎动物还是无脊椎动物,水生动物或陆生动物,都可能受到重金属和农药复合污染的影响。
2.3.1 对水生动物的影响 在水生生态环境中,重金属和农药污染会对水生生物构成一定的威胁,这种威胁不只出现在水体中,也会出现在沉积物中。目前,已有大量研究报道了重金属与农药复合污染对水生动物的毒性作用[63,64-66]。在个体水平上,主要体现在对水生生物死亡率和行为的影响,而在分子水平上则主要体现在对生物体内酶活性的影响,在低浓度水平下,农药和重金属离子等污染物会通过降低或增加酶的活性而对生物产生影响[67]。
2.3.1.1 对水生动物的毒性效应 斑马鱼 (zebrafish)作为模式生物常被运用于毒理学研究[68]。Ku 等[69]研究了重金属Ni 和杀虫剂噻嗪酮 (buprofezin) 对斑马鱼胚胎的毒性作用。结果表明,以24 h 胚胎死亡率作为毒性效应终点,Ni 和噻嗪酮之间呈现出明显的协同作用。导致这一结果的主要原因是Ni 和噻嗪酮之间形成了复合物,从而促进了Ni 的跨细胞膜转运,增加了受体细胞内污染物的积累,导致其毒性效应比单一污染物明显增强。Cd 和毒死蜱之间也呈现出同样的复合作用,二者可以形成Cd-毒死蜱复合物,从而促进Cd 进入人体胚胎的肝细胞发挥其毒性作用,诱导细胞内产生氧化应激反应[63]。Chen 等[70]在对Cd 和毒死蜱的相互作用进行研究时发现,Cd 和毒死蜱复合暴露处理组肝脏Hep G2 细胞中出现了二者的复合物。细胞内积累的活性氧 (ROS) 可能是Cd2+和毒死蜱复合暴露导致肝脏Hep G2 细胞死亡率增加的原因。Yang 等[64]在研究氯氰菊酯和Cd对斑马鱼早期发育的联合作用时发现,暴露在氯氰菊酯和Cd 混合物中的斑马鱼幼鱼发生痉挛的几率显著增加,而Cd 单一暴露并不会引起痉挛反应,认为痉挛的增加可能是Cd 增强了氯氰菊酯对斑马鱼的神经毒性。进一步研究发现,Cd 可抑制氯氰菊酯诱导的斑马鱼CYP 基因表达和酶活性,Cd 暴露会导致斑马鱼体内氯氰菊酯的大量积累,使复合毒性升高[64]。上述研究表明,重金属与农药对斑马鱼复合暴露时常常会形成复合物,从而有利于污染物进入受体细胞,导致其对受试生物的毒性增强。
吴慧明等[65]在农药与重金属复合暴露对大型溞 Daphnia magna 毒性的研究中发现,农药与重金属单独暴露时,Cd 的毒性最高,然后依次是三唑磷 (triazophos)、氟虫腈 (fipronil)、毒死蜱,最后是Pb 离子,而复合污染物对大型溞的毒性呈现出相加效应。Marziali 等[66]以溪流摇蚊 Chironomus riparius 幼虫为载体,采用化学、生态毒理学及生态分析三位一体的方法,分析了河流沉积物中污染物的残留,并且评估了沉积物的污染对底栖生物群落的毒性风险。结果发现,在20 年前的工业活动中,Hg、DDT 和As 进入水体,在河流沉积物中产生了富集。慢性毒性试验表明,复合污染使得摇蚊幼虫发育速度减慢,卵的数量减少,而且污染物对水生生物群落也造成了一定的影响。2.3.1.2 对水生动物酶活性的影响 酶在生物的新陈代谢中发挥着催化多种化学反应的作用[71],对生物的生长发育有着重要意义,而农药和重金属复合暴露对水生生物的抗氧化酶、AChE 和肝脏解毒酶等多种酶活性都有一定的影响。Jijie 等[72]研究发现,溴氰菊酯单一暴露可使斑马鱼超氧化物歧化酶 (SOD) 和谷胱甘肽过氧化物酶 (GPx) 的含量显著上升,而SOD 和GPx 等抗氧化酶含量与斑马鱼游泳行为的损伤直接相关;与重金属Cd、Ni 单一暴露相比,溴氰菊酯与Cd 和Ni 复合暴露后,斑马鱼抗氧化酶含量低于溴氰菊酯单独暴露处理,说明溴氰菊酯与Cd 和Ni 之间存在拮抗作用。Tilton 等[73]研究发现:随着Cu 单一暴露浓度升高,斑马鱼 AChE 活性呈升高趋势;随着毒死蜱单一暴露浓度升高,AChE活性呈下降趋势;二者复合暴露时,若Cu 的浓度不变,则随着毒死蜱浓度升高,AChE 活性呈下降趋势。Banaee 等[74]研究了乐果 (dimethoate) 和Cd 单一和复合暴露对淡水蜗牛 (截口土蜗,Galba truncatula) 亚致死生化指标的影响,发现乐果和Cd 均能引起截口土蜗的氧化应激反应,使其生化指标发生改变,复合暴露还可造成AChE 和葡萄糖-6-磷酸脱氢酶(G6PDH) 活性降低,并且乐果和Cd 复合暴露会增强各自的毒性,表明两者之间存在协同作用。Xu 等[75]在研究Pb 和百草枯 (paraquat) 复合暴露对金鱼 Carassius auratus 肝脏解毒酶的影响时发现,Pb 和百草枯复合暴露会抑制鱼肝脏内7-乙氧基-3-异吩呛哇酮-脱乙基酶 (EROD)、苄氧基-4-三氟甲基香豆素-O-脱苄氧基酶 (BFCOD)、谷胱甘肽转移酶 (GSTs) 和尿苷二磷酸葡萄糖醛酸基转移酶(UGT) 的活性,并且这种影响会随着复合暴露浓度升高和暴露时间延长而增强。
还有研究发现,重金属和农药暴露对水生动物体内酶活性的影响会随季节发生变化。Uluturhan等[76]通过研究指示土耳其爱琴海东部Homa 湖重金属和农药污染状况的生物标志物随季节的变化,发现重金属和农药污染对贻贝 (mussels) 和蛤蚌 (clams) 肝胰腺和软组织中过氧化氢酶 (CAT)、SOD、GPx 和AChE 的影响会表现出季节性和物种特异性差异。Volety[77]的研究也发现,美国佛罗里达州Caloosahatchee 河口牡蛎体内的重金属和农药含量在不同月份之间存在显著差异,但其浓度低于美国全国平均水平,对牡蛎并未产生显著的影响。
2.3.2 对陆生动物的影响 在陆生环境中,重金属和农药复合暴露对昆虫和土壤动物都产生了一定的影响。Sadowska 等[78]研究发现:在意大利博洛尼亚地区,无论是城市还是农村,蜜蜂体内都有不同程度的农药残留,但是农村地区杀虫剂的残留浓度更高,而且农村地区蜜蜂的体内还检测出了已被欧盟禁用的农药杀扑磷 (methidathion);同样,无论在城市还是农村,蜜蜂体内都检测出了重金属Cu、Zn、Mn、Pb 和Co,且其含量相似。Sgolastra 等[79]的研究发现,与Pb、Cd 和Fe 相比,Cr (Ⅲ) 对蜜蜂的急性经口毒性较低,在蜜蜂体内的残留量也较低,说明蜜蜂对Cr (Ⅲ) 的去除能力较强;同时发现,Cr (Ⅲ) 与噻虫胺(clothianidin) 和丙环唑 (propiconazole) 复合暴露并不会增加蜜蜂的死亡率,并且Cr (Ⅲ) 和丙环唑复合暴露在对蜜蜂死亡率的影响上还存在一定的拮抗作用,但两种农药复合暴露对蜜蜂死亡率的影响则呈明显的协同作用。
蚯蚓作为土壤生态系统中重要的指示生物,已被广泛用于评价土壤中污染物的生态毒性。Wang 等[80]研究了5 种杀虫剂、2 种除草剂和重金属Cd 对赤子爱胜蚓 Eisenia foetida 的影响,发现21 组复合暴露中,按照效应终点LC10、LC50及LC90计算得出联合作用类型为协同和相加作用的分别占约81%、76%和76%。该研究结果对实际环境中多种杀虫剂、除草剂和重金属相互作用的研究具有一定的指导意义。Yun 等[81]探究了重金属Cd 与多种农药复合暴露对赤子爱胜蚓的毒性效应,通过滤纸接触试验发现:Cd-莠去津和Cd-高效氯氟氰菊酯 (lambda-cyhalothrin) 复合暴露对蚯蚓的毒性都存在着不同程度的拮抗作用,但复合暴露的毒性会随着暴露时间的延长而增强;Cd-莠去津-毒死蜱和Cd-毒死蜱-阿维菌素复合暴露组则表现出了不同程度的协同作用,并且复合暴露的毒性也会随着暴露时间的延长而增强;Cd-莠去津-毒死蜱-高效氯氟氰菊酯和Cd-毒死蜱-高效氯氟氰菊酯-阿维菌素复合暴露组也呈现出不同程度的协同作用。而通过人工土壤试验发现:Cd-莠去津和Cd-高效氯氟氰菊酯复合暴露组存在协同作用;Cd-高效氯氟氰菊酯-阿维菌素复合暴露组存在拮抗作用;Cd-莠去津-毒死蜱-高效氯氟氰菊酯-阿维菌素复合暴露组则存在协同作用;且复合暴露毒性均与暴露时间呈正相关。
此外,低浓度水平农药和重金属复合暴露所引起的生态风险也值得关注。有研究表明,呋喃丹 (carbofuran) 与Cu 复合暴露下,低浓度处理组蚯蚓蛋白质含量呈上升趋势,SOD 活性呈下降趋势,AChE 活性呈上升趋势;而高浓度处理组蚯蚓的蛋白质含量和SOD 活性变化均不大,AChE 活性则呈下降趋势;同时,随着暴露时间延长,Cu 和呋喃丹之间复合作用的毒性主要以呋喃丹的毒性为主[82]。李勖之[83]研究发现,环草隆和Cd 复合暴露会抑制蚯蚓的可溶性蛋白含量,且其复合暴露在较低的浓度下可观察到明显的拮抗作用,但随着环草隆和Cd 浓度增加,该复合暴露对蚯蚓的联合毒性转变为协同作用。
综上所述,对水生动物而言,重金属和农药复合暴露似乎是通过形成复合物,促进污染物的跨膜运输,从而增强了污染物的毒性;而从分子水平角度分析,也可能是由于重金属或农药能够抑制水生动物体内酶的活性,从而增强了其中某些物质的毒性。而对于陆生动物而言,重金属和农药间的相互作用更加复杂,对酶活性的影响也存在差异——重金属与农药复合暴露对陆生动物存活率和体内酶活性的影响可能存在协同作用,也可能存在拮抗作用,并且复合暴露的毒性与时间相关。表2 总结了目前国内外已开展的重金属与农药复合暴露的生态毒理学相关研究。
3 结论与展望
总体而言,研究复合污染比研究单一污染要困难得多,这与物质本身的特性、物质与物质之间的相互作用,以及处于不同介质中的物质所受到的物理、化学和生物作用有关。目前,人们已经意识到单一污染研究的局限性,开始重视对复合污染的研究,但还需尽快完善现有的研究方法及相关毒理学指标。开展重金属和农药复合暴露的生态毒理学研究有利于探讨复合污染的机理,为减轻污染发生、阻止污染扩散提供理论基础。
现阶段,虽然有关重金属和农药复合暴露的生态毒理学研究已取得一些进展,但国内相关研究数量仍较少。在现实环境中,各种污染物通常以低浓度的方式共存,而由于低浓度水平和高浓度水平复合暴露间存在差异,因此,对农药-重金属复合污染的研究还需更多探讨低浓度水平下的联合作用。在不同的环境介质中,污染物会受到其他环境因素的影响,例如土壤环境中的农药和重金属等污染物会受到土壤中有机质的影响等,但目前大多数研究都还处于实验室阶段,在实际环境中污染物间的相互作用将更加复杂。另外,目前关于农药和重金属复合污染的研究内容也比较单一,缺乏多元化的深层次研究。因此对现有的研究方法、生物机理、生态毒理学指标等还需进行更深层次的探索和完善。因重金属-农药复合污染物的迁移性质,污染物还会在土壤-水-大气、土壤-植物-动物之间流动,并通过食物链影响生态环境和人体健康。因此,尽快建立一个完整、完善的体系,以研究整个生态系统中农药-重金属复合污染所产生的环境风险具有重要的意义。

表2 部分农药与重金属复合暴露的生态毒理学效应Table 2 Ecotoxicological effects of combined exposure of some pesticides and heavy metals
