PEG-IFNα-2a与PEG-IFNα-2b治疗慢性乙型肝炎患者疗效研究*
2021-02-04林金祥杨可立
林金祥,杨可立
慢性乙型肝炎(chronic hepatitis B,CHB)是乙型肝炎病毒(hepatitis B virus,HBV)持续感染引起的肝脏慢性疾病,是一种发病率高、范围广、严重威胁人类身体健康的传染性疾病。目前,HBV感染已经成为一个全球性的公共卫生问题[1]。临床上,主要通过抗病毒、免疫调节、抗炎护肝等方法长期抑制或消除HBV感染,但迄今治疗效果尚不尽人意。选用不同抗病毒作用机制的药物联合治疗CHB可能是较佳的策略之一,但目前尚在探索中。治疗CHB的药物主要有核苷(酸)类似物和干扰素类。前者患者耐受性好,但需长期治疗,且可能在药物的选择性压力下会引发病毒变异耐药,出现临床耐药或停药后引起病毒学反弹和肝功能异常;后者主要为聚乙二醇干扰素α(pegylated interferon-α,PEG-IFNα),通过抑制HBV复制及免疫调节双重作用起到抗HBV的效果[2],具有较高的血清学应答和较持久的病毒学应答,其作用主要是通过激活IFN基因,合成三种抗病毒蛋白,从而发挥其抑制HBV感染的作用[3]。PEG-IFNα包括PEG-IFNα-2a和PEG-IFNα-2b两类,治疗CHB患者疗效较好。本研究比较了PEG-IFNα-2a和PEG-IFNα-2b治疗CHB患者的疗效,现将结果报道如下。
1 资料与方法
1.1 一般资料 2016年7月~2018年5月我院收治的CHB患者74例,男42例,女32例;年龄32~57岁,平均年龄为(45.7±5.6)岁。符合中华医学会肝病学分会和感染病学分会联合修订的《慢性乙型肝炎防治指南(2015年)》的诊断标准[4]。纳入标准:①未发生肝硬化;②无甲型肝炎、丙型肝炎等其他肝炎病毒重叠感染、无自身免疫性肝病;③无严重的心脑血管疾病、造血系统疾病;④治疗依从性好。排除标准:①合并恶性肿瘤;②药物性肝损伤、酒精性肝炎;③妊娠或哺乳期妇女;④精神障碍、语言障碍、听力障碍。采用随机数字表法将患者分为A组和B组,每组37例。两组性别、年龄、基线病毒载量和肝功能指标等一般资料比较均无统计学差异(P>0.05),具有可比性。本研究获得本院医学伦理委员会批准,患者签署知情同意书。
1.2 治疗方法 给予A组PEG-IFNα-2a(上海罗氏制药有限公司,国药准字:S20040007)180 μg皮下注射,1次/w; 给予B组PEG-IFNα-2b(厦门特宝生物工程股份有限公司,国药准字:S20160001)180 μg皮下注射,1次/w。两组均治疗48 w,并随访24 w。
1.3 检测指标 采用实时荧光定量逆转录聚合酶链式反应法检测血清 HBV DNA水平(四川新先达测控技术有限公司);采用ELISA法检测血清HBeAg水平(上海酶联生物科技有限公司);常规检测血生化指标(上海联迈生物工程有限公司)。
1.4 统计学方法 应用SPSS 21.0软件进行统计学分析。计数资料以率(%)表示,采用x2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组疗效比较 在治疗12 w、24 w、48 w和随访24 w, 两组ALT复常率、HBV DNA转阴率和HBeAg转阴率比较,差异无统计学差异(P>0.05,表1)。

表1 两组疗效[n(%)]比较
2.2不良反应 在治疗过程中,两组不良反应发生率无显著性差异(表2)。对于治疗期间出现血细胞减少患者,给予粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF,厦门特宝生物工程股份有限公司,国药准字:S20043035)150μg皮下注射,1次/d,连续2 d或给予白介素-11注射,使血细胞计数得以恢复,维持治疗至结束。大多数患者在治疗2月后,血细胞计数保持稳定。
3 讨论
CHB是全球性的公共卫生问题。调查研究[5]发现,10%~30%CHB患者将发展为肝硬化,5%~10%将进展为原发性肝癌,每年死于CHB及其进展性疾病的患者约有60万人。近年来,各国学者均在努力探索提高CHB抗病毒疗效的最佳治疗策略和方法,CHB治疗的首要目标是消除HBV或治疗结束后能持久抑制HBV的复制。欧美肝病研究机构认为,CHB患者临床治愈的实现途径在于机体免疫功能被调动起来,患者获得持久或接近治愈的疗效是可行的目标[6]。临床研究[7]显示,CHB患者临床治愈的必要条件之一是实现HBeAg血清学转换,是停药及停药后持续应答的前提。同时,常用药物阿德福韦酯和恩替卡韦在抗病毒治疗CHB患者方面均有较好的疗效,但长时间使用会产生病毒变异耐药,导致疗效降低。因此,对于CHB 患者来说,越快实现HBeAg血清学转换将可获得更早的停药机会,减少延长疗程后耐药的风险。α-干扰素作为抗病毒治疗的主要药物,可提高宿主细胞介导的免疫功能,有助于HBV DNA清除,并实现HBeAg血清学转换,降低肝癌的发生率。因此,α-干扰素往往作为年轻初治CHB患者的首选治疗。
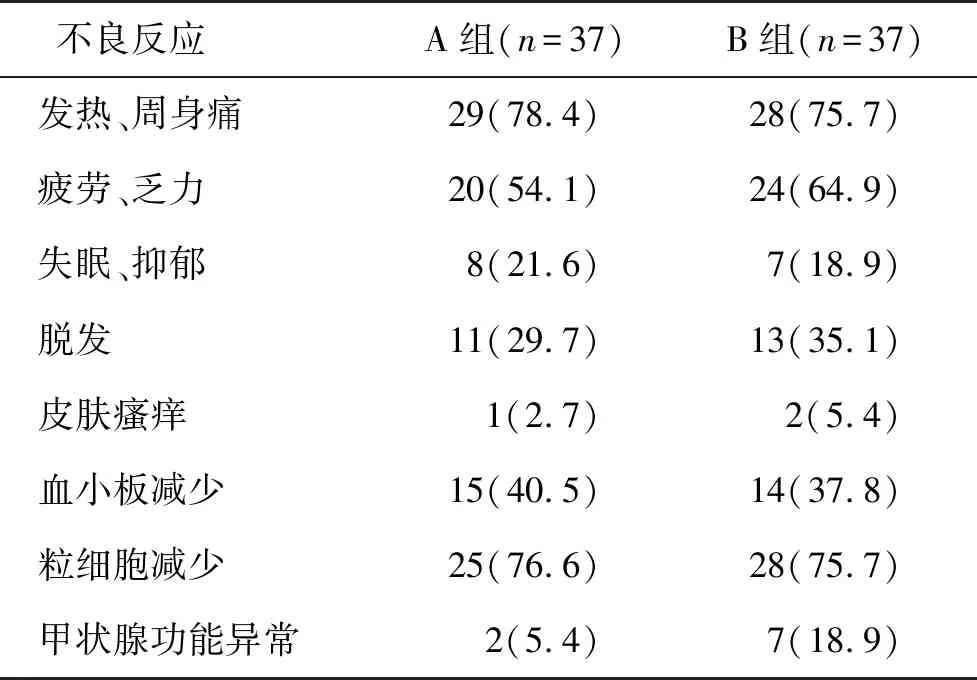
表2 两组不良反应发生率[n(%)]比较
2018年,美国肝病学会指出,为规避HBV耐药的发生,推荐PEG-IFN-α为优先选择的药物之一[8, 9]。本研究治疗后,A组和B组治疗总有效率差异无统计学意义,治疗后不同时间点,A组和B组HBeAg转阴率和HBV DNA转阴率差异无统计学意义,表明PEG-IFNα-2a和PEG-IFNα-2b在抗病毒治疗方面疗效基本相同,与有关研究结果一致[10]。PEG-IFNα-2a和PEG-IFNα-2b均是在α-干扰素的基础上结合了一定分子量的聚乙二醇分子而生成,聚乙二醇本身对人体无毒、无药理作用,可保留原α-干扰素的全部活性而延长其半衰期,使其抗病毒效应得到持续和巩固[11,12]。临床研究[13, 14]显示,皮下注射180 μg PEG-IFNα-2a或PEG-IFNα-2b,其血浆治疗浓度维持时长可达80~168 h。PEG-IFNα-2a和PEG-IFNα-2b的主要代谢器官均在肝脏,其作用效果主要表现在抑制HBV复制,增强巨噬细胞活动及增强淋巴细胞对靶细胞的细胞毒性等免疫调控作用[15]。
本研究治疗后,两组均发生较多的不良反应,主要包括免疫指标异常、流感样症状、骨髓抑制和负面情绪显著增多等几大类,但这些症状基本上在停药后就会消失。因此,治疗不会对患者机体造成较大的伤害,而对于血细胞减少的患者,给予GM-CSF皮下注射后血细胞水平往往能很快复常。研究发现,GM-CSF可通过增强氧化代谢、膜去极化及吞噬功能使得HBV患者特异抗体水平提高8~10倍[16]。此外,GM-CSF能激活单核细胞、吞噬细胞和嗜酸性粒细胞,同时促进白介素和肿瘤坏死因子等免疫调节因子的灭活,增强机体免疫调节功能[17, 18]。研究报道,HBeAg阳性CHB初治患者分别随机接受PEG-IFNα-2b或PEG-IFNα-2b联合GM-CSF治疗后,肝组织HBV共价闭合环状DNA载量下降平均值显著高于PEG-IFNα-2b单独使用组,提示GM-CSF联合长效干扰素治疗能够有效降低HBV共价闭合环状DNA载量[19]。此外,HBeAg阳性CHB患者分别接受PEG-IFNα-2b单独治疗、PEG-IFNα-2b联合阿德福韦酯治疗、PEG-IFNα-2b联合GM-CSF治疗、PEG-IFNα-2b联合阿德福韦酯和GM-CSF治疗,结果发现四组HBeAg转换率和HBsAg清除率均显著升高,但组间比较有统计学差异,结果提示联合GM-CSF可增强PEG-IFNα-2b等抗病毒药物的治疗效果[20]。
HBV持续复制以及由此引发的免疫介导反应是导致肝细胞炎性坏死和肝纤维化进展的重要因素。肝细胞炎症反应过度和纤维化均会使肝细胞遭到破坏。ALT是胞内酶,在肝脏组织受损严重时进入血液,从而引起血清转氨酶升高。因此,对于CHB患者来说,抗病毒治疗至关重要。尽管如此,单纯抗病毒治疗并不能及时、直接和充分控制肝组织内炎症反应,如血清ALT增高的问题。因此,抗炎护肝治疗也不能忽视。研究指出,基线血清ALT水平可能与PEG-IFN-α治疗CHB患者效果有关,因为血清ALT水平不同可能预示不同的免疫功能状态[21]。本研究治疗后,两组血清ALT复常率差异无统计学意义。有研究[22]发现,皮下注射PEG-IFN-α后,其会在血液中高度积聚并直接被运输到肝脏,使肝脏维持较高的血药浓度,直接提高了药物的抗病毒活性,这可能对患者具有更高效的抗病毒作用。有人[23]研究结果显示,应用PEG-IFNα-2a和PEG-IFNα-2b分别联合恩替卡韦治疗CHB患者,结果显示PEG-IFNα-2a联合恩替卡韦治疗组患者血清ALT复常率显著高于PEG-IFNα-2b联合恩替卡韦组,这与本研究结果稍有差异,其原因可能在于选择的研究对象和基础用药不同有关。
综上所述,应用PEG-IFNα-2a和PEG-IFNα-2b治疗CHB患者,在提高血清HBV DNA转阴和HBeAg转阴方面均有较好的效果,同时有利于促进血清ALT复常,两种药物均有较高的用药安全性,临床可根据患者的实际情况进行药物的选择。在治疗过程中,密切监测不良反应,及时提升白细胞水平,对完成治疗,获得良好的疗效都很重要。
