澄迈马袅湾网箱养殖区及周边海域大型底栖生物调查
2021-02-03吝思琪王爱民顾志峰石耀华刘春胜
黄 蓉, 吝思琪, 王爱民, 顾志峰, 石耀华, 刘春胜
澄迈马袅湾网箱养殖区及周边海域大型底栖生物调查
黄 蓉1, 2, 3, 吝思琪1, 2, 王爱民1, 2, 顾志峰1, 2, 石耀华1, 2, 刘春胜1, 2
(1. 海南大学 南海海洋资源利用国家重点实验室, 海口 570228; 2. 海南大学 海洋学院, 海口 570228; 3. 海南南海海岸工程与生态环境研究所, 海口 571199)
本研究分别于2019年7月(夏季)和12月(冬季)对澄迈马袅湾网箱养殖区及周边海域的大型底栖生物进行调查。结果表明, 两次调查共采集鉴定到55种生物, 其中夏季31种, 主要分布在邻近区; 冬季33种, 主要分布在养殖区和邻近区。夏季航次, 底栖生物在养殖区、邻近区和对照区的栖息密度分别为30.55 ind/m2、40.74 ind/m2和29.63 ind/m2, 生物量分别为14.36 g/m2、6.28 g/m2、6.58 g/m2; 冬季航次, 三个海区底栖生物栖息密度分别为55.56 ind/m2、46.67 ind/m2和27.78 ind/m2, 生物量分别为7.29 g/m2、6.20 g/m2和0.22 g/m2。夏季优势种主要为绒毛细足瓷蟹和纽虫; 冬季优势种主要为豆形短眼蟹、梳鳃虫、纽虫和哈氏美人虾。夏季养殖区、邻近区和对照区大型底栖生物多样性指数(′)分别为1.40、2.06和1.46; 冬季分别为2.16、1.59和0.94。综上分析, 网箱养殖产生的残饵和鱼类粪便, 对养殖区及邻近海域底栖生物分布产生一定影响, 且其群落结构与区域和季节存在较强相关性。
马袅湾; 热带海域; 网箱养殖; 底栖生物; 多样性指数
网箱养殖是我国沿海地区海水养殖的主要模式之一。然而, 随着网箱养殖规模的增加和养殖密度的提高, 养殖过程中产生的残饵、粪便等进入到周边海水和沉积物中, 给海洋生态系统带来各种负面影响[1-2]。
大型底栖生物是生活在水底部的生物群落, 其对所在环境的水质和沉积物质量非常敏感[3]。底栖动物生活区域性强, 常固着于海底或短距离移动, 回避环境恶化的能力较弱, 且不同种类对环境胁迫承受能力具有差异性[3-4]。当水体受到污染时, 大型底栖生物群落结构及多样性将会发生改变, 因而其种群数量变化对环境污染的指示作用具有综合性和持续性[5-7]。近年来, 网箱养殖活动引起的大型底栖生物群落特征变化受到越来越多的关注。现有报道表明网箱下方及其邻近水域因有机物质分解形成低氧区, 导致底栖动物数量显著减少; 小头虫科、吻沙蚕科、海稚虫科等多毛类生物和一些小型双壳类极易成为底栖生物群落中的优势种[8-9]。因此, 大型底栖动物群落结构已成为反映海洋底质环境变化的重要指标[10-11]。
近年来, 海水鱼类网箱养殖对大型底栖生物群落影响的研究被大量报道, 但有关热带海域网箱养殖环境相关性研究较少[12-15]。本研究于2019年7月和12月对澄迈马袅湾海域网箱养殖区及周边海域大型底栖生物开展调查, 分析海水网箱养殖对大型底栖生物群落的影响, 以期为我国海水网箱养殖的可持续发展提供数据支撑。
1 材料与方法
1.1 调查时间和站位
本研究在澄迈马袅湾网箱养殖区及周边海域共布设28个大型底栖生物调查站位(图1), 其中养殖区设置6个调查站位(P1~P6), 在距离养殖区约1 km以内的邻近区布设12个调查站位(Z1~Z6, A1~A6), 在距离养殖区约2~3 km的对照区布设10个调查站位(B1~B5, C1~C5)。分别于2019年7月(夏季)和12月(冬季)进行采样分析。

图1 调查站位图
1.2 调查和评价方法
1.2.1 采样方法
底栖生物采样按照《海洋调查规范》[16]和《海洋监测规范》[17], 采用张口面积为0.045 m2的采泥器进行, 每个站采样2次。采集样品采用75%乙醇固定带回实验室, 进行称重、种类鉴定、计数、统计和分析。
1.2.2 评价方法
本文底栖生物群落结构分析使用PRIMER6.0软件完成; 优势度()、多样性指数()、均匀度()、丰富度()和单纯度()[7]采用Excel软件计算, 计算公式如下:

Pielou均匀度指数():=max
丰富度指数():= (–1)log2
单纯度指数():SUM(n/)2
式中:n: 为第个物种的栖息密度;f: 某种生物的出现频率(%);: 某站总生物栖息密度(ind/m2);: 出现生物总种数;P=n/;max=log2, 为最大多样性指数。
2 结果
2.1 种类组成
2次调查共采集鉴定到55种底栖生物(表1)。夏季有7个类别31种, 最多为软体动物(11种), 各区域种类数量邻近区(18种)>养殖区(9种)>对照区(6种); 冬季有8个类别33种, 最多为环节动物(14种), 各区域种类数量邻近区(20种)>养殖区(19种)>对照区(5种)。
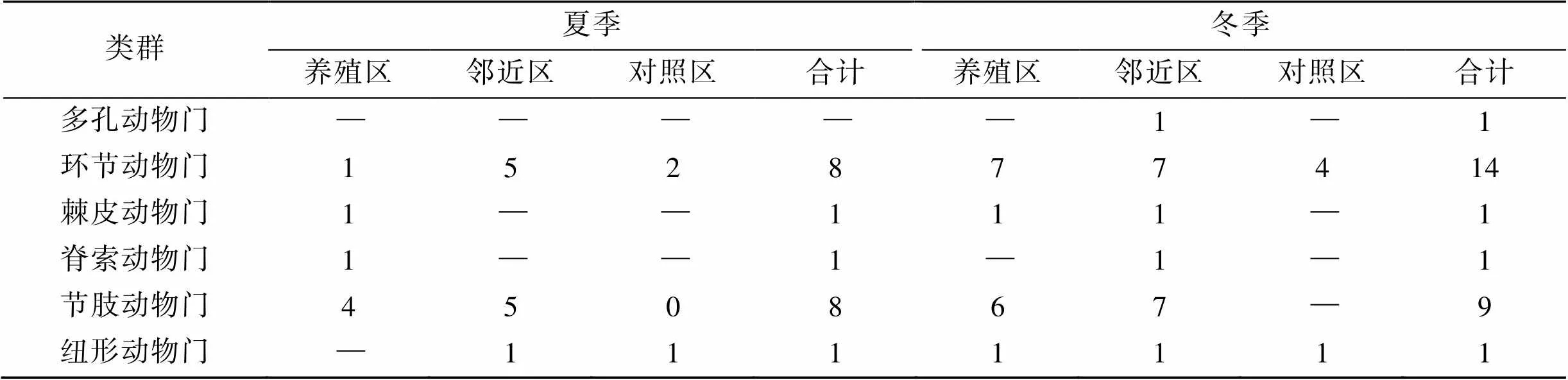
表1 各类群底栖生物种类组成

续表
注: —是指未采集到生物。
2.2 生物量和栖息密度
夏季航次, 共14个站位采集到底栖生物, 其中养殖区4个站位, 平均栖息密度为30.55 ind/m2, 平均生物量为14.36 g/m2; 邻近区7个站位, 平均栖息密度为40.74 ind/m2, 平均生物量为6.28 g/m2; 对照区3个站位, 平均栖息密度为29.63 ind/m2, 平均生物量为6.58 g/m2(图2a、图2b)。
冬季航次, 共22个站位采集到底栖生物, 其中养殖区6个站位, 平均栖息密度为55.56 ind/m2, 平均生物量为7.29 g/m2; 邻近区11个站位, 平均栖息密度为46.67 ind/m2, 平均生物量为6.20 g/m2; 对照区5个站位, 平均栖息密度为27.78 ind/m2, 平均生物量为0.22 g/m2(图2c、图2d)。
夏季航次, 邻近区的生物栖息密度最高, 生物量则是养殖区最高; 冬季航次, 养殖区的栖息密度和生物量均为最高。
按照生物类别计算, 夏季养殖区的栖息密度(图3a)为: 节肢动物(66.67 ind/m2)>脊索动物、软体动物(22.22 ind/m2)>环节动物(11.11 ind/m2); 邻近区的栖息密度为: 软体动物(88.89 ind/m2)>环节动物(77.78 ind/m2)>节肢动物(66.67 ind/m2); 对照区的栖息密度为: 软体动物(33.33 ind/m2)>环节动物、纽形动物(22.22 ind/m2)>螠虫动物(11.11 ind/m2)。冬季养殖区的栖息密度为: 节肢动物(133.33 ind/m2)>环节动物(88.89 ind/m2)>软体动物(77.78 ind/m2); 邻近区的栖息密度为: 节肢动物(233.33 ind/m2)>环节动物(111.11 ind/m2)>纽形动物(77.78 ind/m2); 对照区的栖息密度为: 环节动物(88.89 ind/m2)>纽形动物(22.22 ind/m2)。

图2 大型底栖生物栖息密度和生物量的平面分布图
注: a: 夏季栖息密度; b: 夏季生物量; c: 冬季栖息密度; d: 冬季生物量。

图3 各类型生物栖息密度和生物量的对比图
注: a: 各类别栖息密度; b: 各类别生物量。
夏季养殖区的生物量(图3b)为: 软体动物(38.13 g/m2)>节肢动物(15.40 g/m2)>环节动物(2.17g/m2);邻近区的生物量为: 软体动物(20.15 g/m2)>节肢动物(15.03 g/m2)>环节动物(5.47 g/m2); 对照区的生物量为: 软体动物(13.27 g/m2)>纽形动物(4.98 g/m2)>环节动物(1.22 g/m2)。冬季养殖区的生物量为: 节肢动物(18.22 g/m2)>软体动物(12.55 g/m2)>环节动物(11.75 g/m2); 邻近区的生物量为: 节肢动物(32.77 g/m2)>脊索动物(8.78 g/m2)>棘皮动物(6.24 g/m2); 对照区的生物量为: 环节动物(0.88 g/m2)>纽形动物(0.21 g/m2)。
调查海域的生物量和栖息密度主要以节肢动物、环节动物和软体动物为主。夏季养殖区和邻近区的生物量以软体动物为主, 栖息密度以节肢动物为主; 对照区生物量和栖息密度均以软体动物为主。冬季养殖区、邻近区生物量和栖息密度均以节肢动物为主, 对照区均以环节动物为主。
2.3 优势种
如表2所示, 夏季优势种分别为绒毛细足瓷蟹()、纽虫(sp.); 冬季优势种分别为豆形短眼蟹()、梳鳃虫()、纽虫、哈氏美人虾()。冬季优势种类比夏季多2种, 纽虫为2次调查中出现的优势种。
2.4 生物多样性分析
两次调查大型底栖生物各指数如表3所示。与冬季相比, 夏季养殖区大型底栖生物多样性指数和丰富度较低, 单纯度和均匀度指数较高。夏季邻近区大型底栖生物多样性指数和丰富度高于养殖区和对照区, 各区域间均匀度指数相差不大。冬季养殖区、邻近区和对照区生物多样性指数和丰富度呈递减趋势, 各区域间均匀度指数亦相差不大。

表2 大型底栖生物栖息密度优势种、优势度(优势度≥0.01)

表3 不同季节底栖生物指数
注:指丰富度指数;指单纯度指数;指Shannon-Wiener多样性指数;指Pielou均匀度指数。
对底栖生物丰度进行聚类(Cluster)分析, 调查海域底栖生物群落异质化程度夏季较秋季高(图4)。在20%的相似度上, 夏季调查可将底栖生物群落分为10个组, 其中相似度>20%的有3组, 分别为组1包括Z1和A2号站(豆形短眼蟹); 组2包括P1和P5(绒毛细足瓷蟹、红狼牙鰕虎鱼); 组3包括B5、A5和B2(纽虫)。冬季调查可分为11个组, 其中相似度>20%的有5组, 分别为组1包括P5和A5(焦芋螺); 组2包括C2、C3和C4(梳鳃虫); 组3包括Z6、P2、Z1和B2(纽虫); 组4包括P1、A2、Z2和Z3(哈氏美人虾); 组5包括P3、P4和P6(豆形短眼蟹)。

图4 大型底栖生物丰度聚类图
注: a: 夏季底栖生物丰度聚类图; b: 冬季底栖生物丰度聚类图。
3 讨论
本研究中两次调查共采集鉴定到55种大型底栖生物, 其中夏季31种, 冬季33种, 生物多样性指数为0.94~2.16, 均匀度指数为0.94~0.99, 丰富度指数为0.21~0.78。对比樊立静等[18]对福建北部近岸海域大型底栖生物群落特征的研究(2013年8月调查20个站位, 共采集到69种生物, 多样性指数2.59, 均匀度指数为0.90, 丰富度指数为1.11)和丁敬坤等[19]对胶州湾底栖生态系统的研究(2017年7月调查20个站位, 共采集到64种, 多样性指数为2.35, 均匀度指数为0.81, 丰富度指数为1.56), 马袅湾大型底栖生物多样性指数和丰富度指数较低, 但均匀度指数相对较高, 说明该海域大型底栖生物种类较少, 但种间分布相对均匀。
南海热带海域为寡营养盐[20-21], 其营养盐的增加使生物群落组成在一定程度上发生改变。研究表明适当的有机物质增加对底栖群落有利, 可使其生物量增加, 群落多样性上升。当有机物过度积累, 大量的有机颗粒无法分解, 导致沉积环境处于无氧环境, 影响底栖动物的生存, 耐污种类占据主要优势地位, 生物多样性下降[22-23]。本研究中, 养殖区生物种类数、栖息密度和生物量以及对照区的生物量变化较大, 邻近区底栖生物变化较小。夏季为养殖高峰期, 大量残饵和鱼类代谢物的排放使养殖区有机物沉积, 环境恶化[24]。此时养殖区的底栖生物种类较少, 栖息密度较低, 但能适应环境的生物获得大量有机物, 使得养殖区生物量大大提高。冬季为休养期, 养殖区底质污染情况得以缓解, 大型底栖生物群落有所恢复, 所以冬季养殖区种类数量较多, 且栖息密度较高。邻近区距离网箱养殖较近, 养殖产生的残饵和鱼类代谢物可随海流扩散到邻近区, 但不会造成有机物过度富集。邻近区的底栖生物可以获得充足的营养物质, 同时底质环境又比较稳定, 因此, 邻近区底栖生物种类、密度及生物量均不会产生较大变化。对照区与养殖区距离较远, 养殖产生的残饵和鱼类代谢物基本不会扩散到该海域, 该海域底栖生物主要依靠摄食底质中的有机物和藻类生存。冬季海域初级生产力较低, 底栖生物能获取的食物大量减少, 导致其生物量大量减少。
通常, 受养殖活动影响的特征之一是底栖动物优势种单一, 即优势度高[25]; 而物种优势度越高, 说明群落内物种的生态地位越不平衡, 生物群落越不稳定[26]。本研究中, 夏季共有2种优势种, 冬季有4中优势种。说明夏季受养殖影响较大, 底栖生物群落不稳定。养殖过程产生的有机质为大型底栖动物生长提供了营养来源, 利于其生长, 但累积的有机物在降解过程中往往会消耗大量的氧气, 产生硫化氢等有害物质, 从而降低底栖群落的多样性[27-29]。本研究中, 养殖区多样性指数夏季低而冬季高, 而邻近区和对照区则是夏季高而冬季低, 这与杨俊毅等[24]在乐清湾大型底栖生物群落特征研究的结果一致, 说明养殖区受养殖污染影响显著高于邻近区和对照区。
4 结论
澄迈马袅湾网箱养殖已对海洋环境造成一定影响, 1) 网箱养殖区及邻近海域大型底栖生物栖息密度、生物量和多样性指数显著增加。2) 与网箱养殖期(夏季)相比, 休养期(冬季)养殖区和邻近区大型底栖生物栖息密度显著增加, 对照区海域变化不大; 而养殖区和对照区大型底栖生物生物量显著降低, 邻近区无显著变化。
[1] 何悦强, 郑庆华, 温伟英, 等. 大亚湾海水网箱养殖与海洋环境相互影响研究[J]. 热带海洋, 1996, 15(2): 22-27.He Yueqiang, Zheng Qinghua, Wen Weiying, et al. A study on seawater environment affected by cage mariculture in DaYa Bay[J]. Tropic Oceanology, 1996, 15(2): 22-27.
[2] 林后祥. 海水养殖与海区水环境的关系[J]. 河北渔业, 2011, (8): 57-58.Lin Houxiang, Relationship between mariculture and marine environment[J]. Hebei Fisheries, 2011, (8): 57-58.
[3] Putro S P, Widowati, Suhartana. Assessment level of severity of environmental disturbance caused by aquaculture activities using abundance-biomass curves of macrobenthic assemblages[J]. International Journal of Environmental Science and Development, 2015, 6(3): 178-181.
[4] Leopardas V, Honda K, Go G A. Variation in macrofaunal communities of sea grass beds along a pollution gradient in bolinao, northwestern philippines[J]. Marine Pollution Bulletin, 2016, 105(1): 310-318.
[5] Ishimatsu S, Komorita T, Orita R, et al. Differences in the damage caused by hypoxia to the macrobenthic communities in source regions of hypoxic water and in regions with advected hypoxic water[J]. Journal of Oceanography, 2018, 74: 607-617.
[6] Tomašových A, Gallmetzer I, Haselmair A, et al. Tracing the effects of eutrophication on molluscan communities in sediment cores: outbreaks of an opportunistic species coincide with reduced bioturbation and high frequency of hypoxia in the Adriatic Sea[J]. Paleobiology, 2018, 44(4): 575-602.
[7] 杨艳云. 桑沟湾规模化养殖对底质环境的影响评价[D]. 辽宁大连: 大连海洋大学, 2018. Yang Yanyun. Assessment of the influence of large- scale aquaculture on benthic environment in Sangou Bay[D]. Dalian, Liaoning Province: College of Fisheries and Life Science, Dalian Ocean University, 2018.
[8] Gao Q F, Cheung K L, Cheung S G, et al. Effects of nutrient enrichment derived from fish farming activities on macroinvertebrate assemblages in a subtropical region of Hong Kong[J]. Marine Pollution Bulletin, 2005, 51: 994-1002.
[9] Martinez G E, Sanchez J P, Aguado G F, et al. A meta-analysis approach to the effects of fish farming on soft bottom polychaeta assemblages in temperate regions[J]. Marine Pollution Bulletin, 2013, 69: 165-171.
[10] Mazzola A, Mirto S, Rosa T L, et al. Fish-farming effects on benthic community structure in coastal sediments: analysis of meiofaunal recovery[J]. Ices Journal of Marine Science, 2000, 57(5): 1454-1461.
[11] Sanzlázaro C, Marín A. Diversity patterns of benthic macrofauna caused by marine fish farming[J]. Diversity, 2011, 3(2): 176-199.
[12] 黄洪辉, 林钦, 林燕棠, 等. 大亚湾网箱养殖海域大型底栖动物的时空变化[J]. 中国环境科学, 2005, 25(4): 412-416. Huang Honghui, Lin Qin, Lin Yantang, et al. Spatial- temporal variation of large macrobenthicanimals in cage culture sea area in Daya Bay[J]. China Environmental Science, 2005, 25(4): 412-416.
[13] 许巧情, 过龙根, 刘绍平. 网箱养殖对底栖动物丰度和生物量的影响[J]. 长江大学学报(自然科学版), 2009, 6(3): 35-38. Xu Qiaoqing, Guo Longgen, Liu Shaoping. Effect of cage culture on zoobenthic abundance and biomass[J]. Journal of Yangtze University(Nat Sci Edit), 2009, 6(3): 35-38.
[14] 唐盟, 周进. 福建三沙湾网箱养殖对多毛纲动物群落结构的影响[J]. 海洋与湖沼, 2017, 48(3): 543-552.Tang Meng, Zhou Jin. Impacts of cage farming on Polychaete community in Sansha Bay, Fujian Province[J]. Oceanologia et Limnologia Sinica, 2017, 48(3): 543-552.
[15] 丁敬坤, 薛素艳, 李加琦, 等. 基于大型底栖动物的桑沟湾不同养殖区底栖生境健康评价[J]. 中国水产科学, 2020, doi: 10.3724/SP.J.1118.2020.20090.Ding Jingkun, Xue Suyan, Li Jiaqi, et al. Health assessment of the large-scale aquaculture on benthic habitat in Sanggou Bay[J]. Journal of Fishery Sciences of China, 2020, doi: 10.3724/SP.J.1118.2020.20090.
[16] 中华人民共和国国家质量监督检验检疫总局, 海洋调查规范第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2007, 1-157. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China. The specification for oceanographic survey Part 6: Marine bioligical survey[S]. Beijing: China Standards Press, 2007, 1-157.
[17] 中华人民共和国国家质量监督检验检疫总局, 海洋监测规范第7部分: 近海污染生物调查和生物监测[S]. 北京: 中国标准出版社, 2007, 1-103.General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China. The specification for marine monitoring Part 7: Biological survey and biological monitoring of offshore pollution[S]. Beijing: China Standards Press, 2007, 1-103.
[18] 樊立静, 夏永健, 李益云, 等. 夏季福建北部近岸海域大型底栖生物群落特征[J]. 海洋开发与管理, 2017, 34(2): 85-91.Fan Lijing, Xia Yongjian, Li Yiyun, et al. Characteristics of macrobenthic community in the Coastal area of Northern Fujian Province in Summer 2013[J].Ocean Development and Management, 2017, 34(2): 85-91, 100.
[19] 丁敬坤, 张雯雯, 李阳, 等. 胶州湾底栖生态系统健康评价–基于大型底栖动物生态学特征[J]. 渔业科学进展, 2020, 41(2): 20-26. Ding Jingkun, Zhang Wenwen, Li Yang, et al. Health assessment of the benthic ecosystem in Jiaozhou Bay: Ecological characteristics of the macrobenthos[J]. Progress in Fishery Sciences, 2020, 41(2): 20-26.
[20] 袁梁英. 南海北部营养盐结构特征[D]. 福建厦门: 厦门大学, 2005. Yuan Liangying. Distribution and characteristics of nutrients in the Northern South China Sea[D]. Xiamen, Fujian Province: Xiamen University, 2005.
[21] Liu K K, Chao S Y, Shaw P T, et al. Monsoon-forced chlorophyll distribution and primary production in the South China Sea: observations and a numerical study[J]. Deep-Sea Research, 2002, 49: 1387-1412.
[22] Pearson T H, Rosenberg R. Macrobenthic succession in relation to organic enrichment and pollution of the marine environment[J]. Oceanography and Marine Biology, 1978, 16: 229-311.
[23] Tartari M, Turnbull P, Trinkl B, et al. The environmental impact of marine fish cage culture[J]. Grass & Forage Science, 2001, 58(2): 1-31.
[24] 杨俊毅, 高爱根, 宁修仁, 等. 乐清湾大型底栖生物群落特征及其对水产养殖的响应[J]. 生态学报, 2007, 27(1): 34-41.Yang Junyi, Gao Aigen, Ning Xiuren, et al. Characteristics on macrofauna and the responses on aquiculture in Yueqing Bay[J]. Acta Ecologica Sinica, 2007, 27(1): 34-41.
[25] Kutti T, Hansen P K, Ervik A. Effects of organic effluents from a salmon farm on a fjord system. II. Temporal and spatial patterns in fauna community composition[J]. Aquaculture, 2007, 262(2-4): 355-366.
[26] 刘录三, 孟伟, 郑丙辉, 等. 辽东湾北部海域大型底栖动物研究: Ⅰ. 种类组成与数量分布[J]. 环境科学研究, 2008, 21(6): 118-123.Liu Lusan, Meng Wei, Zheng Binghui, et al. Studies on macrobenthos in the northern waters of Liaodong Bay: Ⅰ. species composition and number distribution[J]. Research of Environmental Sciences, 2008, 21(6): 118-123.
[27] 高爱根, 杨俊毅, 陈全震, 等. 象山港养殖区与非养殖区大型底栖生物生态比较研究[J]. 水产学报, 2003, 27(1): 25-31. Gao Aigen, Yang Junyi, Chen Quanzhen, et al. Comparative studies on macrobenthos between cultured and non-cultured areas in Xiangshan Bay[J]. Journal of fisheries of China, 2003, 27(1): 25-31.
[28] 高爱根, 陈全震, 胡锡钢, 等. 象山港网箱养鱼区大型底栖生物生态特征[J]. 海洋学报, 2005, 27(4): 108-113. Gao Aigen, Chen Quanzhen, Hu Xigang, et al. Ecological characteristics on macrobenthos of net-cage culture areas in the Xiangshan Bay[J]. Haiyang Xuebao, 2005, 27(4): 108-113.
[29] 纪炜炜, 周进. 三都澳大型底栖动物群落结构及其对水产养殖的响应[J]. 中国水产科学, 2012, 19(3): 491- 499. Ji Weiwei, Zhou Jin. Community structure of macrobenthos in response to mariculture practices in Sandu Bay[J]. Journal of Fishery Sciences of China, 2012, 19(3): 491-499.
Investigation of macrobenthos of cage culture and the adjacent sea area in Maniao Bay, Chengmai
HUANG Rong1, 2, 3, LIN Si-qi1, 2, WANG Ai-min1, 2, GU Zhi-feng1, 2, SHI Yao-hua1, 2, LIU Chun-sheng1, 2
(1. Key Laboratory of Tropical Biological Resources of Ministry of Education, Hainan University, Haikou 570228, China; 2. Ocean College, Hainan University, Haikou 570228, China; 3. Hainan South China Sea Institute of Coastal Engineering and Ecological Environment, Haikou 571199, China)
The macrobenthos in a cage fish culture (CF) and in the adjacent (AD) and control (C) sea areas of Maniao Bay, Chengmai were investigated in July (summer) and December (winter) 2019. According to two surveys, 55 species were identified with 30 species in summer, primarily in the AD area, and 33 species in winter, primarily in the CF and AD areas. The habitat density of the CF, AD, and C sea areas in summer were 30.55, 40.74, and 29.63 ind/m2, respectively; their biomasses were 14.36, 6.28, and 6.58 g/m2, respectively. In winter, the habitat density of the CF, AD, and C sea areas were 55.56, 46.67, and 27.78 ind/m2, respectively; their biomasses were 7.29, 6.20, and 0.22 g/m2, respectively. The dominant species wereandsp. in summer and,,sp., andin winter. Moreover, the macrobenthic biodiversity index () of the CF, AD, and C sea areas in summer were 1.40, 2.06, and 1.46, respectively. The indices were of the CF, AD, and C sea areas in winter were 2.16, 1.59, and 0.94, respectively. In conclusion, the sediment of bait and fish metabolites produced through the cage fish culture influenced the distribution of the macrobenthos, and strong correlations were observed between community structure and region and season.
Maniao Bay; Tropical sea area; Cage culture; Macrobenthos; Biodiversity index
Jul. 13, 2020
X835
A
1000-3096(2021)01-0092-08
10.11759/hykx20200713004
2020-07-13;
2020-09-01
国家重点研发计划项目(2018YFD0900704), 院士团队创新中心项目(HD-YSZX-202011)
[Supported by the National Key Research and Development Program of China, No. 2018YFD0900704, Talent Development Program of Hainan Province, No. HD-YSZX-202011]
黄蓉(1992-), 女, 硕士研究生, 主要从事海洋环境研究, E-mail: 243533241@qq.com; 刘春胜, 男,通信作者, 副教授, 主要从事贝类繁育和养殖技术研究, E-mail: lcs5113@163.com
(本文编辑: 赵卫红)
