大豆细胞核雄性不育基因研究进展
2021-02-02孙小媛王一帆王韫慧蔺佳雨李金红丘远涛方小龙孔凡江李美娜
孙小媛,王一帆,王韫慧,蔺佳雨,李金红,丘远涛,方小龙,孔凡江,李美娜
大豆细胞核雄性不育基因研究进展
孙小媛,王一帆,王韫慧,蔺佳雨,李金红,丘远涛,方小龙,孔凡江,李美娜
广州大学生命科学学院,广州 510006
雄性不育是指植物雄蕊不能正常生长和产生有活力花粉粒的现象。利用雄性不育突变体开展杂交育种工作,是快速提高作物单产的有效途径。目前,通过杂种制种已大幅度提高了水稻(L.)、玉米(L.)和小麦(L.)等作物的产量。大豆((L.) Merr.)作为自花授粉作物,通过人工去雄生产杂交种子不仅困难而且经济上不可行。由于适用于杂交种生产的不育系资源短缺,目前大豆还没有实现大规模杂种优势利用。因此,快速实现大豆杂种优势利用迫切需要鉴定稳定的大豆雄性不育系统。本文总结了大豆细胞核雄性不育(genic male sterility, GMS)突变体及不育基因研究进展,同时结合拟南芥()、水稻和玉米中已报道的细胞核雄性不育基因,从反向遗传学的角度,为大豆核雄性不育基因的鉴定提供依据。
大豆;细胞核雄性不育;反向遗传学
大豆((L.) Merr.)原产于中国,是重要的粮食作物和饲用原料。但我国大豆耕种面积逐年缩减、产量增长缓慢,单产水平远远低于世界平均水平,无法满足人们对大豆不断增长的需求。因此,近年来我国大豆超过85%依赖进口,2019年全国大豆进口量达到8851万吨,进口国家主要为巴西和美国。因此,快速提高大豆产量已成为目前我国大豆生产中最迫切的任务。
杂种优势利用是大幅度提高作物单产的有效途径。利用杂种优势,水稻增产55%,小麦增产25%,大麦(L.)增产11%,谷子()增产68%[1,2]。因杂交植物具有较好的适应性、较强的抗逆性,因此对提高农业产量做出了巨大贡献。大豆是目前少数几个没有大规模利用杂种优势的作物之一,其主要原因是适于杂交种生产的不育系资源短缺。
杂交种子的产生需要具有遗传多样性的亲本异花授粉,因此利用雄性不育和雌性可育的突变体是进行异花授粉、实现大规模杂交制种的前提。大豆是典型的自花授粉作物,通过人工去雄生产杂交种子不仅困难而且经济上不可行。因此,快速实现大豆杂种优势利用迫切需要在大豆中鉴定稳定的雄性不育系统[3]。
研究发现,雄性不育由细胞核基因或线粒体基因控制,前者被称为细胞核雄性不育(nuclear male sterility, NMS或genic male sterility, GMS),后者被称为细胞质雄性不育(cytoplasmic male, CMS)[4,5]。杂交育种技术中的三系法利用CMS系为母本,以保持系为父本繁殖大量保持不育特性的种子;以CMS系为母本,以恢复系为父本,实现大规模生产可育的杂交种子。但三系法也存在缺陷,如恢复系的种质资源狭窄、CMS系与恢复系的遗传多样性差,限制了CMS系的进一步发展[6~9]。两系法利用光温敏GMS系,如籼稻安农S-1[10],当处于低温环境时可育,而在高温环境育性转变为不育,以常规品种作为恢复系,同时改变光温条件,可实现不育系繁殖和杂交种生产。但随着研究的深入,两系法的问题也日益突出,不育系的育性受光照和温度的影响,随着繁殖代数的增加,育性转变的临界温度发生改变,大大增加了繁殖不育系的难度[6~9]。随着现代生物技术的发展,研究人员通过分子生物技术和基因工程手段,在水稻中通过利用核不育基因、花粉自我降解基因、红色荧光蛋白筛选标记基因等,获得转基因保持系,利用该保持系繁殖大量非转基因的雄性不育种子可用于商业生产[11]。因此在大豆中利用核不育基因并以此构建雄性不育系统是快速实现大豆杂种优势利用的重要途径。
虽然大豆核雄性不育突变体的发现至今已经有90多年的历史,但是目前仅有基因被克隆,其他核不育基因尚未见报道[12]。对大豆核不育基因相关研究进展进行系统总结有助于深入认识和了解大豆核不育系统,鉴定并挖掘新的雄性不育基因也有助于开发稳定的可用于大豆杂交种子生产的不育系统。本文对大豆核雄性不育基因的相关研究进行了综述,并通过比较拟南芥、水稻和玉米等模式植物中已报道的雄性不育基因,以期为大豆核雄性不育基因的鉴定和研究提供参考。
1 大豆细胞核雄性不育突变体研究进展
1.1 大豆细胞核雄性不育突变体
细胞核雄性不育,其雄性育性大多由细胞核内一对隐性基因控制,少数受显性基因调控,符合孟德尔遗传定律。目前已鉴定出28个大豆细胞核雄性不育突变体,包括雄性和雌性配子都可育的结构型不育、部分雄性不育、雄性和雌性均不育、雄性不育和雌性可育、光敏雄性不育和由单一显性基因控制的雄性不育(表1)。
是迄今为止在大豆中报道的唯一自然产生的结构型不育突变体,其花粉育性正常,但胚珠发育异常,受双隐性基因和共同调控。通常带有外露的花柱和柱头,花瓣发育异常,阻止花丝的伸长,导致花药与柱头之间距离较远,阻止自花授粉,因此结实率较低[13]。是温度敏感型雄性不育,高温环境下雄性生殖力较强[14],其突变体的花药外观各不相同,有的花药为棕色,较小;花药通常开裂,退化的小孢子或花粉凝集成块[15]。和()属雄性和雌性都不育的突变体,其中是染色体联会缺失的突变体,而和是染色体联会异常的突变体,这类不育系的花粉和胚珠都败育[16~20]。

表1 大豆核雄性不育突变体及基因信息
1971年,Brim和Young在大豆中发现了控制雄性不育性状的突变体[21]。迄今为止,已经发现雄性不育雌性可育的突变体包括、、、、、、、、和。突变体在第二次减数分裂末期细胞质分裂失败,结果产生多核小孢子,最终形成的花粉粒粘附在一起,不能萌发[22]。和均能进行正常的减数分裂,形成四分体,但由于绒毡层发育异常,小孢子随后退化,最终花药中没有产生花粉粒[23,24]。与相似,都是第二次减数分裂末期后不发生胞质分裂引起的败育,但花药略小且偏白色,形成中空小孢子[25]。突变体在花粉发育过程中绒毡层空泡化,小孢子解体,花粉增大[26]。突变体小孢子母细胞在第二次减数分裂末期后退化,药室内壁和绒毡层等发育呈现异常,并且花朵相比其他突变体较小[27]。小孢子的败育主要由于四分体时期胼胝质不解体,结果没有产生花粉粒。育性受环境温度的影响,和相似,结果都产生大量的退化花粉粒,但花粉没有萌发沟[14,28,29]。而小孢子母细胞在第一次减数分裂的早前期开始发生败育,染色体联会异常,结果产生异常的多分体(polyad),其雄性育性受隐性基因调控[30]。
光敏雄性不育系在短日照条件下,小孢子发育减数分裂过程中染色体行为异常,最终形成异常花粉粒,导致雄性不育[31]。是目前在大豆中报道的唯一由显性基因调控的雄性不育、雌性可育突变体,该突变体的小孢子四分体表现正常,而成熟花粉粒细胞质分布不均,发生皱缩使花粉完全败育[32]。
以上不育系由于花器官结构异常或大量可育株的存在等问题,很难应用于杂交种生产。目前在优势大豆选育工作中较多使用核不育突变体材料[33]。
1.2 大豆细胞核雄性不育基因定位与克隆
大多数核不育基因(以下简称GMS基因)已被初步定位到大豆染色体上。控制大豆雄性和雌性均不育的GMS突变体中,基因位于11号染色体BARCSOYSSR_11_122-BARCSOYSSR_11_137标记之间,物理距离为~398 kb,包含57个预测基因[34]。基因位于1号染色体Satt436-Satt468标记之间,物理距离约为164 kb,包含17个预测基因,该区域中的基因编码具有RWP-RK结构域(RKD)的转录因子,已知RKD转录因子在雄配子发生、卵细胞功能控制和细胞分裂中发挥重要作用[35],因此该基因可能是的候选基因。位于13号染色体Satt146-Satt030之间[34],在14号染色体BARCSOYSSR_14_84-BARCSOYSSR_14_109标记之间,在2号染色体Satg001和端粒之间[34]。位于16号染色体分子连锁群J上的SSR标记Satt132-Satt414之间,与两个标记的距离分别为7.8 cM和3.4 cM[36]。
在大豆中报道的控制雄性不育雌性可育突变体的候选基因(、、、、、、、、、、和ms)分别定位到大豆的7条不同染色体上[37~39]。其中,和基因定位于13号染色体[38]。基因位于10号染色体Sat_190-Scaa001标记之间,与两个标记距离分别为6.9和9.0 cM[37]。、、和均定位在2号染色体上[15,38,40]。、、和基因分别接近Satt516、Satt157、Satt542 BARCSOYSSR_ 02_1539和AW186493标记[38,40]。、、和分别位于11、9、7、3号染色体上[15,26,37,38]。ms定位在10号染色体SSR标记BARCSOYSSR_ 10_794-BARCSOYSSR_10_819之间[39]。虽然大豆核雄性不育基因的挖掘与定位已被广泛研究和报道,但目前仅有基因被克隆。Thu等[12]将位点精细定位到216 kb的区域,该区域包含23个基因,通过测序发现其中第3外显子有一个碱基插入,导致蛋白编码提前终止。利用拟南芥同源基因突变体与大豆进行功能互补验证,证明编码大豆MS4蛋白,该蛋白是具有PHD结构域的转录因子。该研究首次通过图位克隆的方法定位到大豆核雄性不育基因,但并没有进行深入的功能研究。
2 从反向遗传学角度,同源序列比对鉴定大豆GMS基因
基因之间在序列(蛋白质、DNA或RNA)水平上的相似度越高,往往在功能上也有很高的保守性。有研究报道,在玉米GMS基因中有20%拟南芥GMS同源基因和30%水稻GMS同源基因,在调控雄性不育方面具有相似的功能[47]。相比于大豆,近几十年来在拟南芥和水稻中发现了更多的GMS基因,分别鉴定到至少40个GMS基因[47]。本文根据拟南芥、水稻和玉米GMS基因,在大豆中找到了122个氨基酸相似性大于40%的同源基因(表2),同时结合公共数据库中大豆不同组织中的基因表达数据(http:// venanciogroup.uenf.br/resources/),通过聚类分析将这122个基因分成3类(I、II、III),其中第一类可进一步分为两个子类(图1)。

表2 拟南芥、水稻和玉米GMS基因与大豆同源基因
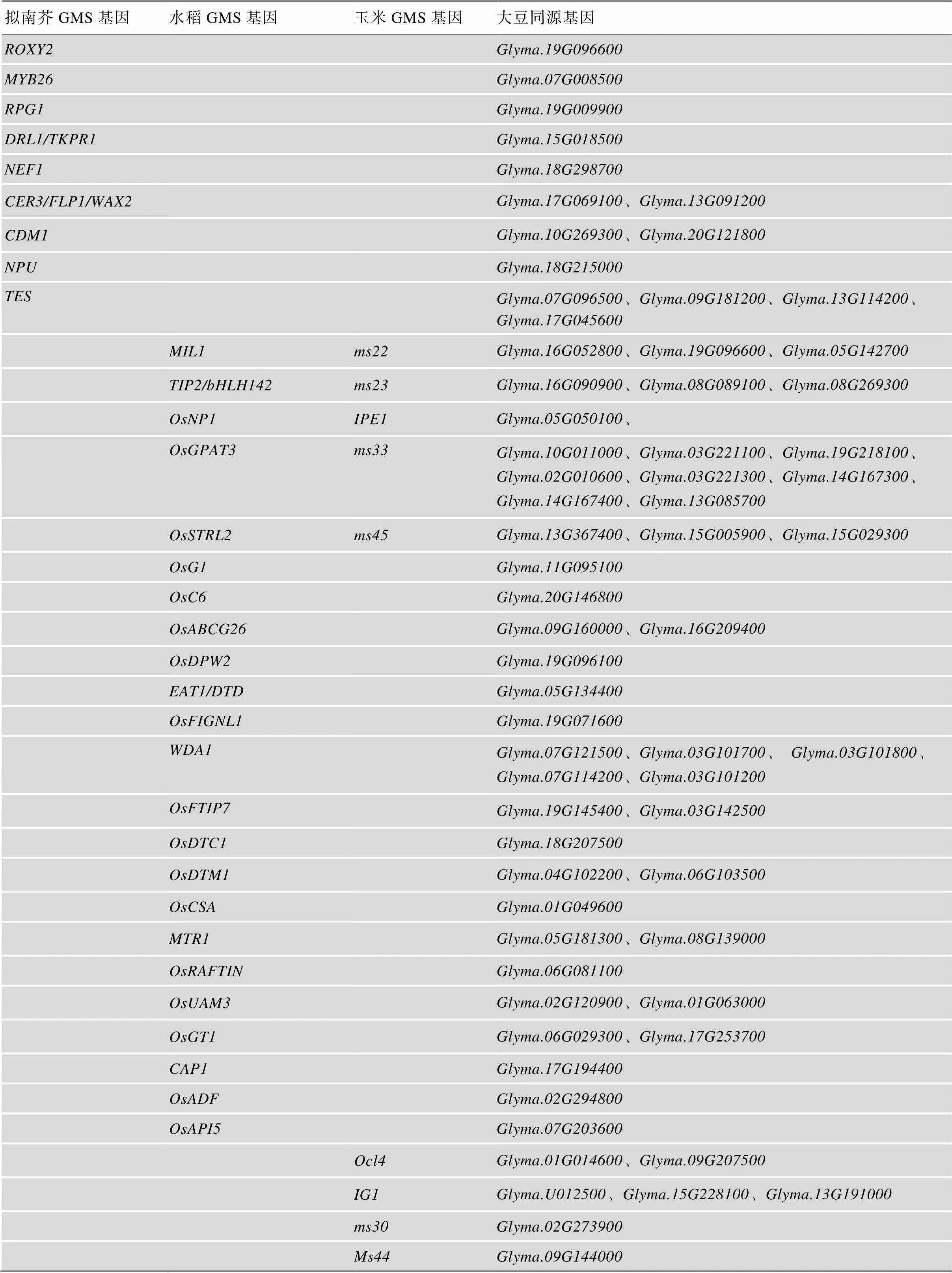
续表

图1 大豆同源GMS基因在不同组织中表达聚类热图
不同颜色深浅表示不同基因在不同组织表达量的高低,蓝色越深则表达量越高,黄色越深则表达量越低;I:I-1类基因在花中优势表达,I-2类基因在子叶和胚乳中几乎不表达;II:在根瘤中几乎不表达的一类基因;III:在子叶、胚乳和根瘤中几乎不表达的一类基因。
32个I类(I-1)基因在花中优势表达,包括拟南芥[48]、[49]、[50]、[51]、[52]、[53]、[54]、[55]、[56]、[57]和[58],水稻[59]、[60]、[61]、[62]、[63]、[64]、[65]、[66]、[67]和[68],玉米、、、、等大豆同源基因[47]。其中绝大部分GMS基因参与了脂质代谢过程,如拟南芥和分别编码脂肪酰基辅酶A合成酶(ACOS)、长链脂肪酸ω-羟化酶(CYP704B)和细胞色素P450脂肪酸羟化酶(CYP703A),在孢粉素合成和花粉外壁形成中扮演重要角色;一旦发生突变,将导致乌氏体形成缺陷,花粉壁发育不完整;它们分别与水稻和及玉米和同源[69]。参与脂质代谢的基因中也包含一些重要转录因子,其中拟南芥[70]与水稻和玉米[71]同源,编码具有PHD结构域的转录因子,调控绒毡层细胞程序性死亡及花药晚期发育。拟南芥和水稻[65]同源,编码bHLH转录因子,形成DYT1-TDF1-AMS-Ms188- Ms1遗传调控网络,影响绒毡层细胞发育和减数分裂后小孢子形成过程[58,72]。玉米是花药体细胞层分化所必须的转录因子,其在水稻中同源基因编码的转录因子在绒毡层细胞程序性死亡和花粉发育中起着关键作用[73]。
29个I类基因(I-2)在子叶和胚乳中几乎不表达。34 个II类基因在胚乳和花中的表达量较高,在子叶和根瘤中几乎不表达。26个III类基因在不同组织均有表达,但大多数基因在子叶、胚乳和根瘤中几乎不表达。综上所述,I类基因(I-1)更有可能是大豆中的GMS基因。
利用大豆中122个可能的GMS基因,结合大豆中已经报道的GMS基因所在的区间,本文将部分基因绘制在大豆染色体上(图2)。结果显示,基因和在位点所在的区间内,其中拟南芥[70]与同源,在花粉发育过程中影响绒毡层发育,与大豆突变体表型相似。基因和在位点所在的区间内,其中与拟南芥[74]同源,在小孢子形成过程中调控胼胝质代谢,影响花粉外壁形成;而与拟南芥水稻基因同源,编码bHLH转录因子,调控绒毡层细胞发育和减数分裂后小孢子形成,突变体产生膨大绒毡层和败育小孢子,突变体绒毡层退化和细胞程序性死亡延迟,导致小孢子凹陷败育[58]。大豆突变体也是由于绒毡层发育异常导致小孢子败育,因此可能是大豆的候选基因。13号染色体的、和在所在的区间内,其中与拟南芥同源,基因是CAZy糖基转移酶31基因家族成员,突变导致阿拉伯半乳聚糖蛋白(AGP)/果胶聚糖合成缺陷,参与拟南芥花粉外壁结构和形态建成,从而影响花粉活力[75]。与水稻[76]同源,与绒毡层发育、脂质代谢相关。拟南芥[77]与同源,通过调控角质层发育影响花粉育性,其中拟南芥同源基因突变体的表型与大豆的突变体表型更为接近,可能是的候选基因。此外,和分别在和位点所在的区间内,其中在拟南芥中的同源基因编码R2R3 MYB转录因子,在绒毡层、减数分裂细胞和小孢子中高度表达,可能是控制胼胝质降解的关键基因[78]。大豆与拟南芥[79]和烟草[80]基因同源,拟南芥基因编码驱动蛋白,与细胞分裂时期微管运动有关,突变体在小孢子四分体时期胞质分裂失败,结果产生体积较大的败育花粉粒;而烟草突变体中NPK1的定位与活性受到影响,抑制了成膜体和细胞板的扩张,从而产生了具有不完整细胞板的多核细胞,该表型与大豆突变体极为相似,提示很有可能是大豆的候选基因。编码具PHD结构域的转录因子,位于所在的区间,已经通过基因功能互补和CRISPR/Cas9技术,证实该基因就是大豆中的[12]。
通过对以上大豆GMS基因候选基因的预测,再利用CRISPR/Cas9或RNAi等反向遗传学手段,对这些可能的大豆GMS基因进行功能验证,以筛选大豆完全雄性不育系,有望创造出更多有价值的大豆雄性不育材料用于杂交育种。
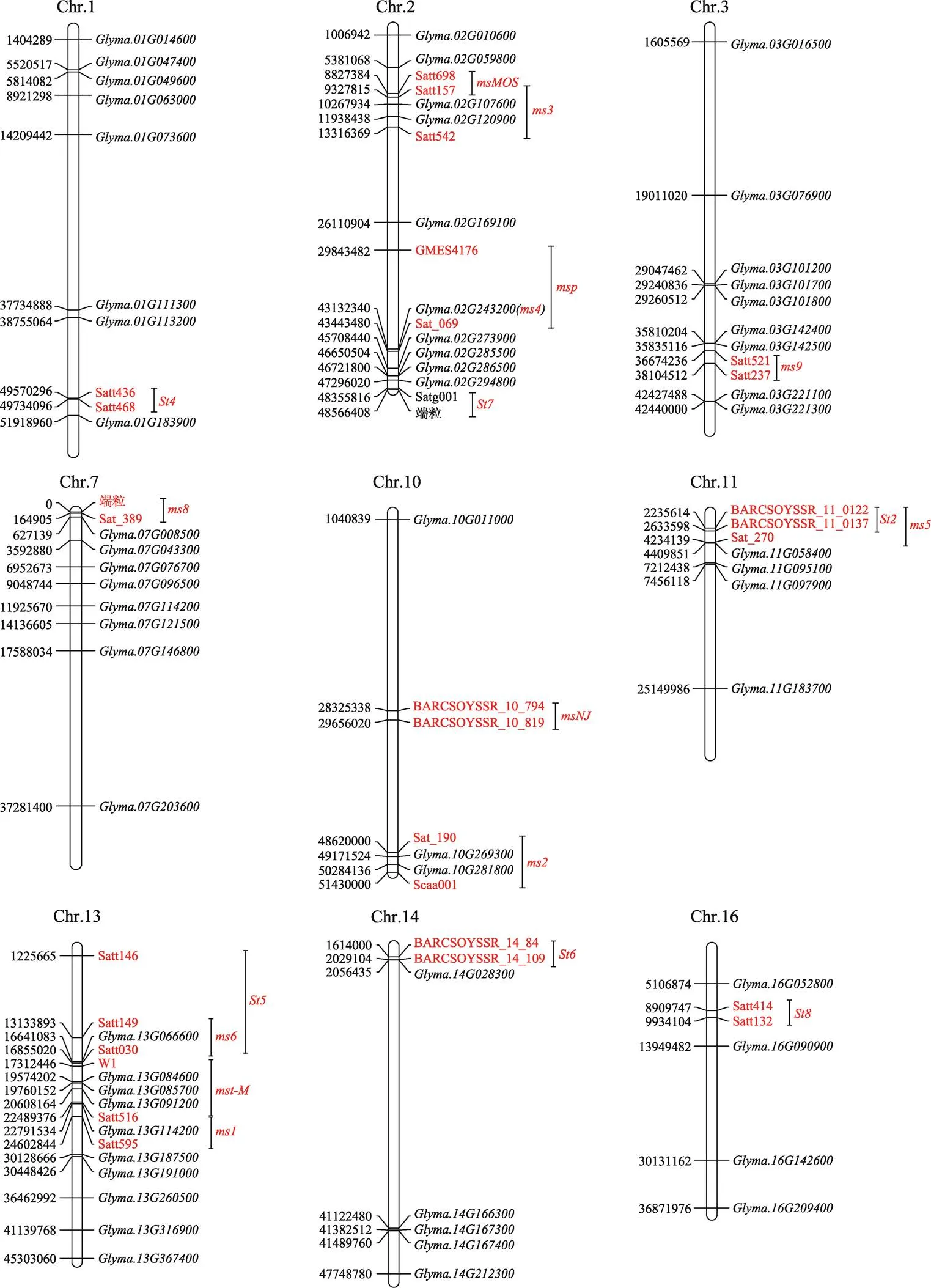
图2 大豆不育位点及GMS同源基因所在的染色体位置图
红色斜体符号、、、、、、、、、、、ms、、、、和为基因;其余红色符号为分子标记。
3 结语与展望
大豆中虽然已经鉴定很多细胞核雄性不育突变体,但是基因克隆和分子机理的研究报道较少。植物之间存在着雄性生殖发育调控网络的保守性和多样性[47],利用模式植物GMS基因信息进行分析是发现大豆中GMS基因的有效方法,通过鉴定这些GMS基因在大豆花药中优势表达的同源基因,再利用CRISPR/Cas9基因编辑技术和功能互补实验进行进一步的验证,可鉴定新的大豆核雄性不育基因。这不仅有助于人们了解雄性不育的分子机制和大豆生殖生物学,更重要的是可以开发稳定的能够用于杂交种子生产的大豆不育系统。
大豆中很多核不育系由于其中存在大量可育植株,并且花器官结构存在异常,很难应用于杂交种的生产[81]。随着三系杂交和两系杂交育种技术在应用中显现的问题日益突出[6~9],研究人员利用现代生物技术,已开发了利用转基因手段保持或繁殖非转基因的植物核雄性不育系的方法[82]。其中包括玉米的多控不育技术、新型玉米基因工程不育制种技术和水稻的智能不育技术,综合了转基因技术、荧光蛋白筛选技术和花粉失活技术,将花粉育性恢复基因、花粉自我降解基因或、荧光蛋白筛选标记基因或抗除草剂基因组合构建遗传转化载体,通过遗传转化将转基因元件导入隐性核不育系中,获得可育的转基因保持系,该保持系自花授粉以1∶1的比例获得可育转基因种子和不育非转基因种子,可通过荧光分选出来;非转基因不育种子不发荧光,因此可以有效解决雄性不育种子保持和繁殖的问题,以期用于大规模商业生产。
叶绿体转化和利用种子成熟后特异表达启动子可能是利用作物核雄性不育基因的有效途径[83]。通过叶绿体转化,如构建定点整合载体、利用叶绿体特异的启动子和终止子等将育性恢复基因转移到雄性不育株的胞质中,实现外源花粉育性恢复基因的表达,获得可育的保持系,该保持系可作为父本与不育系进行杂交,生产杂交种子[83,84]。另外,可以通过人工构建的启动子调控外源基因的表达,将种子成熟特异表达启动子、毒素致死基因和花粉育性恢复基因作为紧密连锁的元件通过遗传转化导入不育株,获得转基因植株。该转基因株系在早期是可育的,可通过自花授粉生产繁殖不育系,在转基因植株种子成熟后,致死基因将发挥作用,导致带有育性恢复基因的转基因种子死亡,因此后代成活的不育种子不具有转基因[84,85]。
通过现代生物技术手段,有望充分利用大豆核不育基因构建相似的大豆核雄性不育杂交系统,有利于在大豆中更快、更好的实现杂种优势利用。
[1] Kim YJ, Zhang DB. Molecular control of male fertility for crop hybrid breeding., 2018, 23(1): 53–65.
[2] Zhang SQ. Advances on yield formation of hybrid wheat., 2019, 35(6): 1–5.张胜全. 杂交小麦产量形成的研究进展. 中国农学通报, 2019, 35(6): 1–5.
[3] Li JJ, Nadeem M, Sun GL, Wang XB, Qiu LJ. Male sterility in soybean: occurrence, molecular basis and utilization., 2019, 138(6): 659–676.
[4] Chen LT, Liu YG. Male sterility and fertility restoration in crops., 2014, 65(1): 579–606.
[5] Horn R, Gupta KJ, Colombo N. Mitochondrion role in molecular basis of cytoplasmic male sterility., 2014, 19: 198–205.
[6] Huang JZ, E ZG, Zhang HL, Shu QY. Workable male sterility systems for hybrid rice: genetics, biochemistry, molecular biology, and utilization., 2014, 7(1): 13.
[7] Cheng SH, Zhuang JY, Fan YY, Du JH, Cao LY. Progress in research and development on hybrid rice: a super- domesticate in China., 2007, 100(5): 959–966.
[8] Xu XM, Zhang SG, Liang KJ. Progress and discussion in breeding of indica rice CMS lines in China., 2007, 23(3): 176–180.许旭明, 张受刚, 梁康迳. 中国水稻籼型三系不育系选育的进展与讨论. 中国农学通报, 2007, 23(3): 176–180.
[9] Chen LY, Lei DY, Tang WB, Xiao YH. Thoughts and practice on some problems about research and application of two-line hybrid rice., 2011, 18(2): 79–85.
[10] Fu ZY, Qin YT, Tang JH. Reviews of photo-or/and thermo-sensitive genic male sterile gene in major crops., 2018, 38(1): 115–125.付志远, 秦永田, 汤继华. 主要作物光温敏核雄性不育基因的研究进展与应用. 中国生物工程杂志, 2018, 38(1): 115–125.
[11] Chang ZY, Chen ZF, Wang N, Xie G, Lu JW, Yan W, Zhou JL, Tang XY, Deng XW. Construction of a male sterility system for hybrid rice breeding and seed production using a nuclear male sterility gene., 2016, 113(49): 14145–14150.
[12] Thu SW, Rai KM, Sandhu D, Rajangam A, Balasubramanian VK, Palmer RG, Mendu V. Mutation in a PHD-finger protein MS4 causes male sterility in soybean., 2019, 19(1): 378.
[13] Johns CW, Palmer RG. Floral development of a flower- structure mutant in soybeans,(L.) Merr. (Leguminosae)., 1982, 69(5): 829–842.
[14] Stelly DM, Palmer RG. A partially male-sterile mutant line of soybeans,(L.) Merr.: characterization of thephenotype variation., 1980, 29(3): 539–546.
[15] Frasch RM, Weigand C, Perez PT, Palmer RG, Sandhu D. Molecular mapping of 2 environmentally sensitive male- sterile mutants in soybean., 2011, 102(1): 11–16.
[16] Hao Y, Zhang JY, Zhang CB, Bao P, Zhang WL, Wang PN, Ding XY, Liu BH, Feng XZ, Zhao LM. Genetic effects and plant architecture influences on outcrossing rate in soybean., 2019, 18(9): 1971–1979.
[17] Owen FV. A sterile character in soybeans., 1928, 3(2): 223–226.
[18] Hadley HH, Starnes WJ. Sterility in soybeans caused by asynapsis., 1964, 4(4):421–424.
[19] Palmer RG, Kaul MLH. Genetics, cytology, and linkage studies of a desynaptic soybean mutant., 1983, 74(4): 260–264.
[20] Palmer RG, Horner HT. Genetics and cytology of a genic male-sterile, female-sterile mutant from a transposon- containing soybean population., 2000, 91(5): 378–383.
[21] Brim CA, Young MF. Inheritance of a male-sterile character in soybeans., 1971, 11(4): 564–566.
[22] Albertsen MC, Palmer RG. A comparative light-and electron-microscopic study of microsporogenesis in male sterile (,) and male fertile soybeans ((L.) Merr.)., 1979, 66(3): 253–265.
[23] Graybosch RA, Palmer RG. Male sterility in soybean (). I. phenotypic expression of themutant., 1985, 72(11): 1738–1750.
[24] Palmer RG, Johns CW, Muir PS. Genetics and cytology of themale-sterile soybean., 1980, 71(5): 343–348.
[25] Delannay X, Palmer RG. Genetics and cytology of themale-sterile soybean., 1982, 73(3): 219–223.
[26] Ott A, Yang Y, Bhattacharyya M, Horner HT, Palmer RG, Sandhu D. Molecular mapping of,andrevealed linkage between the cotyledon color locusand the male-sterile locusin soybean., 2013, 2(3): 441–454.
[27] Skorupska H, Palmer RG. Genetics and cytology of themale-sterile soybean., 1989, 80(4): 304–310.
[28] Palmer RG. Genetics of four male-sterile, female-fertile soybean mutants., 2000, 40(1): 78–83.
[29] Palmer RG, Gai JY, Sun HA, Burton JW. Production and evaluation of hybrid soybean., 2001, 21: 263–307.
[30] Yang SP, Gai JY, Xu HQ. A genetical and cytomorphological study on the male sterile mutantin soybeans., 1998, 17(1): 32–38.杨守萍, 盖钧镒, 徐汉卿. 大豆雄性不育突变体的遗传学与细胞学鉴定. 大豆科学, 1998, 17(1): 32–38.
[31] Wang F, Wei BG, Li GQ, Li YH. A cytological observation of the pollen mother cells of the photoperiod-sensitive male sterile soybean plant of., 2004, 37(8): 1110–1113.王芳, 卫保国, 李贵全, 李艳花. 大豆光敏雄性不育株小孢子母细胞的细胞学观察. 中国农业科学, 2004, 37(8): 1110–1113.
[32] Zhao TJ, Yang SP, Gai JY. Discovery of a dominant nuclear male sterile mutantin soybean and analysis of its inheritance., 2005, 38(1): 22–26.赵团结, 杨守萍, 盖钧镒. 大豆显性核雄性不育突变体的发现与遗传分析. 中国农业科学, 2005, 38(1): 22–26.
[33] Wiebbecke CE, Graham MA, Cianzio SR, Palmer RG. Day temperature influences the male-sterile locusin soybean., 2012, 52(4): 1503–1510.
[34] Speth B, Rogers JP, Boonyoo N, Vanmeter AJ, Baumbach J, Ott A, Moore J, Cina T, Palmer RG, Sandhu D. Molecular mapping of five soybean genes involved in male-sterility, female-sterility., 2015, 58(4): 143–149.
[35] Chardin C, Girin T, Roudier F, Meyer C, Krapp A. The plant RWP-RK transcription factors: key regulators of nitrogen responses and of gametophyte development., 65(19): 5577–5587.
[36] Kato KK, Palmer RG. Molecular mapping of the male-sterile, female-sterile mutant gene () in soybean., 2003, 94(5): 425–428.
[37] Cervantes-Martinez I, Xu M, Zhang L, Huang Z, Kato KK, Horner HT, Palmer RG. Molecular mapping of male- sterility lociandin soybean., 2007, 47(1): 374–379.
[38] Yang Y, Speth BD, Boonyoo N, Baumert E, Atkinson TR, Palmer RG, Sandhu D. Molecular mapping of three male-sterile, female-fertile mutants and generation of a comprehensive map of all known male sterility genes in soybean., 2014, 57(3): 155–160.
[39] Nie ZX, Zhao TJ, Liu MF, Dai JY, He TT, Lyu D, Zhao JM, Yang SP, Gai JY. Molecular mapping of a novel male- sterile genemsin soybean [(L.) Merr.]., 2019, 32(4): 371–380.
[40] Cervantes-Martinez I, Sandhu D, Xu M, Ortiz-Pérez E, Kato KK, Horner HT, Palmer RG. The male sterility locusis present in a fertility controlling gene cluster in soybean., 2009, 100(5): 565–570.
[41] Graybosch RA, Palmer RG. Analysis of a male-sterile character in soybeans., 1987, 78(2): 66–70.
[42] Buss GR. Research Notes: Inheritance of a male-sterile mutant from irradiated Essex soybeans., 1983, 10(33): 104–108.
[43] Zhao LM, Liu DP, Sun H, Yuan Y, Huang M. A sterile material of soybean gainned by introducing exogenous DNA., 1995, 14(1): 83–87.赵丽梅, 刘德璞, 孙寰, 袁英, 黄梅. 外源DNA导入大豆获得一不育材料. 大豆科学, 1995, 14(1): 83–87.
[44] Li SG, Zhao TJ, Gai JY. Cytological and genetical characterization of a nuclear male-sterille soybean mutant, 2010, 29(2): 181–185.李曙光, 赵团结, 盖钧镒. 大豆突变体核雄性不育性的细胞学与遗传学分析. 大豆科学, 2010, 29(2): 181–185.
[45] Zhang L, Huang ZP, Li JK, Dai OH. Preliminary study on soybean male sterile mutantand its heterosis., 1999, 21(1): 20–23.张磊, 黄志平, 李杰坤, 戴瓯和. 大豆雄性不育突变体及其杂种优势初步研究. 中国油料作物学报, 1999, 21(1): 20–23.
[46] Zhao QS, Tong Y, Yang CY, Yang YQ, Zhang MC. Identification and mapping of a new soybean male-sterile gene,., 2019, 10(94): 1–9.
[47] Wan XY, Wu SW, Li ZW, Dong ZY, An XL, Ma B, Tian YH, Li JP. Maize genic male-sterility genes and their applications in hybrid breeding: progress and perspectives., 2019, 12(3): 321–342.
[48] Zheng ZF, Xia Q, Dauk M, Shen WY, Selvaraj G, Zou JT.AtGPAT1, a member of the membrane-bound glycerol-3-phosphate acyltransferase gene family, is essential for tapetum differentiation and male fertility., 2003, 15(8): 1872–1887.
[49] Grienenberger E, Kim SS, Lallemand B, Geoffroy P, Heintz D, de Azevedo Souza C, Heitz T, Douglas CJ, Legrand M. Analysis offunction inreveals a previously unknown, but conserved, biochemical pathway in sporopollenin monomer biosynthesis., 2010, 22(12): 4067–4083.
[50] Yang CY, Xu ZY, Song J, Conner K, Vizcay Barrena G, Wilson ZA.regulates secondary thickening in the endothecium and is essential for anther dehiscence., 2007, 19(2): 534–548.
[51] Lou Y, Xu XF, Zhu J, Gu JN, Blackmore S, Yang ZN. The tapetal AHL family protein TEK determines nexine formation in the pollen wall., 2014, 5(1): 3855.
[52] Dobritsa AA, Shrestha J, Morant M, Pinot F, Matsuno M, Swanson R, Møller BL, Preuss D. CYP704B1 is a long-chain fatty acid omega-hydroxylase essential for sporopollenin synthesis in pollen of., 2009, 151(2): 574–589.
[53] Morant M, Jørgensen K, Schaller H, Pinot F, Møller BL, Werck-Reichhart D, Bak S. CYP703 is an ancient cytochrome P450 in land plants catalyzing in-chain hydroxylation of lauric acid to provide building blocks for sporopollenin synthesis in pollen., 2007, 19(5): 1473–1487.
[54] Kim SS, Grienenberger E, Lallemand B, Colpitts CC, Kim SY, de Azevedo Souza C, Geoffroy P, Heintz D, Krahn D, Kaiser M, Kombrink E, Heitz T, Suh DY, Legrand M, Douglas CJ.andencode hydroxyalkyl α-pyrone synthases required for pollen development and sporopollenin biosynthesis in., 2010, 22(12): 4045–4066.
[55] Paxson-Sowders DM, Dodrill CH, Owen HA, Makaroff CA. DEX1, a novel plant protein, is required for exine pattern formation during pollen development in., 2001, 127(4): 1739–1749.
[56] Guan YF, Huang XY, Zhu J, Gao JF, Zhang HX, Yang ZN., a member of thegene family, is crucial for exine pattern formation and cell integrity of microspores in., 2008, 147(2): 852–863.
[57] Kim MJ, Kim M, Lee MR, Park SK, Kim J.interacts withto control pollen development in., 2015, 81(5): 794–809.
[58] Xu J, Yang CY, Yuan Z, Zhang DS, Gondwe MY, Ding ZW, Liang WQ, Zhang DB, Wilson ZA. Theregulatory network Is required for postmeiotic male reproductive development in., 2010, 22(1): 91–107.
[59] Cai CF, Zhu J, Lou Y, Guo ZL, Xiong SX, Wang K, Yang ZN. The functional analysis ofreveals a conserved genetic pathway for tapetal development between rice and., 2015, 60(12): 1073–1082.
[60] Zhao GC, Shi JX, Liang WQ, Xue FY, Luo Q, Zhu L, Qu GR, Chen MJ, Schreiber L, Zhang DB. Two ATP Binding Cassette G transporters, Rice ATP binding cassette G26 and ATP binding cassette G15, collaboratively regulate rice male reproduction., 2015, 169(3): 2064–2079.
[61] Li H, Yuan Z, Vizcay-Barrena G, Yang CY, Liang WQ, Zong J, Wilson ZA, Zhang DB.encodes a PHD-finger protein that is required for tapetal cell death and pollen development in rice., 2011, 156(2): 615–630.
[62] Zhu XL, Yu J, Shi JX, Tohge T, Fernie AR, Meir S, Aharoni A, Xu DW, Zhang DB, Liang WQ. The polyketide synthase OsPKS2 is essential for pollen exine and ubisch body patterning in rice., 2017, 59(9): 612–628.
[63] Li YL, Li DD, Guo ZL, Shi QS, Xiong SX, Zhang C, Zhu J, Yang ZN. OsACOS12, an orthologue ofacyl-CoA synthetase5, plays an important role in pollen exine formation and anther development in rice., 2016, 16(1): 256.
[64] Tan HX, Liang WQ, Hu JP, Zhang DB.encodes a secretory fasciclin glycoprotein required for male reproductive development in rice., 2012, 22(6): 1127–1137.
[65] Fu ZZ, Yu J, Cheng XW, Zong X, Xu J, Chen MJ, Li ZY, Zhang DB, Liang WQ. The rice basic helix-loop-helix transcription factor TDR INTERACTING PROTEIN2 is a central switch in early anther development., 2014, 26(4): 1512–1524.
[66] Zou T, Li SC, Liu MX, Wang T, Xiao Q, Chen D, Li Q, Liang YL, Zhu J, Liang YY, Deng QM, Wang SQ, Zheng AP, Wang LX, Li P. An atypical strictosidine synthase, OsSTRL2, plays key roles in anther development and pollen wall formation in rice., 2017, 7(1):6863.
[67] Moon S, Kim SR, Zhao GC, Yi J, Yoo Y, Jin P, Lee SW, Jung KH, Zhang DB, An G. Riceencodes a glycosyltransferase essential for pollen wall formation., 2013, 161(2): 663–675.
[68] Shi X, Sun XH, Zhang ZG, Feng D, Zhang Q, Han LD, Wu JX, Lu TG. GLUCAN SYNTHASE-LIKE 5 (GSL5) plays an essential role in male fertility by regulating callose metabolism during microsporogenesis in rice., 2015, 56(3): 497–509.
[69] Wan XY, Wu SW, Li ZW, An XL, Tian YH. Lipid Metabolism: critical roles in male fertility and other aspects of reproductive development in plants., 2020, 13(7): 955–983.
[70] Ito T, Nagata N, Yoshiba Y, Ohme-Takagi M, Ma H, Shinozaki K.encodes a PHD-type transcription factor and regulates pollen and tapetum development., 2007, 19(11): 3549– 3562.
[71] Zhang DF, Wu SW, An XL, Xie K, Dong ZY, Zhou Y, Xu LW, Fang W, Liu SS, Liu SS, Zhu TT, Li JP, Rao LQ, Zhao JR, Wan XY. Construction of a multicontrol sterility system for a maize male-sterile line and hybrid seed production based on thegene encoding a PHD-finger transcription factor., 2018, 16(2): 459–471.
[72] Lou Y, Zhou HS, Han Y, Zeng QY, Zhu J, Yang ZN. Positive regulation of AMS by TDF1 and the formation of a TDF1-AMS complex are required for anther development in., 2018, 217(1): 378–391.
[73] Ko SS, Li MJ, Ku MSB, Ho YC, Lin YJ, Chuang MH, Hsing HX, Lien YC, Yang HT, Chang HC, Chan MT. The bHLH142 transcription factor coordinates with TDR1 to modulate the expression of EAT1 and regulate pollen development in rice., 2014, 26(6): 2486–2504.
[74] Lu PL, Chai MF, Yang JG, Ning G, Wang GL, Ma H. Thegene is required for male fertility through regulating callose metabolism during microsporogenesis., 2014, 164(4): 1893–1904.
[75] Suzuki T, Narciso JO, Zeng W, Van De Meene A, Yasutomi M, Takemura S, Lampugnani ER, Doblin MS, Bacic A, Ishiguro S. KNS4/UPEX1: A type II Arabinogalactan β-(1,3)-Galactosyltransferase required for pollen exine development., 2017, 173(1): 183–205.
[76] Men X, Shi JX, Liang WQ, Zhang QF, Lian GB, Quan S, Zhu L, Luo ZJ, Chen MJ, Zhang DB. Glycerol-3- Phosphate Acyltransferase 3 (OsGPAT3) is required for anther development and male fertility in rice., 2017, 68(3): 513–526.
[77] Chen XB, Goodwin SM, Boroff VL, Liu XL, Jenks MA. Cloning and characterization of thegene ofinvolved in cuticle membrane and wax production., 2003, 15(5): 1170–1185.
[78] Zhu J, Chen H, Li H, Gao JF, Jiang H, Wang C, Guan YF, Yang ZN. Defective inis essential for anther development and tapetal function for microspore maturation in., 2008, 55(2): 266–277.
[79] Yang CY, Spielman M, Coles JP, Li Y, Ghelani S, Bourdon V, Brown RC, Lemmon BE, Scott RJ, Dickinson HG. TETRASPORE encodes a kinesin required for male meiotic cytokinesis in., 2003, 34(2): 229–240.
[80] Nishihama R, Soyano T, Ishikawa M, Araki S, Tanaka H, Asada T, Irie K, Ito M, Terada M, Banno H, Yamazaki Y, Machida Y. Expansion of the cell plate in plant cytokinesis requires a kinesin-like protein/MAPKKK complex., 2002, 109(1): 87–99.
[81] Wang SM, Sun H, Zhao LM, Wang YQ, Peng B, Fan XH, Zhang BS. Progress and problem analysis on soybean male sterility and heterosis exploitation in China., 2009, 28(6): 1089–1096+1102.王曙明, 孙寰, 赵丽梅, 王跃强, 彭宝, 范旭红, 张宝石. 中国大豆雄性不育和杂种优势利用研究进展与问题分析. 大豆科学, 2009, 28(6): 1089–1096+1102.
[82] Wu SW, Wang XY. Using biotechnology to establish the technical system of male sterile cross breeding and seed production of main crops., 2018, 38(1): 78–87.吴锁伟, 万向元. 利用生物技术创建主要作物雄性不育杂交育种和制种的技术体系. 中国生物工程杂志, 2018, 38(1): 78–87.
[83] Hou BK, Yu HM, Xia GM. Expression vector used in chloroplast genetic transformation., 2002, 24(1): 100–103.侯丙凯, 于惠敏, 夏光敏. 用于叶绿体遗传转化的表达载体. 遗传, 2002, 24(1): 100–103.
[84] Li XQ, Yuan LP, Deng QY, Xiao JH. Potential ways to use spontaneous genic male sterility in the molecular breeding of hybrid crops., 2003, 20(5): 625–631.李新奇, 袁隆平, 邓启云, 肖金华. 在杂交作物分子育种中利用普通核雄性不育的几个可能途径. 植物学报, 2003, 20(5): 625–631.
[85] Li XQ, Zhao CP, Xiao JH, Xie FM.Technical analysis of utilization of spontaneous and artificial genic male sterility in molecular breeding of hybrid crops., 2006, 24(11): 39–44.李新奇, 赵昌平, 肖金华, 谢放鸣. 基因转化创造植物杂种优势利用新方式的途径分析. 科技导报, 2006, 24(11): 39–44.
Progress on genic male sterility gene in soybean
Xiaoyuan Sun, Yifan Wang, Yunhui Wang, Jiayu Lin, Jinhong Li, Yuantao Qiu, Xiaolong Fang, Fanjiang Kong, Meina Li
Male sterility refers to the phenomenon that stamens cannot grow normally and produce viable pollen grains in plants. Hybrid seed production by taking advantage of the trait of male sterility is an effective and quick strategy to increase crop yield. Up to date, the yield of rice (L.), maize (L.), wheat (L.) and other crops has been greatly increased based on hybrid vigor utilization. Soybean ((L.) Merr.) is a self-pollination species, artificial emasculation is not only time-consuming, but also labor-intensive and economically impracticable. So far, large scale hybrid breeding has not been performed in soybean due to the shortage of male sterile lines suitable for hybrid production. Therefore, it is urgent to identify a stable male sterile system for the rapid utilization of heterosis in soybean. In this review, we summarize the progress on the discovery of soybean genic male sterility (GMS) mutants and GMS genes. Combining with the investigation of GMS genes in, rice and maize, we provide important insights into the identification and potential utilization of GMS genes in soybean in the perspective of reverse genetics.
soybean; genic male sterility; reverse genetics
2020-10-23;
2020-12-07
国家自然科学基金项目(编号:31871648)资助[Supported by the National Natural Science Foundation of China (No. 31871648)]
孙小媛,在读硕士研究生,专业方向:植物资源利用。E-mail: 1797740106@qq.com
孔凡江,博士,教授,研究方向:大豆分子育种。E-mail: kongfj@gzhu.edu.cn李美娜,博士,副教授,研究方向:大豆杂种优势利用和生物钟与环境互作。E-mail: limeina@gzhu.edu.cn
10.16288/j.yczz.20-357
2021/1/11 17:13:43
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210108.1636.001.html
(责任编委: 王秀娥)
