丹参酮ⅡA对大鼠脑动脉瘤形成的作用
2021-02-02尹媛卫志庆朱建国乔冠群李英斌侯道荣马骏
尹媛 卫志庆 朱建国 乔冠群 李英斌 侯道荣 马骏
(南京医科大学 1医药实验动物中心,江苏 南京 210029;2第二附属医院血管外科;3第二附属医院影像科;4附属南京医院神经外科)
脑动脉瘤(CA)是临床上最常见的脑血管疾病之一,在普通人群中发病率为1%~5%〔1〕。大多数未破裂的CA无症状或表现为慢性头痛等常见症状〔2〕。颅内动脉瘤破裂是蛛网膜下腔出血(SAH)最常见的原因。CA破裂是自发性SAH最常见的原因。SAH在脑血管疾病中占第三位,仅次于脑血栓形成和高血压性脑出血,其致死率和致残率都很高,病死率可达25%~50%〔3〕,存活患者还会出现并发症。开颅手术和血管介入治疗是现有的两种有效治疗手段,但两种方式均为有创性操作,存在不同程度的手术风险及治疗局限性〔4,5〕。因此,寻找有效的CA无创治疗方法具有重要意义。丹参酮(Tan)ⅡA 是从中药丹参中提取的主要成分,其被广泛用于治疗各种疾病,如心血管疾病、糖尿病和癌症〔6~8〕。有报道称Tan ⅡA能抑制肿瘤坏死因子(TNF)-α诱导的磷酸化和核因子(NF)-κB DNA结合,可导致人类主动脉平滑肌细胞(HASMC)迁移并增加基质金属蛋白酶(MMP)-9活性〔9〕。然而,Tan ⅡA在CA治疗中的作用尚未见报道。本研究探讨Tan ⅡA在大鼠CA形成中的作用及可能机制,为抑制CA形成提供可能的临床治疗方法。
1 材料和方法
1.1实验动物 SPF级雄性SD大鼠16只,体重200~250 g,购自南京医科大学医药动物实验中心,实验动物合格证号:SCXK(苏)2016-0002。动物自由饮食并置于恒定环境〔温度(22±2)℃,湿度(50±5)%,12 h昼/夜循环光照〕下饲养。动物实验已通过南京医科大学动物实验中心伦理委员会批准。
1.2主要试剂 Tan ⅡA(T4952)购自美国Sigma公司;TRIzol试剂盒购自美国Invitrogen公司;q-PCR试剂盒购自美国Roche公司;互补脱氧核糖核酸(cDNA)合成试剂盒购自日本Takara公司;NF-κB 抗体(ab16502)购自美国Abcam公司;甘油醛-3-磷酸脱氢酶(GAPDH)抗体(AC033)购自美国Abclonal公司;羊抗鼠和羊抗兔二抗购自美国Cell Signaling Technology 公司。显影液购自美国Thermo公司。
1.3主要仪器 大鼠无创血压仪购自美国肯特公司;Q-PCR仪(ABI 7500)购自美国Applied Biosystems公司;ChemiDoc MP成像仪购自美国Bio.Rad公司。
1.4方法
1.4.1大鼠CA模型的构建 参考相关文献制作大鼠CA模型〔10〕。使用3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,开腹后在显微镜下分离出双侧肾动脉后支予以结扎,术后1 w结扎左侧颈总动脉,并使用含有1%氯化钠的高盐饮食来诱发全身性高血压。手术后的大鼠置于标准设施中饲养。
1.4.2分组和干预 使用随机数字表法将大鼠随机分为模型组(CA组)和治疗组(CA+Tan ⅡA组)。CA组采用手术和高盐饮食诱导CA模型;CA+Tan ⅡA组采用手术和高盐饮食诱导CA后,腹腔注射0.9% NaCl 溶液1 ml 的Tan ⅡA(25 mg/kg)〔11〕,于4 w后处死大鼠。
1.5观察指标
1.5.1大鼠血压测量 根据容量压力记录法(VPR),使用美国肯特动物无创血压测量系统测量大鼠尾动脉血压。每3 d测1次血压,监测其变化。
1.5.2血管苏木素-伊红(HE)染色 小鼠处死后主动脉血管取材固定,石蜡包埋后切片,常规脱蜡至水。对蜡块进行切片(4 μm),HE 染色后置于载玻片进行固定,光学显微镜下观察血管形态改变。
1.5.3q-PCR 使用TRIzol试剂盒从大鼠血管组织中提取总RNA。采用cDNA合成试剂盒从RNA样本中转录的cDNA作为模板。Q-PCR反应循环为94℃,15 s;60℃,30 s;72℃,30 s。反应体系为20 μl。引物序列分别为:NF-κB:上游5′-ACGATCTGTTTCCCCTCATC-3′;下游5′-TGCTTCTCTCCCCAGGAATA-3′;单核细胞趋化蛋白(MCP)-1:上游:5′-CCTCCACCACTATGCAGGTCTC-3′;下游:5′-GCACGTGGATGCTACAGGC-3′;MMP-2:上游:5′-CTGATAACCTGGATGCAGTCGT-3′;下游:5′-CCAG CCAGTCCGATTTGA-3′;MMP-9:上游:5′-TTCAAGGACGGTCGGTATT-3′;下游:5′-CTCGAGCCTAGACCCAACTTA-3′;GAPDH:上游:5′-AAGAAGGTGGTGAAGCAGGC-3′;下游:5′-TCCACCACCCTGTTGCTGTA-3′。
1.5.4Western印迹 大鼠脑动脉血管组织蛋白试剂盒说明书提取。组织裂解产物使用10%~15%的十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳后转移到聚偏氟乙烯(PVDF)膜上,使用5%牛血清白蛋白(BSA)溶液封闭,目标蛋白孵育一抗过夜。孵育相应辣根过氧化物酶(HRP)耦联的羊抗鼠二抗或羊抗兔二抗。使用显影液反应1 min后,在ChemiDoc MP成像系统下曝光。使用Image J软件对条带进行灰度分析。
1.6统计学方法 采用SPSS20.0进行t检验及单因素方差分析。
2 结 果
2.1Tan ⅡA抑制大鼠CA的形成 实验组大鼠术后1 d血压值开始上升,术后3 d血压明显升高,术后30 d时血压已接近升压曲线峰值,以后血压逐渐保持平稳。CA组血压为(154.64±8.65)mmHg,CA+TanⅡA组血压为(152.86±10.14)mmHg。TanⅡA处理对大鼠术后血压无明显影响(P>0.05)。形态学观察表明,Tan ⅡA治疗对大鼠CA的生长有抑制作用(图1)。CA组动脉瘤〔直径(75.67±5.32)μm〕明显大于Ca+TanⅡA组动脉瘤直径〔(41.58±4.79)μm,P<0.05〕。CA组血管壁厚为正常血管的(48.12±7.24)%,CA+TanⅡA组血管壁厚为正常血管的(8.12±5.58)%,与CA组相比,Tan ⅡA处理也增加了血管壁厚(P<0.05)。

图1 Tan ⅡA抑制大鼠CA的形成(HE,×40)
2.2Tan ⅡA降低了CA壁的炎症反应 CA组动脉瘤中浸润巨噬细胞数量为(4.56±2.02)个,CA+TanⅡA组动脉瘤中浸润巨噬细胞数量为(3.05±1.69)个。与CA组相比,CA + Tan ⅡA组巨噬细胞浸润显著较少(P<0.05),CA+Tan ⅡA组MCP-1,MMP-2和MMP-9 mRNA表达水平明显降低(P<0.05)。见表1。
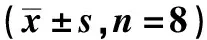
表1 各组动脉瘤组织MCP-1、MMP-2和MMP-9 mRNA表达
2.3Tan ⅡA对NF-κB表达的作用 与CA组NF-κB mRNA表达量(0.97±0.12)及蛋白表达量(0.78±0.15)比较CA+TanⅡA组NF-κB mRNA表达水平和蛋白表达水平(0.17±0.04)明显降低(图2)。
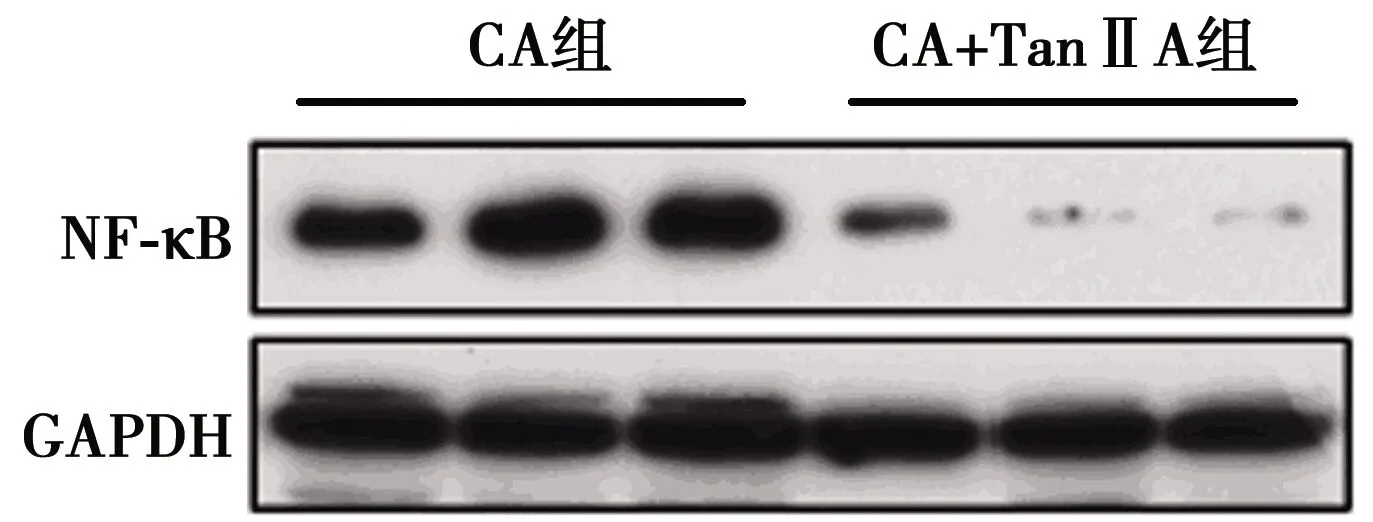
图2 Tan ⅡA对NF-κB蛋白表达的作用
3 讨 论
丹参是中药丹参中发现的一种二萜萘醌,其具有抗炎、抗氧化等多种药理作用,在中国广泛用于癌症、肝病、糖尿病、心血管疾病的治疗〔6~8〕。虽然一些研究已经发现了Tan ⅡA在不同人类疾病动物模型中的作用〔12,13〕,Tan ⅡA对CA形成和进展的影响尚未见报道。因此,这是首次在大鼠模型中探讨Tan ⅡA在CA形成中的作用。在大鼠模型中,颅内动脉分叉处血流动力学应激增加导致炎症延长,触发CA的形成和进展,这与人类的发病机制一致〔10,14〕。该模型被广泛用于探讨CA的形成机制。在过去的几十年里,研究发现CA病变中存在炎症反应,表明炎症过程在CA的发病机制中起着至关重要的作用〔15〕。
CA是一种多基因疾病,近年来,MMPs在CA形成过程中的作用渐受重视〔16,17〕,但其机制尚未阐明。MMPs是一组破坏细胞外基质锌和钙依赖性的蛋白溶解酶,可以降解细胞外基质中的胶原蛋白、非胶原糖蛋白和弹力蛋白,参与细胞外基质重构,这些MMPs主要由浸润的巨噬细胞分泌,在组织重塑中起着至关重要的作用〔18〕。其中MMP-2、MMP-9与CA形成关系最为密切〔19〕。研究证实,MMPs活性异常增高参与了CA的形成〔20〕。在人CA中,患者血清和动脉瘤壁MMP-2和MMP-9的表达显著升高〔21〕。
MCP-1,MMP-2和MMP-9是NF-κB信号的下游分子。NF-κB调节炎症基因的表达,如白细胞介素(IL)-1,诱导一氧化氮合酶(iNOS)和MMP〔22〕。大量研究表明慢性炎症在CA的形成和进展中起着重要作用〔15,23〕。NF-κB通过上调MCP-1表达介导巨噬细胞募集是炎症反应中的一个重要过程。IL-1和iNOS可引起血管平滑肌细胞凋亡,从而导致血管内皮损伤和内部弹性层的破坏〔24〕。MMP-2和MMP-9参与胶原降解和破坏导致的血管壁重塑〔25〕。由于其在CA中的重要作用,NF-κB可能成为CA的治疗靶标。
在本研究中,我们发现Tan ⅡA治疗可以防止巨噬细胞浸润和动脉瘤壁的变性。这种结果是由于对NF-κB和MCP-1表达的抑制。在心肌梗死大鼠模型中也有类似的发现〔26〕。NF-κB是调控一系列炎症相关基因表达的关键转录因子。慢性炎症反应如巨噬细胞浸润,细胞因子释放和MMPs表达引起的异常,激活了NF-κB,从而促进CA的形成和生长〔27~29〕。据报道NF-κB p50亚基的缺乏或者使用嵌合诱饵寡核苷酸抑制NF-κB的活性从而抑制CA形成和进程〔22〕。综上,Tan ⅡA在CA形成过程中,通过抑制NF-κB信号和巨噬细胞浸润减弱炎症反应,抑制血管瘤形成。NF-κB信号通路很可能是一个临床治疗CA有前景的靶标。
