3,4-二羟基苯甲醛改性UiO-66-NH2及其对U(VI)的吸附性能研究
2021-02-01张小平
张小平
(渭南市职业技术学院机电工程学院,陕西 渭南 714026)
Metal-organic frameworks(MOFs)是一种以含氮、氧等多齿有机配体为链链接过渡金属离子簇形成的配位晶体,其制备温度通常低于250 ℃,100 ℃以下常用经典的配位化学法,而在100 ℃以上则基本使用溶剂热法(溶剂通常为水,也可以是乙醇、吡啶、DMF等)[1]。MOFs有几个优点:第一是合成简单,因为羧酸或者含氮杂环配体与金属离子的反应活性高,故大部分MOFs材料可以采用水热法一步到位合成[2];第二是由于路易斯酸与金属离子的静电作用,有机配体中的官能团和配位能力可以灵活改变[3];第三是金属离子作为骨架顶点既可以作为中枢也可以在中枢形成分支,骨架得以延伸而成为三维结构[4]。MOFs的优点决定了其多孔性、比表面积大、具有不饱和的金属配位以及结构多样性的特点[5]。MOFs材料也因其特点而得到了广泛的关注和研究,在过去的十几年中,对MOFs材料的研究取得了令人印象深刻的进步,目前研究已经深入到对孔隙尺寸和功能基团可变的多孔结构的设计。这些类型的多孔材料因其在气体储存、催化、药物载带、化学传感等[6]方面的应用前景而吸引了相当大的关注。
MOFs的水溶液稳定性限制了其在许多领域中的应用,若要用于放射性废液中铀酰离子的吸附和分离则要求所选取的MOFs具有良好的水稳定性以及热稳定性[7]。2007年,Lillerud等人发现了一种具有超高稳定性的MOFs材料UiO-66(UiO=University of Oslo)[8,9],粗略化学式是Zr4O(OH)4(CO2)12,其热稳定性达到了500 ℃。由相关实验和理论计算推断该材料的稳定性是因为高度对称的无机金属单元Zr6O4(OH)4以及材料里面的金属簇八面体核(Zr6)与配体对苯二甲酸中的羧基氧的强相互作用。其中一个八面体笼Zr6与12个对苯二甲酸配体配位,形成四面体和八面体两种形式的孔笼,且每个八面体笼的每个面又都与一个四面体笼相连接,这种连接方式在三维空间内不断延伸,进一步形成了具有6Å孔径的MOFs。将UiO-66放入不同溶剂和不同pH的水溶液中,均表现出了良好的抗水性和抗酸性[10]。此外不同官能团修饰的UiO-66材料如UiO-66-NH2、UiO-66-NO3、UiO-66-Br、UiO-66-2COOH等被陆续报道出来,这些不同官能团修饰的UiO-66材料与UiO-66具有完全相同的骨架结构,但在其他方面有如热稳定性和和化学稳定性有不同程度上的退化[11]。如UiO-66-NH2和UiO-66-2COOH的骨架坍塌温度下降到了300 ℃左右[12]。由于不同官能团的修饰,其比表面积和孔隙率也有一定程度的下降[13~15]。
Uio-66结构稳定,可进行功能化修饰,本文合成了UiO-66-NH2,并在此基础上用3,4-二羟基苯甲醛进行改性,并研究了改性前后的吸附剂对U(VⅠ)的吸附行为,并探究改性后吸附剂的吸附性能是否有所提升,这对处理含U(VⅠ)废水的研究很有意义。
1 实验部分
1.1 实验所用试剂及仪器
本实验所用试剂均为市售分析纯药剂,未进行进一步纯化处理,实验所用水均为去离子水。实验数据由分光光度法测量,相关仪器信息如表1所示。

表1 实验所用主要仪器
1.2 UiO-66-NH2的合成
溶液A:取1.6 g(6.8 mmol)ZrCl4搅拌溶解于150 mLN,N-二甲基甲酰胺(DMF)中,加入11.4 mL(3.4 mol)乙酸并加热至55 ℃得到溶液A。
溶液B:将1.2 g(6.8 mmol)2-氨基对苯二甲酸溶解于50 mL DMF之中,得到溶液B。
将溶液B加入溶液A中,再向混合后的溶液中加入0.5 mL去离子水,加热至60 ℃大约5 min,至固体完全溶解。再在120 ℃油浴中搅拌加热反应24 h。待反应完全,自然冷却至室温,通过抽滤法收集沉淀,然后用20 mL DMF洗涤沉淀,重复2次;再用20 mL无水乙醇洗涤,重复3次。将洗涤后的产物在80℃下真空干燥12 h,得到UiO-66-NH2。
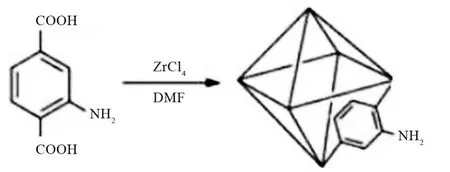
图1 UiO-66-NH2的合成路线
1.3 UiO-66-OHBA的合成
将合成的UiO-66-NH2与3,4-二羟基苯甲醛按照摩尔比为1:2的量加入反应容器,在N2保护、乙醇回流的条件下反应12 h,产物的收集和洗涤以及干燥处理同UiO-66-NH2的合成。
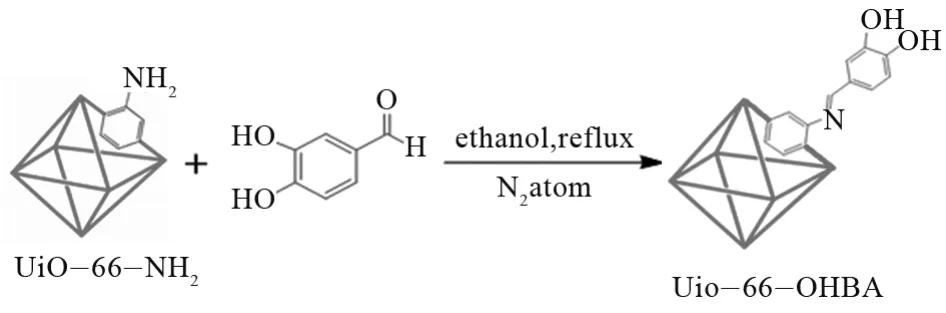
图2 UiO-66-OHBA合成路线图
1.4 U(Vl)的标准曲线
将实验所用浓度为 1.009 1×10-3mol·L-1的 U(VⅠ)标准溶液稀释至1.009 1×10-4mol·L-1,用移液枪准确移取 0.75 mL,1.00 mL,1.45 mL,1.90 mL,·····,4.10 mL等一系列不同体积的 1.009 1×10-4mol·L-1的U(VⅠ)标准溶液于25 mL容量瓶中,依次加入1.0 mL0.5 mol·L-1的 HNO3标准溶液、1.0 mL质量分数为0.1%的偶氮胂Ⅲ溶液,用去离子水定容,摇匀静置显色15~20 min(参比溶液为未加铀酰的容量瓶中的溶液)后在分光光度计中测量溶液在652 nm处的吸光度,并以初始U(VⅠ)离子浓度为横坐标,ABS为纵坐标得出U(VⅠ)离子的标准曲线,如图3所示。该标准曲线在 4.0×10-6~1.15×10-5mol·L-1的范围内线性关系良好(R2=0.999 55),所以对本实验适用。

图3 U(VⅠ)的标准曲线
1.5 实验方法
悬浮液的配制:用分析天平准确称取100 mg样品,加入20 mL去离子水,在电磁搅拌下混合均匀,配制固液比为5 g.L-1的悬浮液。
吸附实验采用分批式操作,具体方法是在10 mL聚乙烯离心管中,按照研究变量的不同依情况加入相应量的悬浮液、U(VⅠ)标准溶液(1.009 1×10-3mol·L-1)、NaNO3标准溶液 (2.0 mol·L-1),再加入去离子水使离心管内液体总量保持在7 mL,再用可忽略体积的NaOH溶液和HNO3溶液将pH调节至指定值。之后把样品置于特定温度的恒温水浴振荡器中进行振荡,至体系达到平衡(研究平衡时间对吸附的影响时对振荡时间有特定的要求,体系不一定平衡)。取出样品后置于高速离心机中以10 000 r.min-1的转速进行离心,离心时间为30 min。之后小心准确移取适量上清液于25 mL的容量瓶中,每个容量瓶中加入1 mL HNO3溶液 (0.5 mol·L-1)和 1 mL 偶氮胂 ⅠⅠⅠ溶液(质量分数0.1%),定容后显色15~20 min,在可见分光光度计中测量吸光度(ABS),再根据U(VⅠ)的标准曲线确定上清液中的U(VⅠ)浓度。
吸附分配比Kd、固相中的吸附质浓度qe以及吸附百分数R的计算公式如表2所示。

表2 不同数值的计算式
式中C0为初始溶液的U(VⅠ)浓度(mol/L),Ce为吸附平衡后U(VⅠ)的浓度(mol/L),V为离心管中液体总体积(L),m为吸附剂的质量(g)。
2 实验结果与讨论
查阅相关文献[15]后可知,氨基官能团对锕系原子来说可以是一种软配体并且对U(VⅠ)有良好的选择吸附效果,本文进行了对UiO-66-NH2的合成,并设想对UiO-66-NH2用3,4-二羟基苯甲醛进行进一步的修饰,并研究修饰前后的UiO-66-NH2对U(VⅠ)的吸附行为,看经修饰的UiO-66-NH2对U(VⅠ)的吸附效果是否有了提升。而要研究他们的吸附行为,则需要先进行UiO-66-NH2及经3,4-二羟基苯甲醛修饰后所得的材料UiO-66-OHBA的合成。
2.1 傅里叶红外光谱(FT-lR)
本实验红外谱图由Nexus-670型傅里叶变换红外光谱仪在4 000~400 cm-1范围内采集所得。测红外时,先用药匙取少量的吸附剂固体试样,然后加入KBr粉末使得样品与KBr的比例约为 1:100,用玛瑙研钵研磨均匀且粒度≤2 μm。将研磨好的固体混合物装入模具,在油压机10 MPa压强作用下压制成片,然后用镊子取出压制成功的样品片,装入样品架扫描测量,得到红外吸收谱图。如图4所示。通过对比红外吸收谱图发现,改性后的UiO-66-NH2的红外吸收谱图相比改性前在1 660 cm-1、1 294 cm-1和1 120 cm-1波数处出现了吸收峰,其中1 660 cm-1处是C=N的伸缩振动吸收峰、1 294 cm-1和1 120 cm-1处是H-O面内弯曲振动的吸收峰,此外,在825 cm-1和796 cm-1处还多出了苯环相邻氢的吸收峰。红外谱图结果说明3,4-二羟基苯甲醛成功地连接到了UiO-66-NH2上。

图4 改性前后吸附剂的红外吸收光谱
2.2 C、H、N元素分析
该分析结果通过Vario cube型元素分析仪所得,将经3,4-二羟基苯甲醛改性前后的UiO-66-NH2试样在氦气和氧气氛围,950 ℃条件灼烧。得到改性前后的UiO-66-NH2样品中C、H、N的含量,如表3所示,通过元素分析得到了改性前后UiO-66-NH2所含碳、氢、氮的含量,算得接枝量为1.070 mmol.g-1。

表3 元素分析结果
2.3 X射线粉末衍射(PXRD)
由X射线粉末衍射图谱可知,改性前后的吸附剂特征衍射峰位置几乎没有变化,仅在强度上有差别,这说明改性前后的UiO-66-NH2结构并没有发生改变。
2.4 不同条件对吸附剂吸附行为的影响
2.4.1 pH值对吸附U(Vl)的影响
据有关实验表明溶液的酸度是吸附剂吸附金属离子的一个重要影响因素,由UO22+的物种分布图可知当pH值不同时UO22+在溶液中的物种形态也会不同。由图6可知pH值对U(VⅠ)的吸附影响显著,因为pH值不仅会影响金属离子的物种形态,也会影响吸附剂的结合位点和表面电荷。

图5 PXRD衍射谱图

图6 不同pH值下UO22+的物种分布图
本实验中所选取的pH范围为1.5~7.0,由图7可知,当pH值小于3.0时,两种吸附剂的吸附率上升都比较缓慢,而当pH值由3.0上升到5.5左右时,吸附率急剧增加直至达到最大值,最后随着pH值的增大吸附率不再变化。可大致做如下解释:当pH较低时,U(VⅠ)主要以 UO22+的形式存在,此时由于质子化作用吸附剂带正电荷,与UO22+发生静电排斥,吸附容量增加缓慢;pH逐渐增大时,吸附剂逐渐去质子化,配体络合物快速生成,吸附率急剧增大;当pH超过5.5后,因OH—的增加,产生了沉淀,吸附率不再升高。此外可以看出两种吸附剂均在pH值为4.5左右时吸附速率达到最大。故后续实验选取最佳吸附pH值为4.50±0.02。改性后得到的UiO-66-OHBA在大pH范围内相比UiO-66-NH2吸附率有所提高,吸附率增加的可能原因是3,4-二羟基苯甲醛(OHBA)中的羟基更适合与U(VⅠ)配位。
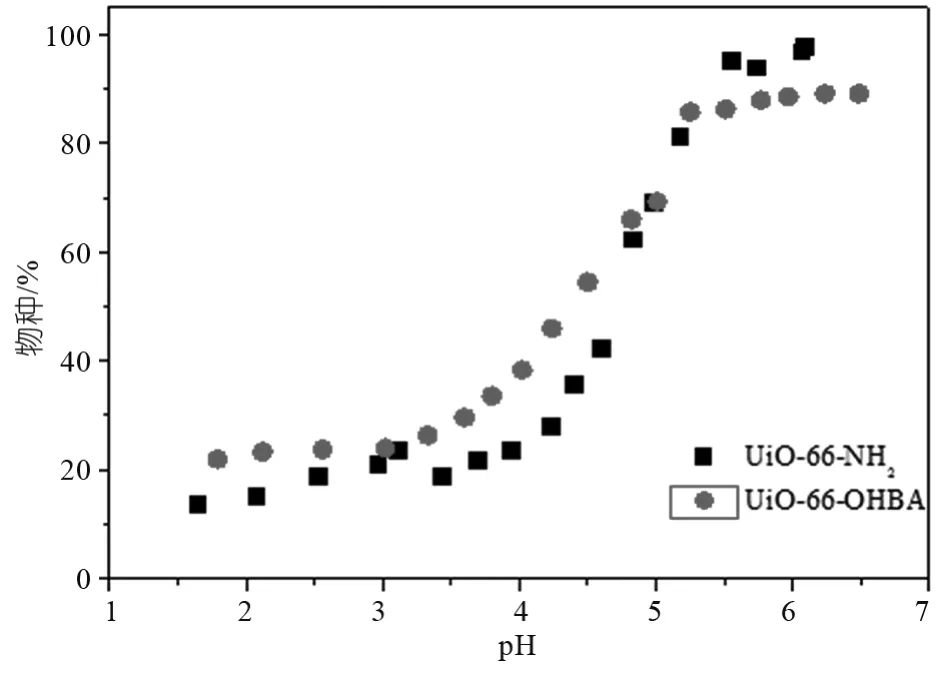
图7 pH值对吸附剂吸附U(VⅠ)的影响
2.4.2 离子强度对吸附U(Vl)的影响
图8展现了离子强度对两种吸附剂吸附行为的影响,由图可以看到当NaNO3浓度由0.01 mol·L-1增加到0.1 mol·L-1时,UiO-66-NH2的吸附率会下降,可能原因是离子强度较低时随着Na+浓度的增大,H+和Na+与U(VⅠ)发生了竞争吸附导致,而当NaNO3浓度大于0.1 mol·L-1时,吸附剂的吸附率基本保持不变,而UiO-66-OHBA的吸附率也几乎没有发生改变,表明离子强度对吸附过程影响不大。此外可以看出,在相同的离子强度下,改性后的材料吸附率有了小幅度的提升。
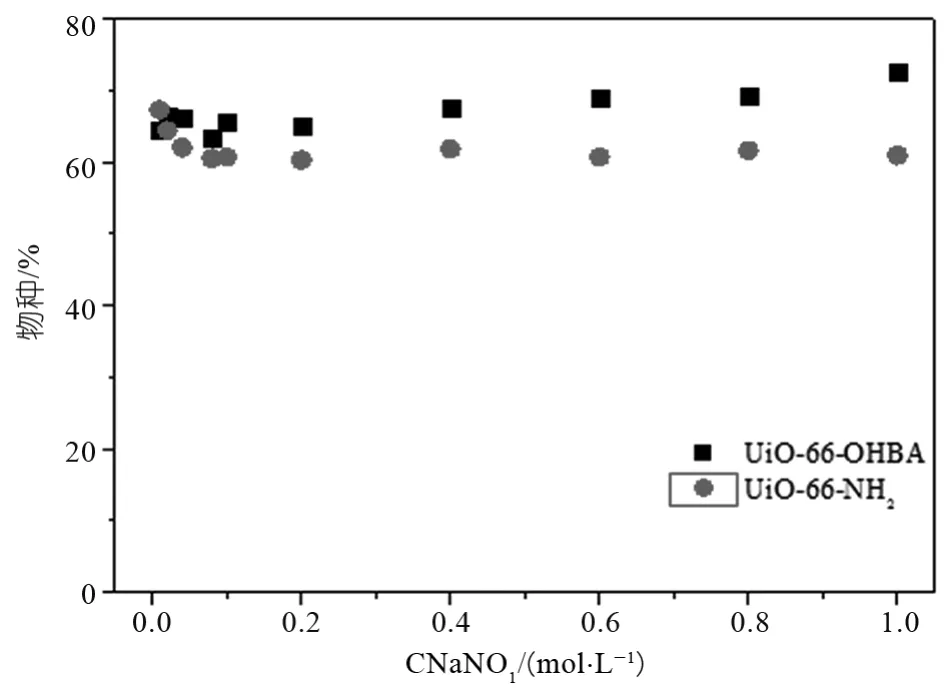
图8 离子强度对吸附的影响
2.4.3 温度对吸附U(Vl)的影响
温度也是对吸附剂吸附行为的一个重要影响因素,我们研究了298 K、318 K以及338 K下U(VⅠ)在两种吸附剂上的吸附等温线,如图9和10所示。
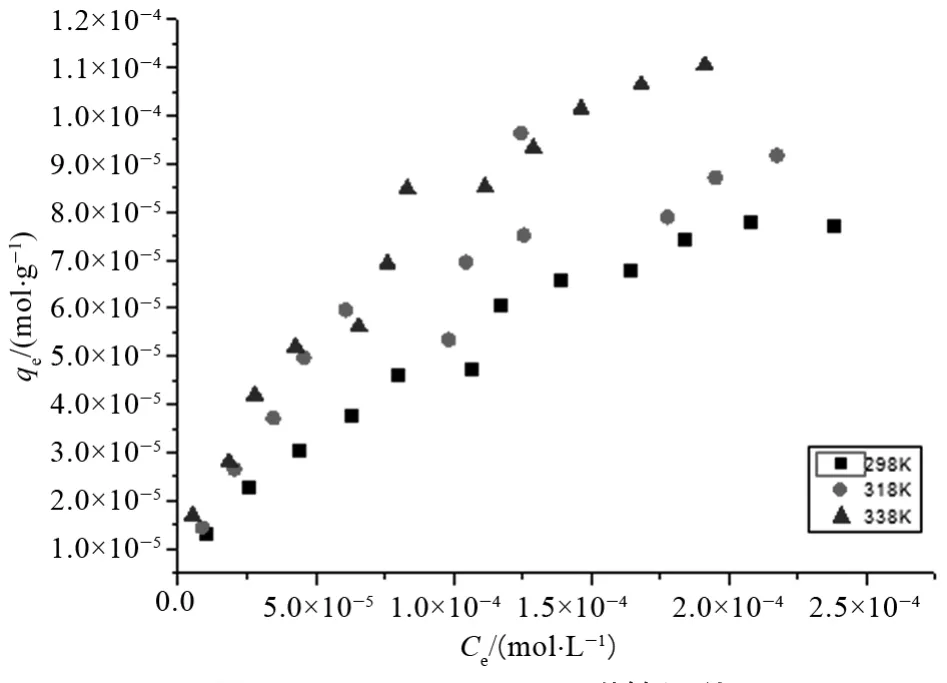
图9 UiO-66-NH2吸附等温线
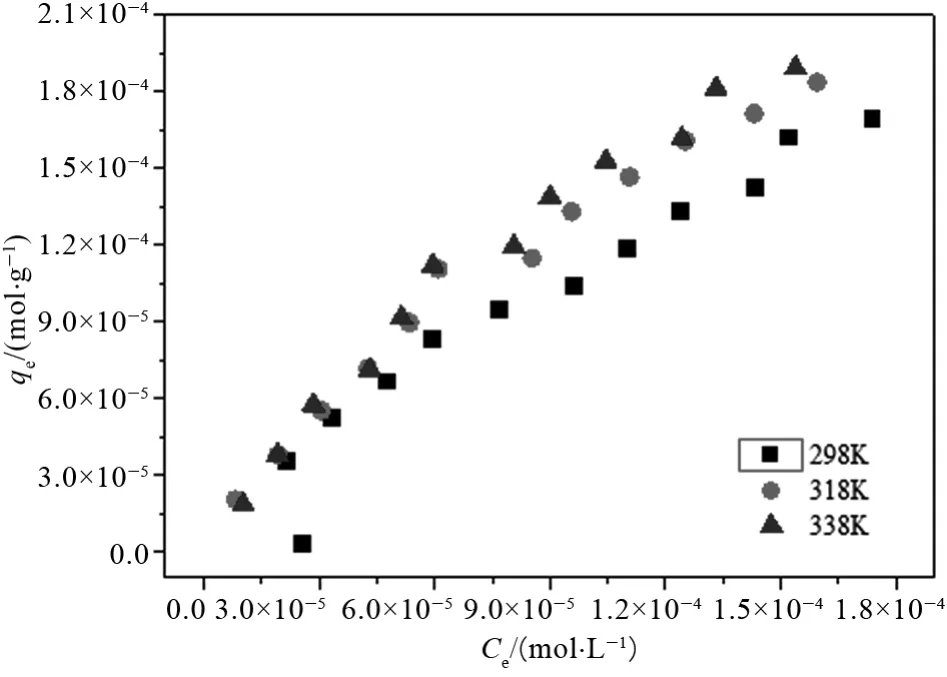
图10 UiO-66-OHBA吸附等温线
观察对比两图可知,随着温度的升高,两种吸附剂对U(VⅠ)的吸附容量都有所上升,这表明温度升高有利于吸附剂对U(VⅠ)的吸附,U(VⅠ)在两种吸附剂上的吸附行为应是一个吸热过程,此外,相同条件下UiO-66-OHBA的吸附容量要高于UiO-66-NH2,但温度对其吸附性能影响并不大。
对实验数据分别用Langmuir吸附等温线和Freundlich吸附等温线进行拟合。其中Langmuir吸附等温线模型公式如下:
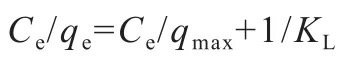

图11 Langmuir吸附等温模型拟合(T=298K)

图12 Freundlich吸附等温模型拟合(T=298K)
式中:Ce(mol·L-1)为平衡时上清液中 U(VⅠ)浓度;qe(mol·g-1)为平衡时的吸附量 ;qmax(mol·g-1)为吸附剂的最大吸附容量;KL(L·g-1)为吸附平衡常数。
Freundlich吸附等温线模型公式如下:

式中:KF(mol1-n.Ln.g-1)为单位平衡浓度的最大吸附容量;n为平衡浓度对吸附行为的进程影响。
拟合模型如图11和12所示。
相关拟合参数如表4所示。
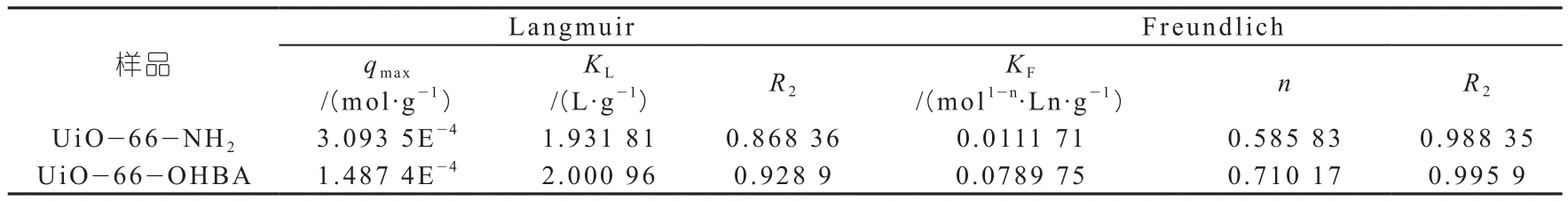
表4 Langmuir和Freundlich等温线模型拟合相关参数
由等温模型拟合的相关参数可以看出,两种吸附剂都更符合Freundlich等温线模型拟合,说明这两种吸附剂对吸U(VⅠ)的吸附很可能是多层吸附。
2.4.4 平衡时间对吸附U(Vl)的影响
图13显示了时间对两种吸附剂吸附U(VⅠ)的影响,由图可以看出,吸附剂的吸附大致可以分为两个阶段,前阶段随着时间的增加吸附剂对U(VⅠ)的吸附百分数逐渐增大,但吸附速率逐渐减小,这是因为前期U(VⅠ)浓度较大,与吸附剂上的官能团接触几率大,随着反应的逐渐进行,U(VⅠ)浓度逐渐较小,可用于于之相结合的官能团数量也减小,百分数的增加逐渐变缓,直至不再增加,吸附达到平衡。由图中还可以看出当反应进行至5 h左右即可达到平衡,UiO-66-OHBA与UiO-66-NH2达到吸附平衡的时间是十分接近的,此外,UiO-66-OHBA的吸附效果要优于UiO-66-NH2。对吸附数据数据进行动,拟合发现它们的吸附不符合假一级动力学模型,但符合假二级动力学模型。

图13 平衡时间对吸附行为的影响

图14 吸附过程的假二级动力学模型
2.4.5 固液比对吸附U(Vl)的影响
固液比在吸附研究中有很重要的作用,它可以衡量在实际应用中的生产价值。本实验中,保持初始U(VⅠ)浓度、溶液pH、离子强度、等其他实验条件不变,在一定范围内改变吸附剂的用量,以此研究固液比对吸附行为的影响。由图可知改性前后的UiO-66-NH2对U(VⅠ)的吸附百分数随着固液比的增大而增大,直至吸附趋近完全,这是由于随着吸附剂用量的增加,溶液中可用于吸附U(VⅠ)的位点也会更多。此外,经修饰后的UiO-66-NH2在同等固液比条件下吸附百分数更大,这可能是因为经改性后的吸附剂具备了更多的吸附位点所致。改性后得到的UiO-66-OHBA吸附性能有所提升。
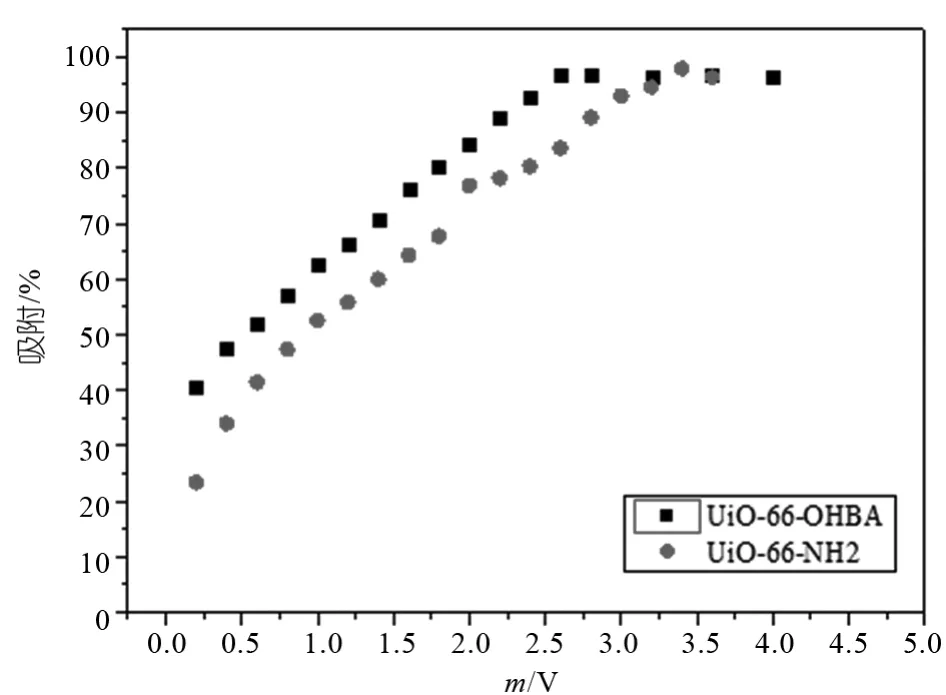
图15 固液比对吸附的影响
3 结论
本文进行了MOFs材料UiO-66-NH2的合成,并利用3,4-二羟基苯甲醛对其进行改性,得到了UiO-66-OHBA,然后研究了这两种材料对U(VⅠ)的吸附行为。由改性前后的UiO-66-NH2红外光谱、元素分析以及X射线粉末衍射结果可知,改性后的UiO-66-NH2成功地与3,4-二羟基苯甲醛相结合,说明改性是成功的,得到了UiO-66-OHBA,改性前后的UiO-66-NH2结构并未发生改变。
研究UiO-66-NH2以及UiO-66-OHBA对U(VⅠ)的吸附行为,发现相同条件下改性后得到的UiO-66-OHBA吸附性能相比改性前有了一定的提升。此外,溶液的pH值对吸附剂的吸附性能影响较大,且吸附过程均符合假二级动力学模型,两者对U(VⅠ)的吸附能力均随着溶液pH增加而增加。离子强度的变化对两种吸附剂的吸附性能干扰很小。两种吸附剂对U(VⅠ)的吸附性能也受温度影响,随着温度的升高两种吸附剂吸附容量均有所上升,但UiO-66-OHBA随温度的变化吸附容量的提升幅度并没有UiO-66-NH2来得明显,此外UiO-66-OHBA的饱和吸附容量比UiO-66-NH2小,这可能是改性之后空间位阻增大所导致的,通过等温线模型拟合发现两种吸附剂的吸附行为均符合Freundlich等温线模型。
MOFs具有诸多优点,也有很大的发展前景,今后的研究重点可以放在寻找寻找结构更稳定的MOFs材料作为基体,对其进行功能化修饰,提高其吸附分离的选择性方面,此外修饰后材料的吸附机理也值得研究。
