番茄果实类胡萝卜素组成含量与色泽相关性分析
2021-01-29王丹,张建,王晓蕊,张连富,魏哲文,熊素玉
王丹,张建,王晓蕊,张连富,魏哲文,熊素玉





摘要:類胡萝卜素是番茄呈现不同色泽的物质基础,系统研究番茄色泽与类胡萝卜素种类、含量的相关性可以为筛选特定类胡萝卜素成分如六氢番茄红素、八氢番茄红素和顺式番茄红素等提供指导。利用高效液相色谱-二极管阵列检测系统(HPLC-PDA)和色度仪对12个不同品种番茄在不同成熟期的类胡萝卜素组成和颜色特征值进行分析。结果表明,红色系番茄主要积累番茄红素,最高鲜质量含量达到(123.50±1.34) μg/g;黄色系番茄、绿色系番茄主要积累β-胡萝卜素,最高鲜质量含量达到(7.56±0.02) μg/g。黄色系番茄中橙色番茄有较高鲜质量含量的八氢番茄红素、六氢番茄红素,分别达到(59.72±0.84) μg/g、(23.24±0.31) μg/g,且番茄红素中顺式番茄红素占比达到77.44%,远远高于其他颜色的番茄品种。在所有供试番茄品种中,八氢番茄红素、六氢番茄红素、番茄红素含量在果实发育过程中整体上随着番茄果实成熟度的增加而增加,β-胡萝卜素因番茄品种的不同在果实发育过程中呈现出不同的变化趋势。在番茄果实中,番茄红素含量与红度(a*)和a*/b*呈极显著正相关,与亮度(L*)、黄度(b*)和色度角(H)呈极显著负相关,β-胡萝卜素含量与亮度(L*)和H呈极显著负相关,与b*无显著相关性,这2种主要类胡萝卜素含量与色彩饱和度(C)均无显著相关性。
关键词:番茄;八氢番茄红素;六氢番茄红素;顺式番茄红素;颜色特征值
中图分类号:S641.201文献标识码:A文章编号:1000-4440(2021)06-1554-11
Correlation analysis between tomato color with carotenoid constitutes and content
WANG Dan1,ZHANG Jian1,WANG Xiao-rui1,ZHANG Lian-fu2,WEI Zhe-wen3,XIONG Su-yu4
(1.College of Food Science and Technology, Shihezi University, Shihezi 832003, China;2.School of Food Science and Technology, Jiangnan University, Wuxi 214122, China;3.Shihezi Customs of the People′s Republic of China, Shihezi 832099, China;4.Institute for Drug Control of Changji Hui Autonomous Prefecture, Changji 831100, China)
Abstract:Carotenoids are the material basis for different colors of tomatoes. Systematic study on the relationship between tomato color with carotenoid constitutes and content can provide guidance for screening specific carotene components such as phytofluene, phytoene and cis-lycopene. The carotenoid composition and color characteristics of twelve different tomato varieties at different maturity stages were analyzed by high performance liquid chromatography-photo diode array detection (HPLC-PDA) and colorimeter. The results showed that the main carotenoid in red series of tomatoes was lycopene, the highest content was (123.50±1.34) μg/g, the main carotenoid in the yellow and green series of tomatoes was β-carotene, the highest content was (7.56±0.02) μg/g. The content of phytoene and phytofluene in orange tomato was (59.72±0.84) μg/g and (23.24±0.31) μg/g, respectively. The proportion of cis-lycopene in orange tomato was 77.44%, which was much higher than that in other tomato varieties. Among all tested varieties, the contents of phytoene, phytofluene and lycopene increased with the increase of tomato fruit maturity, β-carotene showed different trends during fruit ripening in coloured-tomatoes. Lycopene content in tomato fruits was significantly positively correlated with redness (a*) and a*/b*, and negatively correlated with brightness (L*), yellowness (b*) and chromaticity angle (H), β-carotene content was negatively correlated with brightness (L*) and chromaticity angle (H), but had no significant correlation with yellowness (b*). There was no significant correlation between the contents of these two main carotenoids and color saturation (C).
Key words:tomato;phytoene;phytofluene;cis-lycopene;color characteristic value
番茄为茄科茄属草本植物,是世界范围内重要的蔬菜作物之一,中国是其主要产地,2016年的产量为5.640×107 t,占世界总产量的1/3[1]。番茄中含有类胡萝卜素、酚类化合物、维生素C和生育酚等营养物质[2],其中类胡萝卜素通常呈现黄、橙、红等颜色,它们赋予番茄果实鲜艳的色彩,被称为呈色类胡萝卜素,主要包括番茄红素、β-胡萝卜素等[3-4],这些化合物的含量因成熟阶段、种植环境或其他因素的作用而有显著的不同[5]。同时,番茄中也含有一类呈色类胡萝卜素的前体物质,它们本身不呈现肉眼可见的色彩,被称为无色类胡萝卜素,主要包括八氢番茄红素与六氢番茄红素[6]。Li等[7]研究发现,类胡萝卜素能改善人的认知功能和心血管功能、减少氧化损伤并可能有助于预防某些癌症,如前列腺癌、肺癌、乳腺癌、皮肤癌等,还能预防动脉粥样硬化等。
番茄果实呈色的物质基础是其中所含类胡萝卜素的种类及含量[8]。目前,生产上倾向于优选红色番茄,因为在通常情况下,红色番茄的颜色越深,其中的番茄红素,尤其是全反式番茄红素的含量就越高。番茄的红色成分是广受关注的类胡萝卜素组分[9-12],但是近年来,番茄红素以外的其他类胡萝卜素组分以其独特的生理功能而广受关注,如顺式构型番茄红素(Cis-lycopene),为黄至橙色,比普通番茄中呈现红紫色的全反式番茄红素更易被人体吸收[13-16];在可见光区没有吸收峰(本身不呈现颜色)的六氢番茄红素、八氢番茄红素可有效保护皮肤免受紫外线伤害,有优异的美白作用,商业价值非常高[17-20]。企业在筛选天然含有高含量顺式构型番茄红素或天然含有高含量六氢番茄红素及八氢番茄红素的番茄原料时,缺乏番茄色泽与类胡萝卜素组分相关性的基础信息。为此,本研究以12个不同品种、不同颜色的番茄果实为原料,采用高效液相色谱(HPLC)法分析番茄果实在成熟过程中的类胡萝卜素含量及其变化规律,探究番茄中2种主要呈色类胡萝卜素组分含量与颜色特征值的相关性,以期为番茄优质品种选育及质量评价提供理论依据和技术参考。
1材料与方法
1.1材料与试剂
从主产地新疆挑选12个番茄品种在实验基地进行种植,不同品种番茄的名称及特性见表1。全反式番茄红素标准品(纯度≥95%),购自上海纯优生物科技有限公司;全反式β-胡萝卜素标准品(纯度≥96%),购自上海阿拉丁生化科技股份有限公司;正己烷、丙酮、甲醇均为分析纯,购自国药集团化学试剂有限公司;甲醇、甲基叔丁基醚(MTBE)为色谱纯,购自上海阿拉丁生化科技股份有限公司。
1.2仪器与设备
Wates e2695高效液相色谱仪(配有2998二极管阵列检测器和Epower3色谱工作站),产自美国Waters 公司;YMC Carotenoids C30色谱柱(4.6 mm×250.0 mm,5 μm),产自日本YMC株式会社;R-300型旋转蒸发仪,产自瑞士歩琪公司;HJ-6A多头磁力加热搅拌器,产自常州鼎丰仪器制造有限公司;CM-5型台式分光测色仪,产自日本柯尼卡美能達有限公司。
1.3试验方法
1.3.1材料的选择12种供试番茄品种于2019年3月上旬播种,于2019年5月上旬定植于石河子大学农学院实验站大田中,参试品种均为无限生长型,管理方法同大田栽培模式。分5个时期取样:绿熟期(M1),绿色,坚实,不宜食用;显色期(M2),果实顶端转色面积占全果面积的10%;转色期(M3),果实表面转色面积占全果面积的50%;半熟期(M4),果实转色面积占全果面积的75%;成熟期(M5),果实呈现各参试品种特有的色泽。
1.3.2类胡萝卜素的提取番茄中类胡萝卜素的提取参考Jazaeri等[21-22]的方法,并作少许改变。取大小相仿的新鲜番茄若干,带皮切成小块后,用打浆机打成番茄匀浆。取5 g番茄匀浆于锥形瓶中,用锡纸包裹避光,加入20 ml正己烷-甲醇-丙酮混合溶剂(体积比为2∶1∶1),在磁力搅拌器上搅拌30 min,将样品过滤后收集滤液,将残渣再提取2次至残渣为无色。收集3次过滤所得滤液,用分液漏斗分离有机相和水相,收集上层有机相并转移至圆底烧瓶中,在35 ℃、150 MPa条件下旋转蒸发溶剂后,用甲基叔丁基醚-甲醇溶剂(体积比为1∶1)溶解后用于HPLC分析。
1.3.3类胡萝卜素的高效液相色谱-二极管阵列检测系统(HPLC-PDA)分析HPLC分析参照Cooperstone等[23]的方法,并作少许改变。流动相A为甲醇-MTBE-水-2%醋酸铵水溶液(体积比为88∶5∶5∶2),流动相B为甲醇-MTBE-2%醋酸铵水溶液(体积比为78∶20∶2),采用线性梯度洗脱,流动相B的含量在20 min内由45%增加至50%,再在8 min内由50%增加到95%并维持4 min,随后在2 min内增加到100%并维持3 min,最后在3 min内减少到初始含量,检测波长为471 nm、452 nm、348 nm、286 nm,流速为1 ml/min,进样量为20 μl,采用C30色谱柱(4.6 mm×250.0 mm,5 μm),柱温为25 ℃,PDA的光谱收集范围为200~600 nm。
1.3.4番茄果实颜色特征值的测定选择大小和色泽比较均匀一致的6个番茄果实, 沿果1周均匀取3个点, 用色度仪测定亮度(L*)、红度(a*)和黄度(b*),根据公式(1)、公式(2)计算色彩饱和度(C)和色度角(H)[24]。C越大,表明颜色的鲜艳度越高;H是0°~360°之间的颜色角,0°~90°包含红色、橙色和黄色,90°~180°包含黄色、黄绿色和绿色,180°~270°包含绿色、青色和蓝色,270°~360°包含蓝色、紫色、洋红色和红色[25-26]。
C=(a*)2+(b*)2(1)
H=tan-1(b*/a*),a*>0,b*>0
H=180°+tan-1(b*/a*),a* <0(2)
1.4统计分析
以上试验至少重复3次,结果用平均值±标准差表示。用IBM SPSS 16软件进行数据分析,显著性采用单变量方差分析和多元线性相关分析进行统计,同组数据中标有不同小写字母表示有显著差异(P<0.05)。
2结果与分析
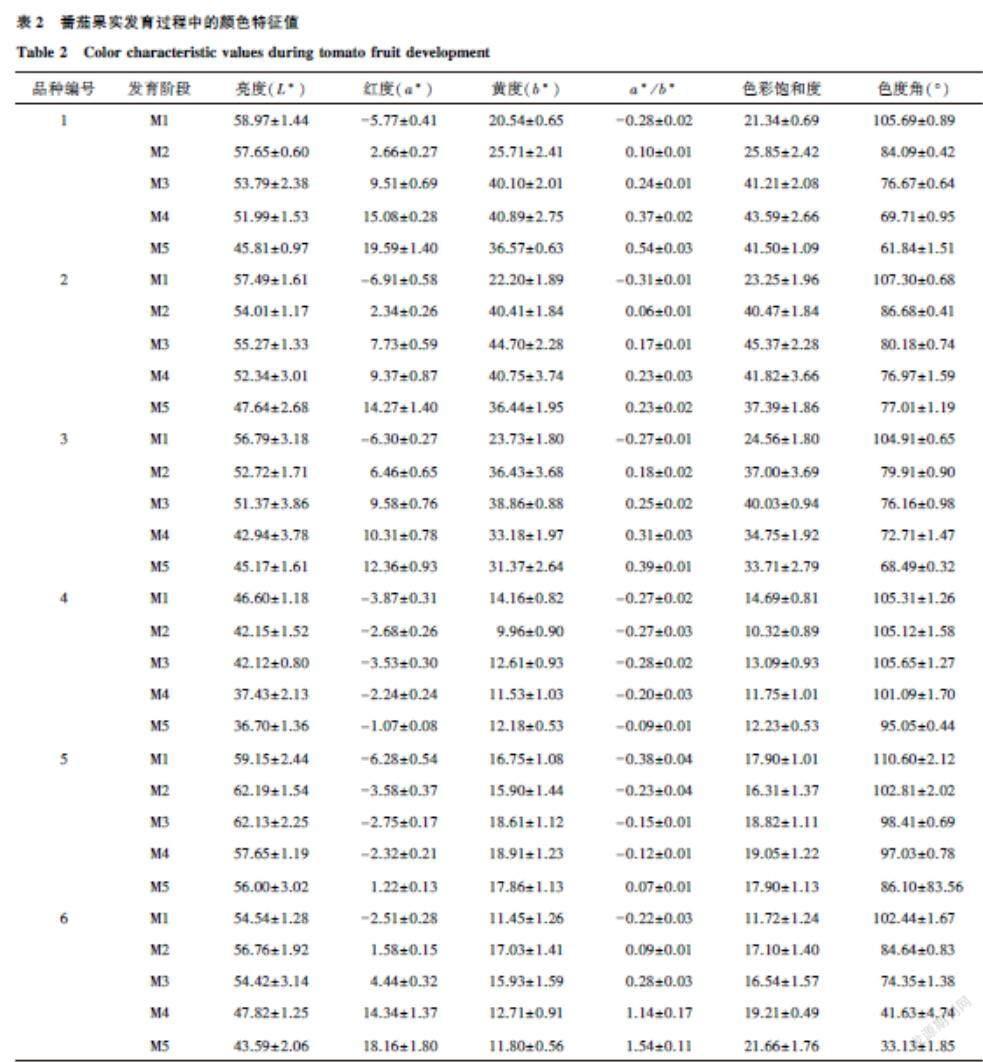
2.1番茄果实发育过程中颜色特征值
果实颜色是果实品质中最重要也是最复杂的属性之一,由于不同品种的番茄具有不同的类胡萝卜素色素系统,导致其外观颜色不同[8]。如表2所示,在M5阶段,红色系番茄品种L*的范围为34.60±3.24~43.59±2.06,a*的范围为12.13±1.05~23.19±1.21,b*的范围为8.57±1.02~18.74±1.34,这与已有的报道[27]相近,b*的差异相对较大,可能因为编号为11、12的番茄与典型的红色番茄不同,它们分别呈现紫红色、黑红色,在这些颜色较深的品种中,造成这一特性的原因可能是叶绿素的保留和番茄红素的积累[28],甚至是类胡萝卜素、花青素的积累[29],导致其b*降低。随着番茄成熟度的增加,红色系番茄的L*整体呈下降趋势,a*的变化最明显,呈上升的趋势,在M1阶段a*为负值,从M2阶段开始部分品种的a*变为正值。在果实未完全成熟前,ζ-胡萝卜素(浅黄色)含量达到最高,导致b*在成熟前的浅红阶段达到最高值,在果实完全成熟时,番茄红素(红色)和β-胡萝卜素(橙色)含量最高,在番茄整个成熟过程中,叶绿素的降解及番茄红素和其他类胡萝卜素的合成导致红色系番茄果实呈现最终的深红色[8]。绿色系番茄的颜色没有明显变化,几乎不含番茄红素,与a*为负值在本质上相符。黄色系番茄在M5阶段的L*、b*均最高,分别为45.17±1.61~47.64±2.68、31.37±2.64~36.57±0.63,L*越高,表明亮度越好,b*越高,表明颜色越黄,这与其外观相符。与其他颜色的番茄(绿色番茄除外)相比,编号为2、3的番茄在M5阶段的a*/b*较低,分别为0.23±0.02和0.39±0.01,Georgé等[30]认为,这可能与黄色番茄中番茄红素的缺失有关,含有较高番茄红素含量的番茄(编号12)中的a*/b*较高,为1.57±0.19,含有较低番茄红素含量的番茄(编号3)中的a*/b*较低,为0.39±0.01。C代表色彩饱和度,C越大则表明颜色的鲜艳度越高[31],在所有参试番茄品种中,以橙色番茄的成熟期果实色泽最好。与红色系番茄相比,黄色系番茄、绿色系番茄在M5阶段有较高的色度角,为61.84±1.51~95.05±0.44,这也证实其不含红色成分。此外,如表3所示,在M5阶段,红色系番茄中β-胡萝卜素的鲜质量含量较高,为(14.51±0.13)~(28.58±0.13) μg/g,黄色系番茄中β-胡萝卜素的鲜质量含量相对较低,为(7.07±0.16)~(7.56±0.02) μg/g。
2.2不同颜色番茄类胡萝卜素成分鉴定
如圖1~图4所示,八氢番茄红素、六氢番茄红素、β-胡萝卜素、番茄红素分别在286 nm、348 nm、452 nm、471 nm处有独特的吸收光谱,类胡萝卜素全反式异构体主要通过与相应标准品的保留时间和紫外吸收光谱进行对比来鉴别,由于八氢番茄红素、六氢番茄红素和顺式异构体没有标准品,因此主要基于文献报道中各类胡萝卜素及异构体的特征吸收光谱和Q值(Q=A顺式峰/A最大吸收峰)进行鉴别[32-34]。外标法用于定量全反式番茄红素和全反式β-胡萝卜素,此外,顺式番茄红素、顺式β-胡萝卜素也可用全反式异构体的标准曲线定量[7],但应指出的是,顺式异构体的摩尔吸光系数较全反式异构体小,因此所得结果比实际结果偏小。八氢番茄红素和六氢番茄红素参照Cooperstone等[23]的方法进行定量。
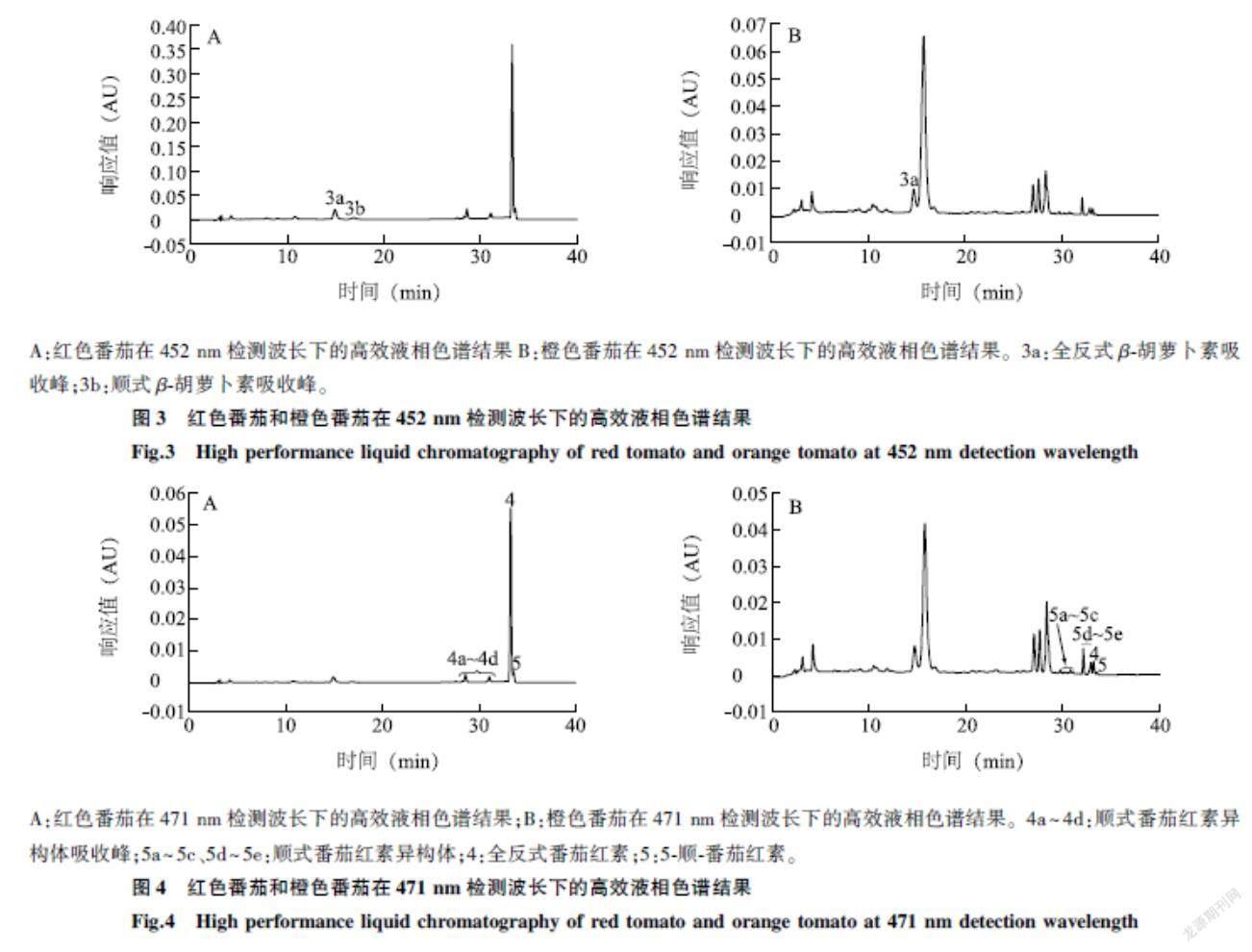
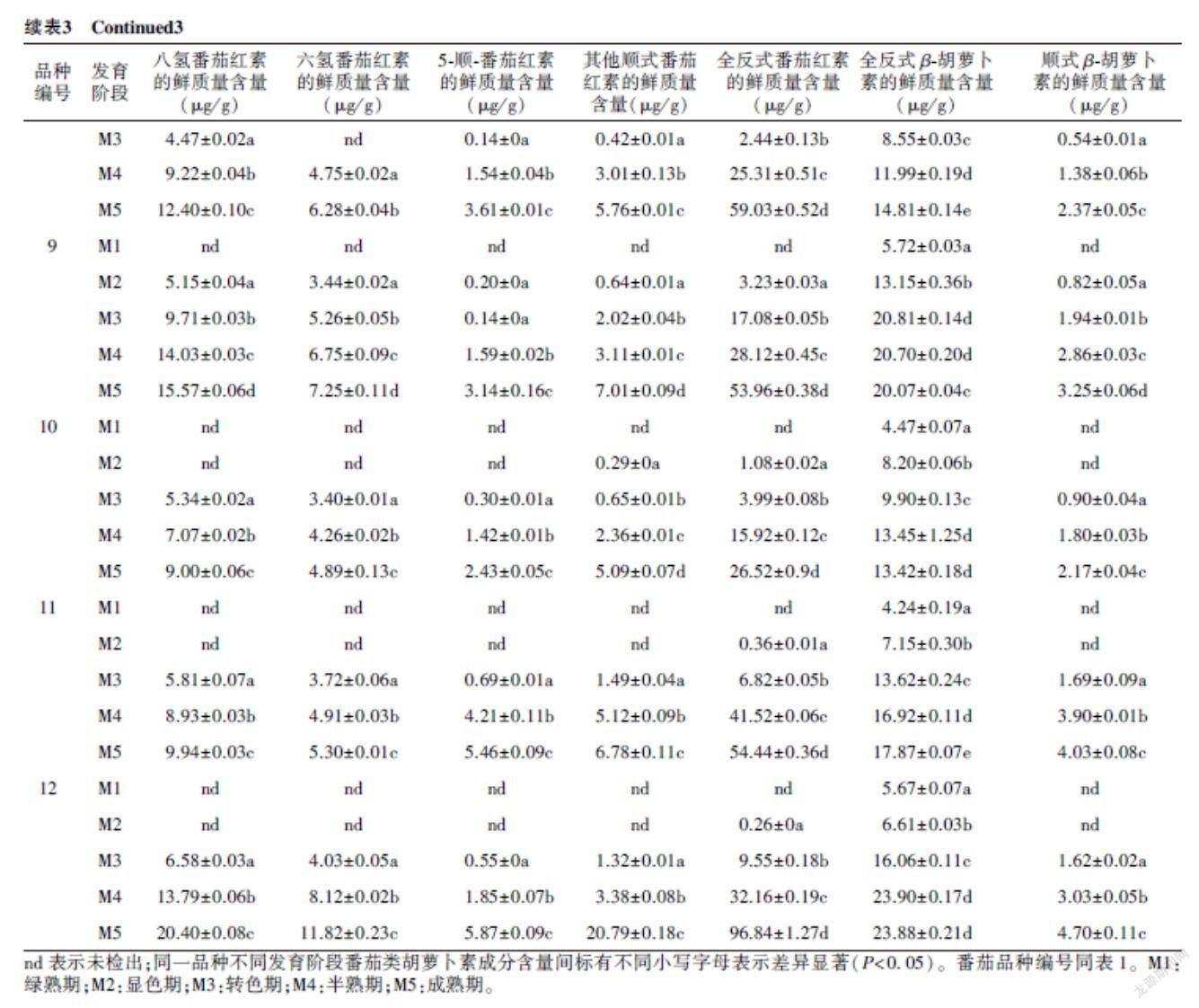
图1~图4中的a图和b图分别为红色番茄和橙色番茄在286 nm、348 nm、452 nm、471 nm检测波长下的高效液相色谱结果,可以看出,在红色、橙色番茄中均检测到了八氢番茄红素、六氢番茄红素、β-胡萝卜素和番茄红素(包括全反式番茄红素、顺式番茄红素异构体),但2种颜色番茄的高效液相色谱图有明显不同,说明其类胡萝卜素含量及组成有明显差异。在同一检测波长下,橙色番茄中八氢番茄红素、六氢番茄红素的峰面积明显大于红色番茄,全反式番茄红素的峰面积明显小于红色番茄,但橙色番茄顺式番茄红素峰面积占番茄红素(包括全反式番茄红素、顺式番茄红素异构体)总峰面积的77.44%,远远大于红色番茄的13.72%。上述数据表明,与红色番茄相比,橙色番茄拥有较高含量的八氢番茄红素、六氢番茄红素,同时其顺式番茄红素异构体占比也远远大于红色番茄。
A:红色番茄在286 nm检测波长下的高效液相色谱结果;B:橙色番茄在286 nm检测波长下的高效液相色谱结果。1a、1b、1:八氢番茄红素吸收峰。
A:红色番茄在348 nm检测波长下的高效液相色谱结果;B:橙色番茄在348 nm检测波长下的高效液相色谱结果。2a、2b、2c:六氢番茄红素吸收峰。
A:红色番茄在452 nm检测波长下的高效液相色谱结果B:橙色番茄在452 nm检测波长下的高效液相色谱结果。3a:全反式β-胡萝卜素吸收峰;3b:顺式β-胡萝卜素吸收峰。
A:红色番茄在471 nm检测波长下的高效液相色谱结果;B:橙色番茄在471 nm检测波长下的高效液相色谱结果。4a~4d:顺式番茄红素异构体吸收峰;5a~5c、5d~5e:顺式番茄红素异构体;4:全反式番茄红素;5:5-顺-番茄红素。
2.3番茄果实发育成熟过程中类胡萝卜素成分的比较
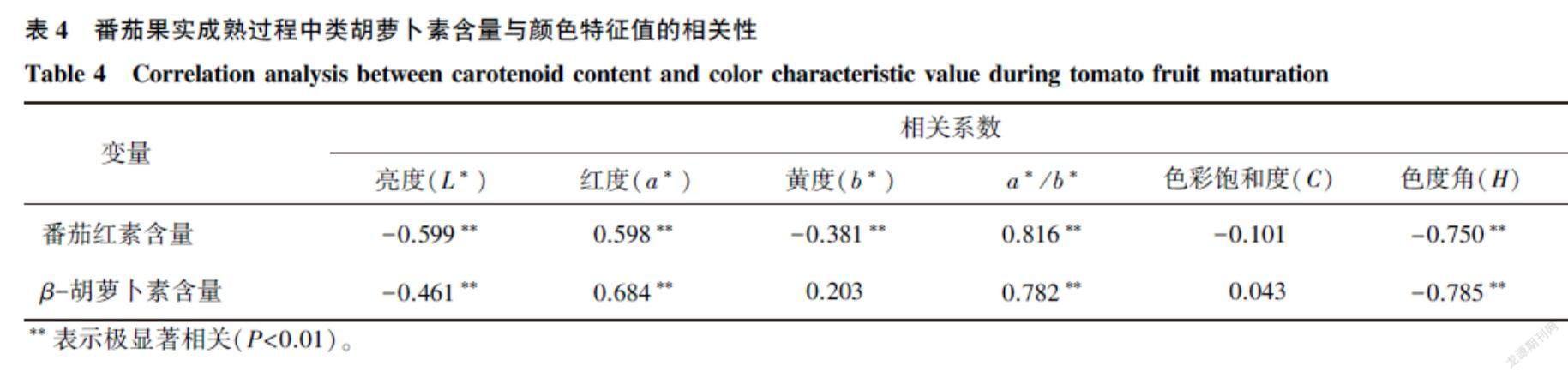
如表3所示,不同顏色番茄果实中的类胡萝卜素组成及含量差异显著,红色系番茄主要积累番茄红素,大部分番茄品种的番茄红素含量从M2阶段开始显著增加,在M5阶段达到最高值,这与Li等[7,35-36]的研究结果一致。与几个典型的红色番茄不同,编号为12的番茄有明显的黑红色表皮,可能由于其在合成番茄红素的过程中同时保留了叶绿素[10],同时其含有比普通红色番茄更高的番茄红素和β-胡萝卜素鲜质量含量[在M5阶段分别为(123.50±1.34) μg/g、(28.58±0.13) μg/g]。编号为10的番茄中番茄红素的鲜质量含量最低,在M5阶段为(34.04±1.02) μg/g,在M5阶段其余红色系番茄中番茄红素的鲜质量含量为(42.38±0.12)~(95.83±1.10) μg/g,在番茄红素鲜质量含量中,顺式番茄红素的鲜质量含量占比为12.2%~22.1%,全反式番茄红素的鲜质量占比为78.9%~88.8%。整体上看,2种重要的类胡萝卜素八氢番茄红素和六氢番茄红素的鲜质量含量从M2阶段开始显著增加,在M5阶段达到最高值,且八氢番茄红素的鲜质量含量高于六氢番茄红素,在红色系番茄中,二者最高值分别达到(20.66±0.10) μg/g、(11.82±0.23) μg/g。在红色系番茄中,M1阶段积累的类胡萝卜素主要是β-胡萝卜素,八氢番茄红素、六氢番茄红素在此阶段未检测到。从M1到M5阶段可以看出,各番茄品种的β-胡萝卜素都呈现出稳步上升的趋势,这些结果与Meléndez-Martínez等[37]的研究结果一致。
与红色系番茄相比,黄色系番茄中的橙色番茄中含有较少的番茄红素,但其顺式异构体占比达到了77.44%。此外,橙色番茄中还有较高鲜质量含量的八氢番茄红素和六氢番茄红素,从M1阶段开始,随着成熟度的增加,二者的鲜质量含量显著增加,在M5阶段达到最高值,分别为(59.72±0.84) μg/g和(23.24±0.31) μg/g,分别是红色系番茄的2.89~6.59倍和1.97~4.75倍,这与已有研究报道的橙色番茄汁中无色类胡萝卜素含量显著高于红色番茄汁的结果相符[15]。绿色系番茄和黄色系番茄主要积累β-胡萝卜素,其中主要是全反式β-胡萝卜素,不同品种番茄果实在发育过程中β-胡萝卜素的鲜质量含量变化不一致[37],成熟期的鲜质量含量为(3.82±0.05)~(7.56±0.02) μg/g。在绿色系番茄和黄色系番茄中没有检测到八氢番茄红素和六氢番茄红素,这与Coyago-Cruz等[38]的测定结果一致。基于红色系番茄以外品种中类胡萝卜素的水平可以推测,在物种内部和物种之间对类胡萝卜素生物合成的调控确实存在重要差异,在绿色系番茄中没有检测到红色系番茄的典型类胡萝卜素成分,可能由于其关键类胡萝卜素基因的低表达[37],或是果实成熟过程中软化或乙烯合成等其他因素[39-40]。关于乙烯在番茄成熟过程中的作用,有研究认为可能是由于激素协调了果实中高转录物质的积累,因此1个乙烯受体的简单突变会影响300多个基因的表达,更确切地说,乙烯参与了好几种类胡萝卜素的生物合成过程[41]。Dias等[42]认为,在很多水果中观察到类胡萝卜素明显的定性和定量差异是由于受到成熟度、气候和遗传等多种因素的影响。
2.4番茄果实成熟过程中类胡萝卜素含量与颜色特征值的相关性分析
如表4所示,在不同品种番茄果实成熟过程中,番茄红素含量与L*、b*呈极显著负相关,即当番茄果实中的番茄红素含量越高时,其亮度越低,黄度越低;番茄红素含量与a*、a*/b*呈极显著正相关,即在番茄果实成熟过程中,番茄红素含量越高,红度越高,a*/b*越大;β-胡萝卜素含量与L*呈极显著负相关,即当番茄果实中β-胡萝卜素含量越高时,其亮度越低,β-胡萝卜素含量与b*没有显著相关性;番茄红素和β-胡萝卜素含量与色度角(H)呈极显著负相关,即番茄果实中的番茄红素、β-胡萝卜素含量越高,色度角越小;番茄红素和β-胡萝卜素含量与色彩饱和度(C)均无显著相关性。
3结论
不同品种番茄的类胡萝卜素含量差异显著,同色系番茄品种中类胡萝卜素的组成相似。在番茄果实成熟过程中,八氢番茄红素、六氢番茄红素、番茄红素含量均随着果实成熟度的增加而增加,β-胡萝卜素含量因番茄品种不同而在果实发育过程中呈现出不同的变化趋势。在所有供试品种中,编号为1的番茄(大黄)中八氢番茄红素、六氢番茄红素含量及其顺式番茄红素占比均远远高于其他番茄品种,可作为获取八氢番茄红素、六氢番茄红素和顺式番茄红素等特殊类胡萝卜素成分的良好原料。番茄果实中番茄红素含量与a*、a*/b*呈极显著正相关,与L*、b*、H呈极显著负相关,β-胡萝卜素含量与L*、H呈极显著负相关,与b*无显著相关性,2种主要类胡萝卜素含量与C均无显著相关性。这些研究结果对今后评价不同颜色番茄中的类胡萝卜素组成、含量和综合利用不同颜色番茄原料生产高附加值番茄制品具有重要指导意义。
参考文献:
[1]LU Z Q, WANG J J, GAO R P, et al. Sustainable valorisation of tomato pomace: a comprehensive review[J]. Trends in Food Science & Technology, 2019, 86: 172-187.
[2]COYAGO-CRUZ E, CORELL M, MORIANA A, et al. Effect of the fruit position on the cluster on fruit quality, carotenoids, phenolics and sugars in cherry tomatoes (Solanum lycopersicum L.)[J]. Food Res Int, 2017, 100(1): 804-813.
[3]NISAR N, LI L, LU S, et al. Carotenoid metabolism in plants[J]. Molecular Plant, 2015, 8(1): 68-82.
[4]LEWINSOHN E, SITRIT Y, BAR E, et al. Not just colors-carotenoid degradation as a link between pigmentation and aroma in tomato and watermelon fruit[J]. Trends in Food Science & Technology, 2005, 16(9): 407-415.
[5]VIOLETA N, IONICA M E, TRANDAFIR I. Bioactive compounds, antioxidant activity and color of hydroponic tomato fruits at different stages of ripening[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2015, 43(2): 404-412.
[6]MELéNDEZ-MARTNEZ A J, MAPELLI-BRAHM P, STINCO C M. The colourless carotenoids phytoene and phytofluene: from dietary sources to their usefulness for the functional foods and nutricosmetics industries[J]. Journal of Food Composition and Analysis, 2018, 67: 91-103.
[7]LI H Y, DENG Z Y, LIU R H, et al. Carotenoid compositions of coloured tomato cultivars and contribution to antioxidant activities and protection against H2O2-induced cell death in H9c2[J]. Food Chemistry, 2013, 136(2): 878-888.
[8]RAWAL R, GAUTAM D M, KHADKA R B, et al. Fruit quality characters of tomato (Solanum lycopersicum) genotypes differed by maturity stages[C]//AVRDC-VEGETABLE POST-HRVEST POJECT. The 5th international conference on agriculture, environment and biological sciences (ICAEBS-16). Pattaya,Thailand: AVRDC-Vegetable Post-Hrvest Poject, 2016.
[9]FERNNDEZ-RUIZ V, TORRECILLA J S, CMARA M, et al. Radial basis network analysis of color parameters to estimate lycopene content on tomato fruits[J]. Talanta, 2010, 83(1):9-13.
[10]PARK M H, SANGWANANGKUL P, BAEK D R. Changes in carotenoid and chlorophyll content of black tomatoes (Lycopersicone sculentum L.) during storage at various temperatures[J]. Saudi Journal of Biological Sciences, 2018, 25(1): 57-65.
[11]吳学平,刘日华,应允祥. ‘黑妃’小番茄引种及山地高效栽培关键技术浅析[J]. 农学学报, 2013, 3(12): 42-44.
[12]李凯,谭丹. 新疆番茄产业国际竞争力分析[J]. 现代商业, 2018(35): 65-68.
[13]利慧华,叶成,李莉莉,等. 番茄红素的顺反异构化及生物利用率研究进展[J]. 食品研究与开发, 2015, 36(18): 188-191.
[14]陈伟,丁霄霖. 番茄红素化学和生物学特性[J]. 粮食与油脂, 2002(7): 47-49.
[15]COOPERSTONE J L, RALSTON R A, RIEDL K M, et al. Enhanced bioavailability of lycopene when consumed as cis-isomers from tangerine compared to red tomato juice, a randomized, cross-over clinical trial[J]. Molecular Nutrition & Food Research, 2015, 59(4): 658-669.
[16]YANG C, LIU H X, SUN Q R, et al. Enriched Z-isomers of lycopene-loaded nanostructured lipid carriers: physicochemical characterization and in vitro bioaccessibility assessment using a diffusion model[J]. LWT-Food Science and Technology, 2019, 111(1): 767-773.
[17]MELNDEZ-MARTNEZ A J, MAPELLI-BRAHM P, BENTEZ-GONZLEZ A, et al. A comprehensive review on the colorless carotenoids phytoene and phytofluene[J]. Archives of Biochemistry and Biophysics, 2015, 572: 188-200.
[18]STINCO C M, HEREDIA F J, VICARIO I M, et al. In vitro antioxidant capacity of tomato products: relationships with their lycopene, phytoene, phytofluene and alpha-tocopherol contents, evaluation of interactions and correlation with reflectance measurements[J]. LWT-Food Science and Technology, 2016, 65: 718-724.
[19]CAMPBELL J K, ENGELMANN N J, LILA M A, et al. Phytoene, phytofluene, and lycopene from tomato powder differentially accumulate in tissues of male fisher 344 rats[J]. Nutrition Research, 2007, 27(12): 794-801.
[20]MELENDEZ-MARTINEZ A J, STINCO C M, LIU C, et al. A simple HPLC method for the comprehensive analysis of cis/trans (Z/E) geometrical isomers of carotenoids for nutritional studies[J]. Food Chemistry, 2013, 138(2/3): 1341-1350.
[21]JAZAERI S, MOHAMMADI A, KERMANI A M P, et al. Characterization of lycopene hydrocolloidal structure induced by tomato processing[J]. Food Chemistry, 2018, 245: 958-965.
[22]胡建中,王可興,潘思轶. 高效液相色谱法测定柑橘汁中类胡萝卜素[J]. 食品科学, 2006,27(12): 634-636.
[23]COOPERSTONE J L, FRANCIS D M, SCHWARTZ S J. Thermal processing differentially affects lycopene and other carotenoids in cis-lycopene containing, tangerine tomatoes[J]. Food Chemistry, 2016, 210: 466-472.
[24]ARIAS R, LEE T C, LOGENDRA L, et al. Correlation of lycopene measured by HPLC with the L*, a*, b* color readings of a hydroponic tomato and the relationship of maturity with color and lycopene content[J]. Journal of Agricultural and Food Chemistry, 2000, 48(5): 1697-1702.
[25]高莉红. 姜黄素的合成、染发及其染发机理研究[D]. 无锡:江南大学, 2013.
[26]LI X, LU M, TANG D Q, et al. Composition of carotenoids and flavonoids in narcissus cultivars and their relationship with flower color[J]. PLoS One, 2017, 10(11): e0142074.
[27]COYAGO-CRUZ E, CORELL M, STINCO C M, et al. Effect of regulated deficit irrigation on quality parameters, carotenoids and phenolics of diverse tomato varieties (Solanum lycopersicum L.)[J]. Food Research International, 2017, 96: 72-83.
[28]PARK M H, SANGWANANGKUL P, BAEK D R. Changes in carotenoid and chlorophyll content of black tomatoes (Lycopersicone sculentum L.) during storage at various temperatures[J]. Saudi Journal of Biological Sciences, 2018, 25(1): 57-65.
[29]BORGHESI E, GONZLEZ-MIRET M L, ESCUDERO-GILETE M L, et al. Effects of salinity stress on carotenoids, anthocyanins, and color of diverse tomato genotypes[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11676-11682.
[30]GEORG S, TOURNIAIRE F, GAUTIER H, et al. Changes in the contents of carotenoids, phenolic compounds and vitamin C during technical processing and lyophilisation of red and yellow tomatoes[J]. Food Chemistry, 2011, 124(4): 1603-1611.
[31]米佳,祿璐,戴国礼,等. 枸杞色泽与其类胡萝卜素含量和组成的相关性[J]. 食品科学, 2018, 39(5): 81-86.
[32]张颖,陈华翰,李春美. 番茄中类胡萝卜素及其顺式异构体的HPLC分析[J]. 分析测试学报, 2016, 35(4): 448-453.
[33]ISHIDA B K, ROBERTS J S, CHAPMAN M H, et al. Processing tangerine tomatoes: effects on lycopene-isomer concentrations and profile[J]. Journal of Food Science, 2007, 72(6): C307-C312.
[34]BRITTON G, YOUNG A. Methods for the isolation and analysis of carotenoids[M]//YOUNG A J, BRITTON G. Carotenoids in photosynthesis. Dordrecht: Springer, 1993: 409-457.
[35]阮美颖,叶青静,周国治,等. 不同颜色樱桃番茄果实成熟过程中色素的变化[J]. 浙江农业科学, 2013(5): 526-528.
[36]曲瑞芳,梁燕,巩振辉,等. 番茄不同品种间番茄红素含量变化规律的研究[J]. 西北农业学报, 2006,15(3): 121-123.
[37]MELNDEZ-MARTNEZ A J, FRASER P D, BRAMLEY P M. Accumulation of health promoting phytochemicals in wild relatives of tomato and their contribution to in vitro antioxidant activity[J]. Phytochemistry, 2010, 71(10): 1104-1114.
[38]COYAGO-CRUZ E, CORELL M, MORIANA A, et al. Study of commercial quality parameters, sugars, phenolics, carotenoids and plastids in different tomato varieties[J]. Food Chemistry, 2019, 277: 480-489.
[39]ALEXANDER L, GRIERSON D. Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening[J]. Journal of Experimental Botany, 2002, 53(377): 2039-2055.
[40]GIOVANNONI J J. Genetic regulation of fruit development and ripening[J]. The Plant Cell, 2004, 16(S1): S170-S180.
[41]ALBA R, PAYTON P, FEI Z, et al. Transcriptome and selected metabolite analyses reveal multiple points of ethylene control during tomato fruit development[J]. The Plant Cell, 2005, 17(11): 2954-2965.
[42]DIAS M G A, OLMEDILLA-ALONSO B, HORNERO-MéNDEZ D, et al. Comprehensive database of carotenoid contents in Ibero-American foods. A valuable tool in the context of functional foods and the establishment of recommended intakes of bioactives[J]. Journal of Agricultural and Food Chemistry, 2018, 66(20): 5055-5107.
(责任编辑:徐艳)
收稿日期:2021-03-04
基金项目:昌吉州科学研究与技术开发计划项目(2019G02); 新疆生产建设兵团重点领域创新团队建设计划项目(2019CB007)
作者简介:王丹(1996-),女,安徽六安人,硕士研究生,主要研究方向为功能性食品。(E-mail)88623827@qq.com
通讯作者:张连富, (E-mail)lianfu@jiangnan.edu.cn
