“聊红椿”提取物对非小细胞肺癌的抑制作用
2021-01-29张泽鑫马晓瑞魏洪帅朱艳娟冀芦沙
张泽鑫,李 攀,马晓瑞,谢 芳,魏洪帅,朱艳娟,冀芦沙
(1.聊城大学 药学院,山东 聊城250059;2.银川市疾病预防控制中心,宁夏 银川750000)
0 引言
根据影像学和病理学分类,肺癌分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌又可以分为肉瘤样癌、腺癌、鳞状细胞癌和大细胞未分化癌等,其发生概率占总肺癌患者的80%-85%[1]。现阶段对于非小细胞肺癌的治疗主要以西医为主,其中I,II,III A期治疗以手术切除为主,如果没有发生转移,那么切除后就不考虑术后辅助治疗;如果发生转移,则会采取术后辅助治疗,比如化疗辅助。对于高危的III B期和IV期,主要采取全身治疗,目的是为了减轻患者痛苦,提高其生活质量,延长其生存期[2]。近年来,随着中医的发展,越来越多的患者倾向于采取中西医结合治疗的策略。患者手术后会通过服用一些补气益血的中医药来恢复机体正气,增加机体免疫力,减少术后癌细胞转移的风险。患者在进行放疗、化疗或者分子间靶向治疗以及免疫疗法时,也可以服用一些中医药。一是,可以减轻其毒副作用对机体的伤害;二是,一些中医药有增强敏感性作用,能够提高治疗效果。对于一些肺癌晚期患者,手术治疗和辅助治疗已经没有意义,此时也可以采取中医药治疗。一是减轻患者疼痛感;二是提高患者生存质量;三是延长患者生命[3]。肺癌是一种常见性的恶性肿瘤,其发病率和致死率呈现逐年上升趋势。根据预测,到2025年,我国每年将会有100万新发肺癌患者,每年高达90万人会死于肺癌,那时我国将成为肺癌大国[4]。因此,寻找治疗肺癌的有效方法显得格外重要。本研究中,我们通过从“聊红椿”中提取有效成分,作用于非小细胞肺癌A459细胞系和肺癌肿瘤模型小鼠,发现其对非小细胞肺癌具有显著活性,这为将来对非小细胞肺癌的治疗提供了新思路。
1 材料
1.1 药物
“聊红椿”提取物由本实验室通过有机溶剂萃取法提取,并通过旋转蒸发仪蒸干浓缩,再用常规水煎,浓缩至0.20 mg/mL,分装到EP管中,置于4 ℃冰箱保存,用于后续研究。非小细胞肺癌治疗药物顺铂(Cisplatin,DDP),购买于齐鲁制药有限公司,产品批号为:411016CE,含量为20 mg/瓶,用细胞等渗浓度生理盐水稀释为0.367 mg/mL。
1.2 动物
选取60只SPF级雄性小鼠,鼠龄6-8 w,重量20 ± 2 g,购买于江苏省常州卡文斯实验动物有限公司,合格证号为:SCXK(苏)2011-0003,饲养于聊城大学药学院实验室动物房,室温控制在25 ℃,空气湿度保持为70%,采用国家标准饲料喂养,实验过程中小鼠采取自由饮食和饮水。
1.3 细胞株
人肺腺癌细胞系A549 购自美国ATCC公司,编号 CCL-185,培养于含有100mL/L胎牛血清的DMEM培养基中,置于温度设定为37 ℃,CO2含量为50 mL/L的细胞培养箱中培养。
1.4 试剂
臭椿酮,购买于上海乔羽生物科技有限公司,分析纯;MTT(四甲基偶氮唑盐),购买于上海Sigma公司;胎牛血清和DMEM培养基均购买于Gibco公司;RNA提取液Trizol,cDNA反转录试剂盒以及荧光定量PCR试剂盒均购买于大连TaKaRa公司;细胞凋亡检测试剂盒Annexin V-FITC购买于江苏碧云天公司;β-actin、 Bax、Bcl-2、caspase-3、cleaved PARP基因引物由上海生工公司合成;裂解 DNA 修复酶(cleaved PARP)购买于美国Abcam公司;兔抗人β肌动蛋白 (β-actin) 抗体、兔抗人 Bcl-2 抗体、兔抗人裂解型caspase-3 (cleaved-caspase-3) 抗体和兔抗人 Bax 抗体均购买于万类生物科技公司;甲醇、甲酸等有机试剂购买于国药集团化学试剂有限公司。
1.5 仪器
液相色谱LC-20A购买于日本岛津;荧光定量PCR Prism 7300购买于美国ABI公司;CO2恒温细胞培养箱FormaSeries和酶标仪Multiskan FC均购买于美国Thermo Fisher Scientific公司;倒置显微镜CKX-41购买于日本Olympus公司;流式细胞仪FACS CaliburTMFlow Cytometer REF 34295购买于美国BD公司;低温高速离心机Eppendorf Centrifuge5810R购买于德国Eppendorf公司;电泳仪及转膜仪Mini PROTEAN 3 Cell购买于美国Bio-Rad公司;凝胶成像系统Tanon NIM2045购买于中国Tanon公司。
2 方法
2.1 “聊红椿”有效成分提取
(1) 称取新鲜“聊红椿”和野生型臭椿翅果150 g;(2) 液氮冷冻后研磨成粉末,加入少许无水乙醇使其充分溶解;(3) 加入200 ml蒸馏水,超声处理20 min;(4) 将其转移到旋转蒸发仪中,旋转蒸发浓缩成粉末状;(5) 称取0.1 g粉末将其置于1.5 mL EP管中,加入1 mL 75%乙醇,室温下旋转震荡抽提12 h;(6) 室温,12000 rpm,离心10 min,将上清液转移到新的EP管中;(7) 用0.22 μm 微孔滤膜过滤,将其转移到HPLC上样小瓶中,制备成待测样品,用于后续HPLC检测。
2.2 HPLC检测
色谱仪为岛津LC-20A仪器;色谱柱为XTerra (2.1 X 150 mm,C18);流动相 A相为乙腈,B相为0.1%甲酸水溶液;流速:1.0 mL/min;检测波长:240-600 nm;柱温:常温;进样量:20 μL;洗脱梯度:0 min A相 10%,B相 90%;20 min A相65%,B相 35%;22 min A相10%,B相 90%;35 min 停止。
2.3 细胞培养
A549细胞株系用含有10%胎牛血清的DMEM培养基培养,放置于5% CO2的培养箱中,37 ℃静置培养。取A549对数生长期的细胞,采用0.25 %胰蛋白酶消化后进行相关细胞实验。
2.4 MTT检测
将上述培养和处理后的细胞接种到96孔板中,每孔100 μL,细胞密度保持5000个左右。将不同浓度的“聊红椿”提取物加入到96孔板中,培养不同时间,设置3个重复。每孔中加入10 μL 5 g·L-1的MTT溶液(PBS缓冲液配制),孵育4 h,倒掉上清液。每孔中加入100 μL DMSO,震荡反应10 min。测定其吸光度,检测波长为490 nm,计算并统计A549细胞增殖抑制率。
2.5 流式细胞仪检测细胞凋亡
选取对数生长期的A549细胞,将不同浓度的“聊红椿”提取物加入到96孔板中,培养24 h,每个浓度设置3个重复。具体步骤按照Annexin V-FITC细胞凋亡检测说明书进行操作[5]。
2.6 Real-Time PCR检测相关基因表达
(1) 总RNA提取:采用有机试剂Trizol萃取法,具体步骤参考Trizol提取试剂盒;(2) cDNA反转录:具体步骤参考TaKaRa反转录试剂盒;(3) Real-Time PCR:具体步骤参考TaKaRa 荧光定量PCR试剂盒。
2.7 Western blot检测相关蛋白表达
选取对数生长期的A549细胞,将不同浓度的“聊红椿”提取物加入到96孔板中,培养24 h,每个浓度设置3个重复。提取各组细胞总蛋白后,按照相关方法和步骤检测相关蛋白的表达。
2.8 肺癌裸小鼠皮下移植瘤模型建立
选取对数生长期的A549细胞,将0.25 %胰蛋白酶消化后,将其制成1×108/mL的细胞悬浮液。将其通过注射方式接种0.2 mL到裸小鼠右侧颈背交界处皮下,待裸小鼠皮下肿瘤长成即为模型构建成功[6]。
2.9 分组及给药
裸小鼠模型构建过程中,选取60只小鼠,将其分为6组,每组10只,模型对照组(MC group),裸小鼠腹腔注射0.9%氯化钠注射液0.5 mL;阳性药物治疗组(DDP组),裸小鼠注射0.5 mL DDP稀释液;低剂量提取物组(L group),注射1.0 mg/kg的“聊红椿”提取物;中剂量提取物组(M group),注射2.0 mg/kg的“聊红椿”提取物;高剂量提取物组(H group),注射4.0 mg/kg的“聊红椿”提取物;联合组(LC group),注射0.5 mL DDP稀释液和2.0 mg/kg的“聊红椿”提取物。注射方式为腹腔注射,每3天注射1次,共注射14次,总计实验进行6 w。6 w后,处死肿瘤小鼠,摘下肿瘤,测量小鼠体质量和肿瘤直径。

表1 “聊红椿”提取物对A549细胞增殖的抑制影响
2.10 统计学分析
本研究中所有实验数据均需要通过SPSS19.0统计学软件进行统计学处理,数据呈现方式为平均数±标准差(x±s)。各组数据之间采用t检验,当P< 0.05时,表示差异显著,有统计学意义[7]。
3 结果
3.1 “聊红椿”有效成分HPLC检测
结果如图1所示,与野生型相比,“聊红椿”中有效成分臭椿酮含量显著高于野生型。鉴于之前的报道,臭椿酮具有很好的抗癌活性。接下来的研究中,我们重点将“聊红椿”提取物作用于非小细胞肺癌,研究其作用效果和分子机制。

图1 “聊红椿”有效成分HPLC检测
3.2 “聊红椿”提取物对A549细胞增殖的抑制影响
结果如表1所示,不同剂量“聊红椿”提取物组作用A549细胞株系后,A549细胞生长受到非常显著的抑制,且作用时间越长,剂量越高,其抑制效果越好。
3.3 “聊红椿”提取物对A549细胞凋亡的影响
结果如图2和表2所示,与对照组相比,不同剂量“聊红椿”提取物作用A549细胞株系后,A549细胞凋亡率明显增加,且具有显著的剂量依赖性。

图2 “聊红椿”提取物对A549细胞凋亡的影响
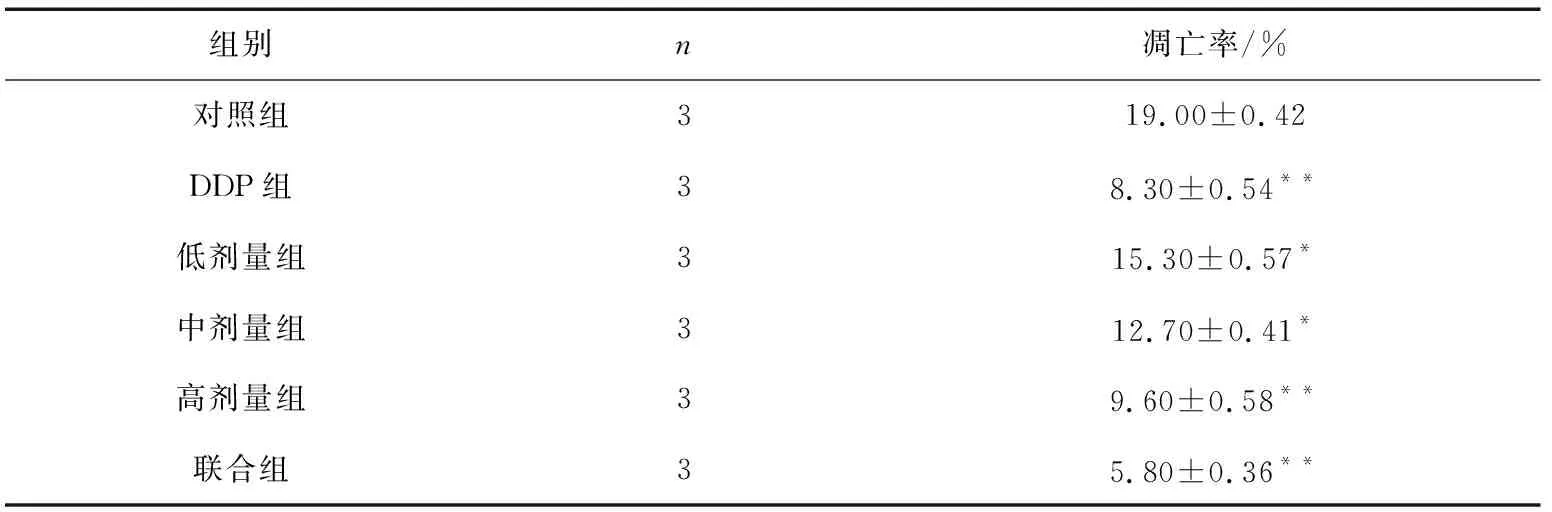
表2 “聊红椿”提取物对A549细胞凋亡的影响
3.4 “聊红椿”提取物对A549细胞中相关基因表达的影响
结果如图3所示,与对照组相比,“聊红椿”提取物处理后,A549中细胞凋亡因子Caspase-3,Bax,cleaved PARP的mRNA含量显著下降,抗凋亡因子Bcl-2 mRNA含量显著增加。
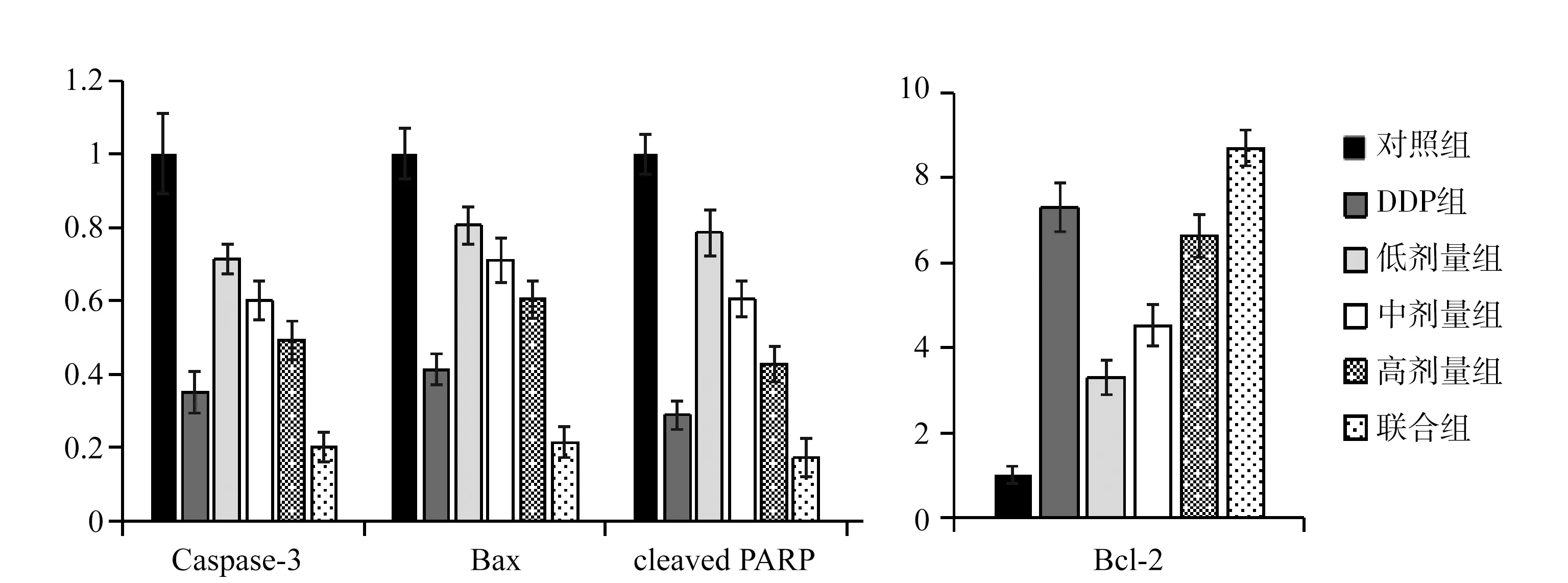
图3 “聊红椿”提取物对A549细胞中相关基因表达的影响
3.5 “聊红椿”提取物对A549细胞中相关蛋白表达的影响
结果如图4所示,“聊红椿”提取物对A549细胞中细胞凋亡因子蛋白水平表达的影响与mRNA水平一致。与对照组相比,Caspase-3,Bax,cleaved PARP的蛋白水平显著下降,抗凋亡因子Bcl-2的蛋白水平显著增加。
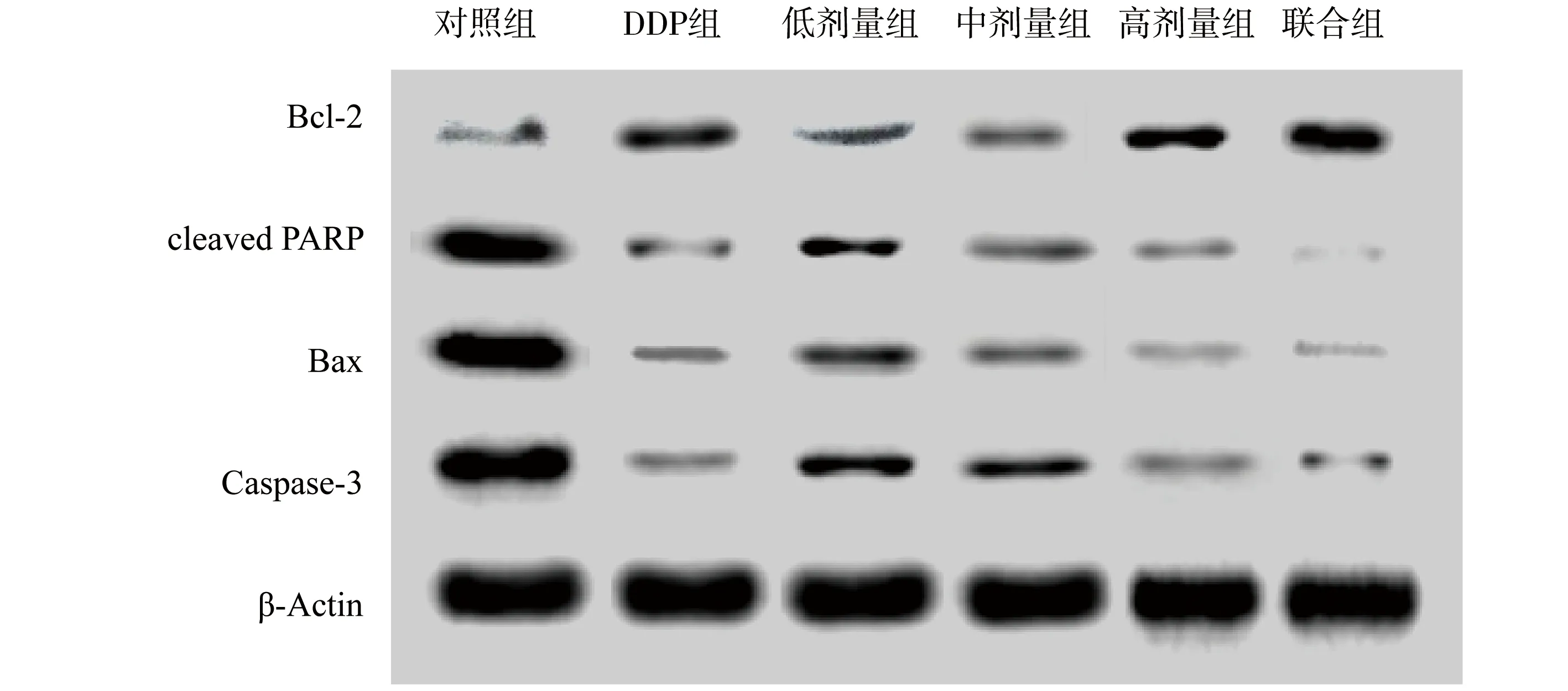
图4 “聊红椿”提取物对A549细胞中相关蛋白表达的影响
3.6 “聊红椿”提取物对裸小鼠体质量及肿瘤直径的影响
结果如表3所示,“聊红椿”提取物对各组小鼠体质量影响不显著,但是显著影响裸小鼠肿瘤直径,且具有剂量依赖性。

表3 “聊红椿”提取物对裸小鼠体质量及肿瘤直径的影响
4 讨论
臭椿Ailanthus altissima(Mill.)Swingle,属于落叶乔木,也叫椿树或木砻树。因其叶基部有腺点,易发散出臭味而得“臭”字。中医研究表明,臭椿树皮、根皮和荚果等都是中药材,具有止泻、止血、清热燥湿等功效[8]。“聊红椿”从聊城大学农学院臭椿培养基地中发现的一株稳定遗传的臭椿株系,其荚果呈现红色。臭椿酮(Ailanthone)是从臭椿中提取分离出来的一种苦味素类化合物,研究发现其有多种生物活性,如抗过敏、抗HIV、抗炎症、抗疟疾、抗微生物和抗溃疡等[9]。现代药理学研究发现,臭椿酮还具有抗癌症、抗病毒和抗结核病等生物活性[10]。近年来关于臭椿酮抗癌活性的报道越来越多,如Zhou Z等研究发现,臭椿酮可以通过抑制细胞周期蛋白和CDKs的表达,诱导p21和p27的上调表达,进而使得肝癌细胞处于G0/G1期阻滞,最终促进细胞凋亡发生[11]。He Y等研究发现,臭椿酮还具有克服药物治疗前列腺癌所产生的耐药性,同时还具有抑制前列腺癌肿瘤细胞的增殖,其作用机制主要是通过直接结合p23,进而抑制AR(雄激素受体)与HSP90(热休克蛋白90)的互作,使得AR蛋白发生不可逆降解,抑制下游基因的表达,从而达到治疗前列腺癌的目的[12]。本研究中,我们通过有机试剂萃取法,HPLC分析发现“聊红椿”中主要有效成分为臭椿酮,且其含量远高于野生型臭椿,这个结果说明“聊红椿”提取物可能比野生型臭椿株系中医药活性更好。
研究发现臭椿酮及其衍生物还具有很好的抗肺癌功效,其在细胞水平和动物水平抗肺癌主要是通过泛素-蛋白酶体途径(ubiquitin-proteasome pathway,UPP),抑制下游相关基因表达[13]。当UPP生物学行为发生异常时,会造成恶性肿瘤的发生,这主要是由于当UPP蛋白异常时,会造成细胞内与UPP相关的重要功能蛋白发生降解,进而造成细胞内代谢紊乱[14]。Ni Z等研究发现,臭椿酮可以在体外抑制非小细胞肺癌细胞的生长,体内抑制皮下移植瘤的生长,能够显著延长荷瘤小鼠的生存质量和生存期。对其机制进行研究,发现臭椿酮主要是通过下调RPA1(复制蛋白A1)的蛋白表达,抑制DNA复制的发生,进而抑制非小细胞肺癌细胞的生长[15]。本研究中,我们将“聊红椿”提取物作用于非小细胞肺癌细胞,发现“聊红椿”提取物能够显著抑制A549细胞增殖和促进细胞凋亡发生,具有剂量依赖性。荧光定量PCR和Western blot实验发现,“聊红椿”提取物能够降低细胞凋亡因子Caspase-3,Bax,cleaved PARP的mRNA和蛋白水平的表达,增加抗凋亡因子Bcl-2 mRNA和蛋白表达,具有剂量依赖性。体外成瘤实验显示,“聊红椿”提取物能够明显降低肿瘤细胞直径,抑制效果与浓度呈正比。
总之,本研究从一个新的突变株系“聊红椿”中提取出有效成分,发现其中有高含量的臭椿酮,且对非小细胞肺癌具有抑制细胞增殖和促进细胞凋亡作用。对其机制研究发现,其通过细胞凋亡因子起作用。但是本研究仍有不足之处,如“聊红椿”中提取物如何起作用,后续仍需要大量研究去确定。
