AURKA介导DNA损伤修复通路对肝癌细胞HepG2的影响*
2021-01-28彭期臻郝剑文李慧锴张雪宁
彭期臻,郝剑文,秦 宇,李慧锴,张雪宁△
(1.天津医科大学第二医院放射科,天津 300211;2.天津医科大学诊断学教研室,天津 300070;3.天津市肿瘤医院肝胆肿瘤科,天津 300060)
肝细胞癌(hepatocellular carcinoma,HCC)是全球第六大常见癌症,每年有84万以上新增病例,且近年来发病率一直呈上升趋势[1]。监测HCC生物标志物可以对早期HCC进行筛查与诊断,经过肿瘤切除、肝移植或射频消融术治愈的部分患者生存期可以达到5年以上[2]。然而,对于更多的被诊断为晚期HCC的患者,化疗是唯一的治疗方法,由于存在多种复杂的耐药机制,晚期HCC患者的总体预后仍然较差[3]。近年来HCC的分子靶向治疗是研究热点[4-5]。Aurora蛋白激酶(aurora kinase A,AURKA)是一种丝氨酸/苏氨酸激酶,可调节细胞有丝分裂周期和细胞凋亡,与癌症的发病机制密切相关[6-7]。AURKA是各种癌症(例如乳腺癌、胰腺癌、泌尿道上皮癌等)中扩增和表达最多的基因之一,且高表达的AURKA可促进肿瘤进展至中晚期,可能导致不良预后[8-9]。研究表明,DNA损伤反应(DNA damage response,DDR)中DNA的损伤和异常变化,特别是DNA修复过程在癌症进展中起到关键作用,对DDR分子机制的深入了解将为癌症的预防和治疗提供新的思路[10]。因此,AURKA及DDR在肿瘤发生发展过程中发挥重要作用,但目前有关AURKA在DDR中的作用机制研究较少。本研究构建以增强绿色荧光蛋白(EGFP)为载体的shRNA和AURKA过表达质粒,获得肝癌稳定转染细胞系,通过体外和体内实验系统地研究AURKA对肝癌细胞的影响,并对AURKA在DDR中的分子机制进行了初步探讨,敲低HCC中AURKA表达水平有望成为HCC新的治疗方案。
1 材料与方法
1.1 材料
人肝癌HepG2细胞由天津医科大学基础医学院保存。MLN8237购自美国Selleck公司;CCK8(Cell Counting Kit-8)试剂盒购自美国MCE公司;α-微管蛋白(α-Tubulin)抗体购自美国Acam公司,DDR抗体试剂盒购自美国Cell Signaling Technology公司;AURKA相关表达质粒和慢病毒包装试剂盒EndoFectinTM-Lenti购自美国Genecopoeia公司。
1.2 细胞培养
将肝癌细胞HepG2加入含10%胎牛血清、青霉素和链霉素各100 μg/mL的DMEM培养液中,置于37 ℃、5% CO2的培养箱中培养。实验均取对数生长期细胞。
1.3 构建HepG2稳定转染细胞系
取对数生长期HepG2细胞,分为shAURKA组及shCTRL组(对照组)、AURKA OE组及AURKA EV组(对照组)。根据EndoFectinTM-Lenti说明书分别利用shRNA和AURKA过表达质粒转染细胞后,通过流式细胞分选仪分选绿色荧光蛋白(EGFP)阳性细胞。分选后的转染细胞扩增后,置于细胞培养箱中传代培养。
1.4 RNA提取和实时荧光定量聚合酶链反应(RT-PCR)
收集转染后的各组细胞,用TRIzol法提取各组细胞总RNA,紫外分光光度计检测总RNA水平及纯度。采用All-in-OneTMqPCR Mix进行反转录反应,使用SYBR Green法在 ABI 7500 RT-PCR仪上进行RT-PCR。反应条件:95 ℃ 5 min(聚合酶活化),然后进行40个循环[95 ℃ 30 s(变性),55 ℃ 30 s(退火)和72 ℃ 30 s(延伸)]。检测引物为AURKA,上游引物序列5′-GGA ATA TGC ACC ACT TGG AAC A-3′,下游引物序列5′-TAA GAC AGG GCA TTT GCC AAT-3′;以GAPDH作为内参,上游引物序列5′-ACA ACT TTG GTA TCG TGG AAG G-3′,下游引物序列5′-GCC ATC ACG CCA CAG TTT C-3′。最后使用目的基因和内参基因的Ct值,通过2-ΔΔCt计算目的基因的相对表达水平,其中2-ΔΔCt=实验组/对照组;Ct =实验组(Ct目的-Ct内参)-对照组(Ct目的-Ct内参)。实验重复3次。
1.5 CCK8实验
取对数生长期的各组细胞,接种于96孔培养板中,24 h后向每组的3个孔各加入10 μL CCK8试剂,继续孵育1~2 h,使用酶标仪测定上述孔在波长450 nm处的吸光度(A)值,此时为第1天的A值;之后,分别在第2、3、4、5天向每组剩余孔的其中3个孔加入10 μL CCK8试剂,并重复第1天的操作。记录各组第1~5天的A值。实验重复3次。
1.6 克隆形成实验
取对数生长期的各组细胞,接种于12孔培养板中,每组设立3个复孔;细胞培养约10 d后,待出现肉眼可见的集落时终止培养;形成克隆后,以磷酸盐缓冲液(PBS)清洗细胞,4%多聚甲醛固定后用结晶紫染色液染色,然后用蒸馏水清洗后晾干,拍照并使用Image J软件计算细胞克隆数。实验重复3次。
1.7 细胞划痕实验
取对数生长期的各组细胞,接种于12孔培养板中,每组设立3个复孔;待细胞贴壁达80%融合时,用枪头在孔内垂直、均匀地划横线,横线横穿过孔,此时记为第0小时,分别于第0、24、48小时在显微镜下拍照。使用Image J软件测量细胞划痕迁移距离,计算第48小时与第0小时的细胞划痕迁移距离之比。实验重复3次。
1.8 免疫细胞荧光染色
将盖玻片进行高温、高压灭菌处理后用无菌镊子放置到12孔板的孔内;取对数生长期的各组细胞,接种于12孔培养板中;24 h后吸去细胞培养液,PBS溶液洗涤1次,加入4%多聚甲醛后-20 ℃冰箱固定20 min;将固定好的细胞用通透液(0.1% Triton X-100/PBS)通透15 min后,用封闭液37 ℃封闭1 h,然后与稀释好的一抗4 ℃孵育过夜;加入稀释好的二抗,室温避光孵育1 h;向每张盖玻片加入含4′,6-二脒基-2-苯基吲哚(DAPI)的封片液,将盖玻片的细胞面向下小心铺于载玻片上,用铝箔纸包裹并-20 ℃保存;使用荧光显微镜观察各组细胞。
1.9 Western blot
取对数生长期的各组细胞,接种于6孔培养板中;24 h后收集、提取各组细胞蛋白质并进行定量检测;每孔按25 μg的蛋白进行凝胶电泳后,转移至聚偏氟乙烯(PVDF)膜上,封闭后分别加入DDR抗体试剂盒内的抗体,4 ℃孵育过夜;加入相应二抗,室温孵育1 h;显影液显影、定影,在ChemiDoc成像系统中进行曝光成像,检测蛋白质条带,使用Image Lab软件分析目的条带灰度值,以目的蛋白条带灰度值与内参蛋白GAPDH条带灰度值的比值表示目的蛋白相对表达水平。实验重复3次。
1.10 人肝癌裸鼠皮下成瘤模型的建立及组织免疫化学染色
所有动物实验程序均已获得天津医科大学实验动物管理和使用委员会(IACUC)的批准。将12只5周龄的雌性BALB/c裸鼠分为4组;裸鼠右前肢皮下分别接种4组肝癌细胞后(5×106个细胞/只),每天观察裸鼠一般状况;待可触及皮下瘤体,使用游标卡尺每3天测量1次肿瘤的长径和宽度,肿瘤体积用长×宽2/2公式计算(单位:mm3),并绘制肿瘤生长体积曲线;待4组裸鼠瘤体大小有一定差异时,处死、解剖全部裸鼠,取出瘤体并进行拍照,然后置于4%甲醛溶液中保存,进行常规组织包蜡及切片的制作;对肿瘤标本组织切片进行苏木精-伊红染色(hematoxylin-eosin staining,HE)及TUNEL染色。
1.11 统计学处理
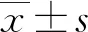
2 结 果
2.1 shCTRL/shAURKA、AURKA EV/AURKA OE HepG2稳定转染细胞系的构建及鉴定
对获得的shCTRL/shAURKA、AURKA EV/ AURKA OE HepG2稳定转染细胞系行RT-PCR检测AURKA mRNA表达水平,结果显示:shAURKA组较shCTRL组相对低表达AURKA mRNA;AURKA OE组较AURKA EV组相对高表达AURKA mRNA,差异有统计学意义(P<0.05),见图1。
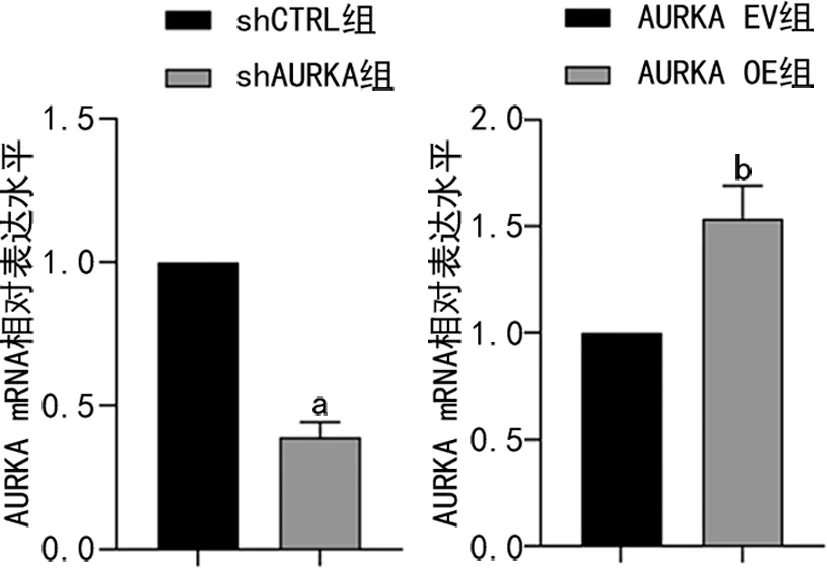
a:P<0.05,与shCTRL组比较;b:P<0.05,与AURKA EV组比较。
2.2 AURKA对肝癌细胞增殖活性的影响
对肝癌稳定转染细胞系进行CCK8实验和细胞克隆形成实验,结果显示:与对照组细胞相比,shAURKA组细胞增殖活性显著降低,而AURKA OE组细胞增殖活性显著增高,差异有统计学意义(P<0.05),见图2。

A:CCK8实验;B:细胞克隆形成实验;a:P<0.05,与shCTRL组比较;b:P<0.05,与AURKA EV组比较。
2.3 AURKA对肝癌细胞迁移侵袭能力的影响
用获得的肝癌稳定转染细胞系进行细胞划痕实验,结果显示:与对照组细胞相比,shAURKA组细胞迁移侵袭能力明显降低,而AURKA OE组细胞迁移侵袭能力明显提高,差异有统计学意义(P<0.05),见图3。
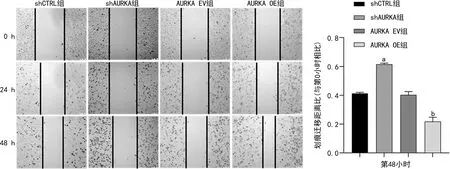
a:P<0.05,与shCTRL组比较;b:P<0.05,与AURKA EV组比较。
2.4 AURKA对肝癌细胞凋亡过程的影响
用获得的肝癌稳定转染细胞系进行了α-Tubulin免疫荧光染色,并在共聚焦显微镜下观察细胞微观形态变化(红色荧光是α-Tubulin,代表细胞纺锤丝;蓝色荧光是DAPI,代表细胞核),结果显示:与对照组细胞相比,在shAURKA组细胞中观察到微管网络结构改变,纺锤体不能形成及染色体错位、细胞核崩解,而AURKA OE组细胞的微管蛋白聚合,纺锤体形成并出现多极分裂,中期染色体排列有序,见图4。

图4 AURKA对HepG2细胞凋亡过程的影响(×400)
2.5 AURKA介导DNA损伤修复通路参与HCC发生
Western blot实验结果显示:与对照组细胞相比,shAURKA组细胞DNA损伤等相关蛋白表达水平显著降低,AURKA OE组细胞DNA损伤等相关蛋白表达水平显著升高,差异有统计学意义(P<0.05),见图5。
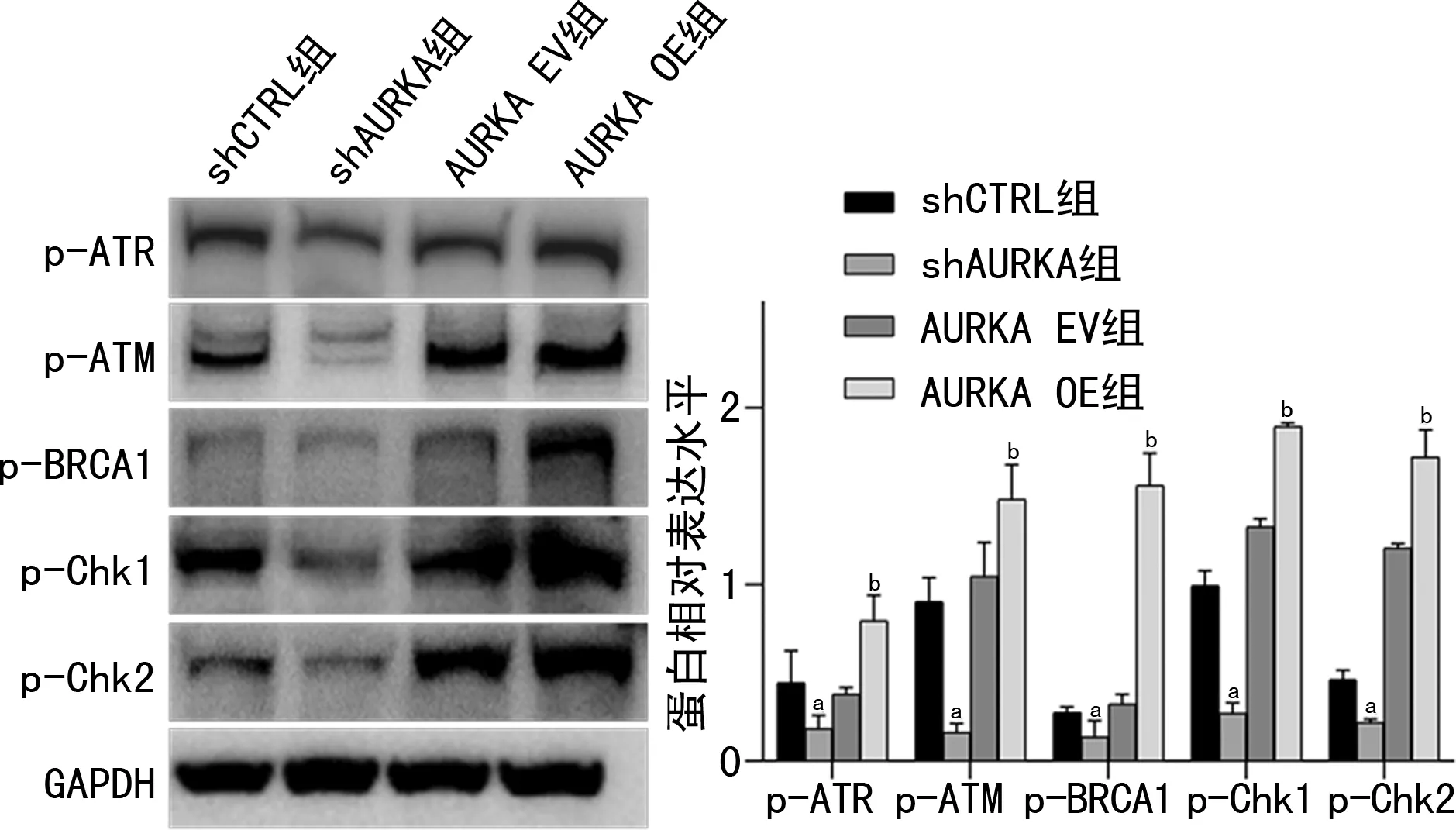
a:P<0.05,与shCTRL组比较;b:P<0.05,与AURKA EV组比较。
2.6 AURKA表达水平对人肝癌裸鼠皮下成瘤生长情况的影响
利用肝癌稳定转染细胞系成功建立人肝癌裸鼠皮下成瘤模型,结果显示:与对照组相比,shAURKA组肿瘤生长明显受到抑制且体积最小,而AURKA OE组肿瘤快速增长且体积最大,差异有统计学意义(P<0.05),见图6A、B。HE和TUNEL染色结果显示,敲低AURKA表达可促进肿瘤细胞凋亡坏死,AURKA表达上调可抑制肿瘤细胞凋亡坏死,见图6C。

A:人肝癌裸鼠皮下成瘤实验肿瘤标本;B:人肝癌裸鼠皮下成瘤实验肿瘤平均体积的增长曲线 (a:P<0.05,与shCTRL组比较;b:P<0.05,与AURKA EV组比较);C:人肝癌裸鼠皮下成瘤实验肿瘤标本的HE(×400)和TUNEL染色(×400)。
3 讨 论
AURKA是Aurora激酶家族中最重要的成员,研究已证明完成一系列重要的有丝分裂过程(例如中心体形成、启动有丝分裂、纺锤体形成和胞质分裂等)均需要AURKA。AURKA通过调控细胞周期进程、增殖和/或凋亡信号通路、癌基因的致癌性、上皮间质转化及癌细胞的干细胞特性等,在癌症发展过程中发挥多种作用[11-12]。例如棕榈碱可通过靶向AURKA诱导结肠癌细胞G2/M期阻滞及调控线粒体相关途径而促进凋亡[13];上消化道腺癌组织样本中AURKA明显过表达,抑制AURKA表达可导致细胞G2/M期延迟、染色体多倍性和细胞死亡;抑制AURKA表达可诱导成神经细胞瘤细胞衰老和G2/M期停滞而抑制细胞生长[14];AURKA介导Wnt-β-catenin信号通路参与慢性粒细胞白血病和头颈癌的肿瘤干细胞调控[15]。
AURKA在HCC中亦扮演至关重要的角色,研究证实AURKA在HCC的多种细胞系中表达升高,并与HCC分级和分期密切相关[16]。AURKA与Myc基因启动子结合并诱导AURKA在肝癌细胞中的表达,形成Myc-AURKA反馈环而导致HCC发生[17]。AURKA通过介导NF-κB/miR-21/PTEN/Akt信号通路提高HCC的化学抗性,这表明靶向AURKA将有助于降低HCC对化疗药物的抵抗性[18]。抑制HepG2细胞中的AURKA表达可介导PI3K/Akt/mTOR途径诱导细胞自噬和细胞周期停滞,并提高细胞的化疗敏感性[19]。本研究首先利用shRNA和AURKA过表达质粒转染人肝癌细胞HepG2,进一步的体内和体外实验证实敲低AURKA表达可显著抑制HepG2细胞的增殖、迁移侵袭,并导致细胞周期阻滞而抑制有丝分裂过程,诱导细胞发生凋亡,同时抑制人肝癌裸鼠皮下成瘤生长、促进其凋亡坏死,从而抑制肿瘤组织生长;而AURKA表达上调在HepG2细胞中起促癌作用。
众所周知,细胞发生DNA损伤时产生突变导致细胞癌变的可能性增加,而DDR可纠正DNA损伤因子或致癌物引起的DNA损伤,从而维持基因组稳定性,因此DDR效率低下是癌症发展过程中的重要驱动力[20],近年来研究表明靶向DDR将有助于治疗多种癌症[21-22]。例如AURKA/p53/ATM/Chk2介导的DDR途径与miR-137共同在多发性骨髓瘤的染色体不稳定性和耐药性中发挥作用[23]。CDK12抑制剂促进肝癌细胞DDR,并可与索拉非尼协同治疗HCC[24]。AURKA和BRCA1/2能够调控ATM/Chk2介导的DNA修复网络,破坏癌细胞的DDR[25]。本研究结果显示敲低AURKA表达可显著抑制HepG2细胞中p-ATM、p-ATR、p-BRCA1、p-Chk1和p-Chk2的蛋白表达,促进细胞DDR发生,防止细胞发生恶性转变;而AURKA表达上调,则抑制细胞DDR发生而起促癌作用,推测AURKA通过影响ATM/Chk2和ATR/Chk1介导的DNA损伤修复网络调控肝癌细胞的增殖、侵袭等过程。
目前已有研究表明AURKA激酶抑制剂,如MLN8237、MLN8054等有成为癌症靶向治疗药物的潜力[26]。其中MLN8237目前已通过临床Ⅰ期试验,临床Ⅱ、Ⅲ期试验正在积极开展中,MLN8237在多种血液和实体肿瘤中均显示出有效的AURKA抑制和抗肿瘤活性[27]。AURKA激酶抑制剂在肿瘤中的有效治疗成果预示着AURKA有希望成为治疗HCC的关键靶标。此外,ZHANG等[28]研究发现MLN8237与肝癌靶向化疗药物索拉非尼协同影响肝癌细胞的增殖、凋亡、血管形成等而发挥抗HCC作用,因此MLN8237联合已应用于临床的肝癌靶向药物协同增强HCC的治疗效果可能是未来的研究方向。
综上所述,AURKA在肝癌细胞中起着重要的调控作用,并且与肝癌细胞的抗凋亡能力和DDR密切相关,抑制AURKA可以阻碍HCC发生发展,为HCC的临床治疗和诊断提供理论依据。因此,针对AURKA的靶向治疗有望成为HCC的新型治疗策略。
