免疫检查点抑制剂PD-1 免疫相关不良反应的临床分析
2021-01-28周静文何明基黄文薮黄敬君郭永建蔡明岳朱康顺
周静文,何明基,练 辉,黄文薮,黄敬君,郭永建,蔡明岳,朱康顺
免疫检查点抑制剂(immune checkpoint inhibitors,ICI)是近年来在恶性肿瘤治疗中具有突破性进展的药物,与传统的放化疗直接杀伤肿瘤细胞不同,ICI针对机体免疫系统,可以打破肿瘤的免疫耐受及逃逸,恢复效应T 细胞特异性识别和杀伤肿瘤细胞的功能,从而治疗肿瘤[1]。程序性细胞死亡蛋白-1(PD-1)免疫检查点抑制剂可调节机体自身的免疫系统以发挥抗肿瘤作用,因此在某种意义上,ICI 可被称为“广谱抗肿瘤药物”或“泛瘤种抗癌药”,并已被证实在黑色素瘤、非小细胞肺癌、淋巴瘤、肾癌、尿路上皮癌、胃癌、头颈部肿瘤、结直肠癌及肝癌等肿瘤中显示出良好疗效,并正在进行其他各癌种的临床试验及应用。
随着PD-1 免疫检查点抑制剂在各类恶性肿瘤治疗中的广泛应用,免疫治疗相关不良反应(immune related adverse events,irAE)逐渐引起人们的关注和重视。本文就PD-1 治疗恶性肿瘤期间出现的不良反应进行临床分析。
1 材料与方法
1.1 材料
1.1.1 研究对象 2019 年1 月至12 月在我科接受PD-1 治疗的各类晚期恶性肿瘤患者194 例,其中男160 例、女 34 例,年龄 19~86 岁,包括肝癌 104 例、肺癌 33 例、其他癌种 57 例。共接受 473 次治疗,平均每例2.4 次。
1.1.2 主要药物: 纳武利尤单抗注射液(3 mg/kg,每2 周1 次)、帕博利珠单抗注射液(2 mg/kg 或200 mg固定剂量,每3 周1 次)、信迪利单抗注射液(200 mg,每 3 周 1 次)、特瑞普利单抗注射液(3 mg/kg,每 2 周1 次)、卡瑞利珠单抗注射液(200 mg,每 2 周 1 次;3 mg/kg,每 3 周 1 次)。
1.2 方法
1.2.1 治疗方案 194 例患者均为晚期恶性肿瘤,告知患者及家属使用PD-1 的利弊及可能出现的风险,并签署免疫治疗知情同意书。根据临床实际情况使用不同种类PD-1 进行抗肿瘤治疗,用药剂量按药物说明书推荐剂量,用药周期按药物说明书或根据实际返院治疗时间适当延长。患者在接受PD-1治疗期间可进行介入治疗,包括肿瘤供血动脉灌注化疗、化疗栓塞及放射性粒子植入术等。
1.2.2 不良反应观察与评估 以2017 年美国卫生及公共服务部常见不良事件评价标准(CTCAE)5.0版为依据,观察患者使用PD-1 单抗治疗期间不良反应的发生情况,包括不良反应的类别、分级、发生时间、持续时间、处理方案、预后等。
1.3 统计学分析
应用SPSS 25.0 统计软件对相关数据进行统计分析,计数资料的比较方法采用卡方检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料
194 例患者接受 PD-1 治疗,男 160 例(82.5%)、女 34 例(17.5%),年龄 19~86 岁、中位年龄 58 岁。
2.2 不良反应发生情况
194 例患者中,83 例发生不良反应,发生率为42.8%,其中 1、2 级不良反应 75 例(38.7%),3、4 级不良反应 7 例(3.6%),死亡 1 例(0.52%)。其中 13例(6.7%)同时出现累及多个系统的不良反应。具体不良反应发生情况见表1。
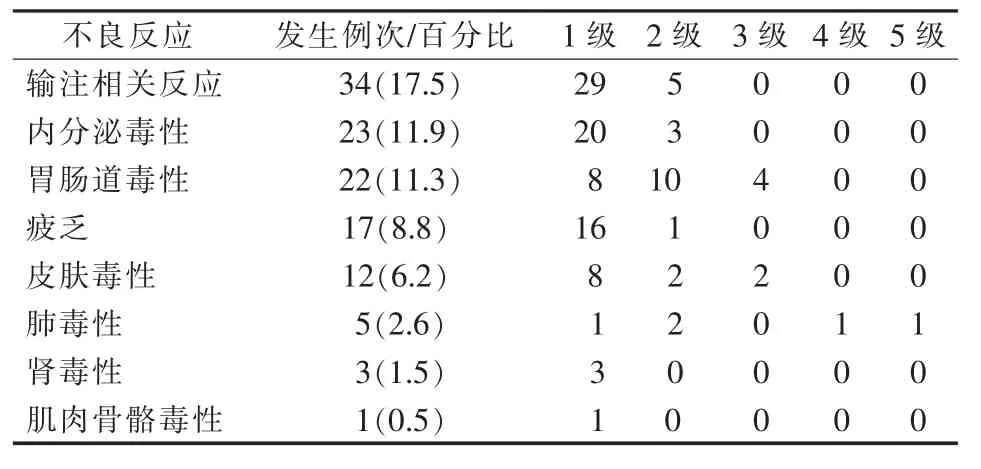
表1 194 例患者使用PD-1 单抗治疗后不良反应的发生情况 例(%)
2.2.1 输注相关不良反应 34 例,发生率为17.5%,其中发热11 例、头晕8 例、关节痛/肌痛 8 例、出汗5 例、荨麻疹/瘙痒 4 例、高血压 3 例、气促 3 例、咳嗽/喘息 3 例、血管性水肿 1 例、潮红/头痛 1 例、低氧血症1 例。输注相关不良反应22 例发生在首次接受治疗 PD-1 单抗后,12 例(35.3%)在第 2 次治疗时发生。输注相关不良反应均发生在治疗的当天,经立即暂停或减慢输注速度及对症处理,患者不适症状自行缓解,然后继续PD-1 输注完毕。
2.2.2 内分泌毒性 23 例,发生率为11.9%,其中高血糖/糖尿病12 例、甲状腺疾病11 例。发生高血糖/糖尿病不良反应的患者中,58.3%(7/12)发生在治疗后 3~7 d,25%(3/12) 发生在治疗后 1 个月,16.7%(2/12)发生在治疗后 7~8 个月。66.7%(8/12)为一过性高血糖,无需特殊处理,但在多次输注中均有发生,33.3%(4/12)为持续性高血糖,进行口服降糖药物治疗后可控制血糖在正常范围内。甲状腺疾病不良反应发生在2~21 周,平均6 周,均为持续性发生,大部分患者无临床症状,严重患者在进行药物治疗后可恢复至正常。
2.2.3 胃肠道毒性 22 例,发生率为11.3%,其中免疫性结肠炎1 例、免疫性肝毒性21 例,发生肝毒性的患者中有90.5%(19/21)为肝癌患者。胃肠道毒性其发生时间68.2%(15/22) 在当次治疗住院期间发生,31.8%(7/22)发生在治疗后 3~14.7 周,平均6.7 周。胃肠道毒性中肝毒性患者经常规护肝治疗均可缓解,发生结肠炎的患者为3 级不良反应,予激素治疗3 周后痊愈。
2.2.4 疲乏 17 例,发生率为 8.8%,58.8%(10/17)患者在后续治疗时可多次发生。疲乏发生输注后1~3 d,无需特殊处理均可自行缓解。
2.2.5 皮肤毒性 12 例,发生率为 6.2%,83.3%(10/12)患者发生在治疗当天,另2 例分别发生在治疗后 2 周和 6 周。1、2 级(10 例)皮肤不良反应其持续时间短,一般 1~3 d 可缓解,3、4 级(2 例)皮肤不良反应其持续时间较长,分别为2 周和4 周。
2.2.6 肺毒性 5 例,发生率为2.6%,发生时间在治疗后 3~21 周,其中 4 例发生在 10 周以内,1 例发生在21 周。肺毒性发生后立即予以激素、抗感染治疗,4 例免疫性肺炎患者在1~2 周内均完全缓解,1 例患者因肺炎引起多器官衰竭最终死亡。
2.2.7 肾毒性:3 例,发生率为 1.5%,2 例发生在当次治疗住院期间,1 例发生在治疗后2 个月时。3 例均为持续性肌酐轻度升高,未予特殊治疗。
2.2.8 肌肉骨骼毒性:1 例,发生率为0.5%,发生在当次治疗住院期间并自行缓解。
2.3 基线资料与不良反应的关系
患者的性别、年龄、血常规、肝功能等基线资料与不良反应发生的关系见表2。
3 讨论
ICI 阻断T 细胞负性调控信号、解除免疫抑制,增强T 细胞抗肿瘤效应的同时,也可能异常增强自身正常的免疫反应,导致免疫耐受失衡,累积到正常组织时表现出自身免疫样的炎性反应,称为irAE[2-4]。不同ICI 信号通路的irAE 发生情况也不同,PD-1与 PD-L1 抑制剂 irAE 发生率相当(64% 比 66%)[5],CTLA-4 抑制剂irAE 发生率和严重程度明显高于PD-1/PD-L1 抑制剂[6]。本研究所用的 5 种品牌 PD-1抑制剂,相关研究显示其总体irAE 发生率为58%~94.1%,3 级以上不良反应发生率为7.0%~30.6%。(见各种药物说明书)。本组患者irAE 发生率为42.8%,3、4 级不良反应发生率为3.6%,5 级不良反应发生率为0.52%。irAE 发生率和严重程度均较低,这可能与早期用药期间对1、2 级不良反应的观察不足有关。
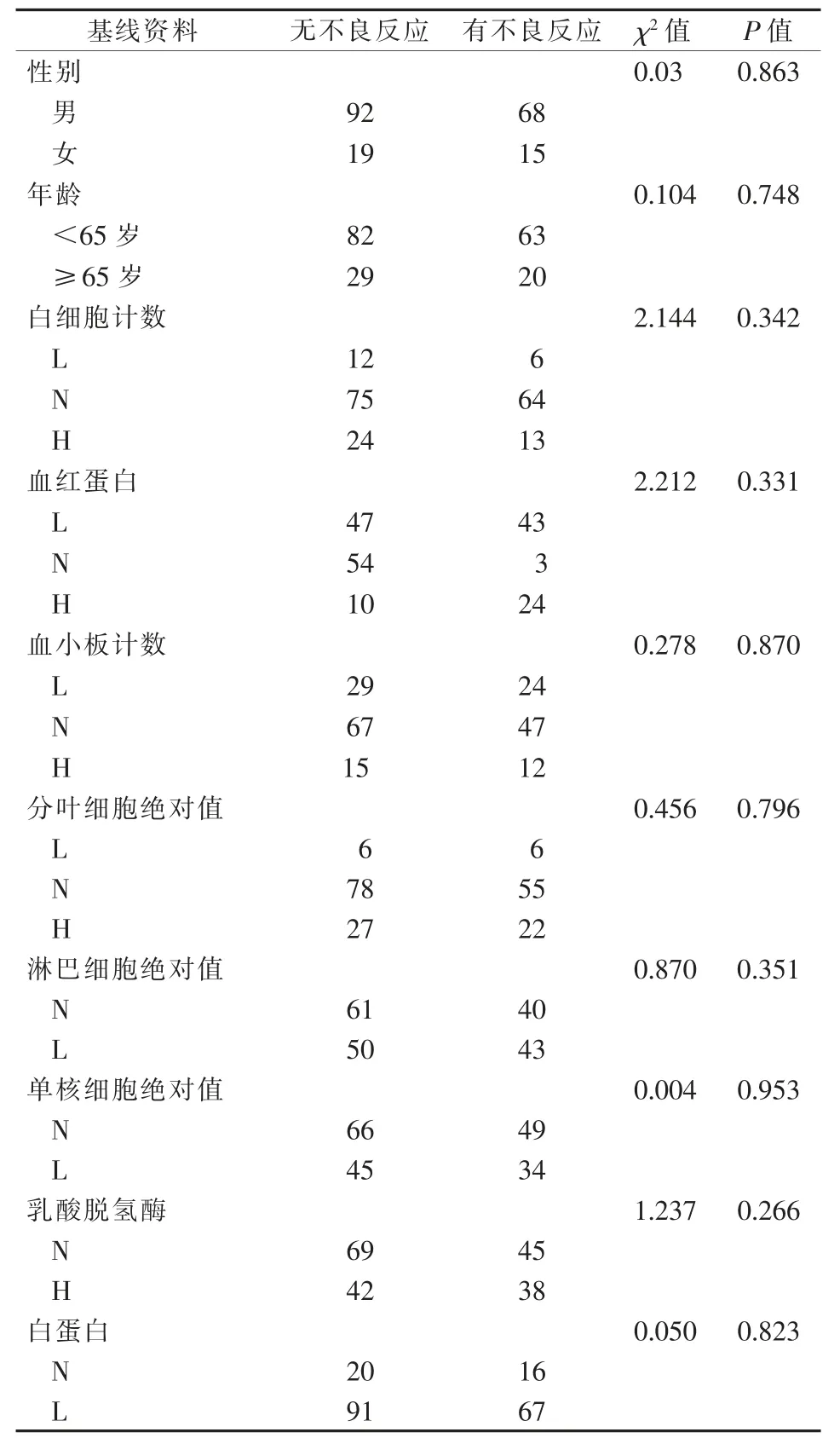
表2 不良反应发生因素 n
理论上irAE 可发生于任何组织和器官,不良反应谱广泛,其中比较常见的发生器官是皮肤(34%~45%)、内分泌(5%~10%)、肝脏(5%)、胃肠道(<19%)、肺(5%~53%)、类风湿性/骨骼肌(15%)不良反应以及输注反应(10%)等,而发生在神经(6.1%)、血液、肾脏(<5%)、心脏(<1%)以及眼(<1%)的不良反应较少见[7-8]。本组病例中,十分常见(≥10%)的不良反应是输注相关反应(17.5%)、内分泌毒性(11.9%)、胃肠道毒性(11.3%);常见(1%-10%)的不良反应是疲乏(8.8%)、皮肤毒性(6.2%)、肺毒性(2.6%)、肾毒性(1.5%);肌肉骨骼毒性仅 1 例(0.5%),眼毒性、神经系统毒性、心血管毒性本组病例未观察到发生。
本组患者中输注相关反应发生率较高,且可以多次发生,虽然反应轻微,但仍须引起重视、仔细观察。皮肤毒性发生率较低,可能与本组病例肝癌患者占53.6%,部分患者在服用靶向药物期间出现皮肤反应,难以判断是否为PD-1 单抗引起。本组病例中有103 例肝癌患者,其中77 例服用分子靶向药物治疗、26 例未服用,免疫不良反应发生率分别为49.3%(38/77)、34.6%(9/26)(P>0.05),提示是否服用分子靶向药物不影响免疫不良反应的发生。但在胃肠道毒性的肝毒性观察中显示高达90.5%(19/21)为肝癌患者,这可能与肝癌患者本身肝功能水平差有关。
本组患者中有13 例(6.7%)患者同时出现累及多个系统的不良反应,双系统9 例,三系统4 例。有报道PD-1/PD-L1 治疗肺癌的研究中发现5%(16/319)的患者出现了多系统irAE,双系统14 例;三系统2 例。其进一步研究指出已经患有肺部炎症反应、皮炎、甲状腺功能减退这3 种irAE 的患者最易产生多系统irAE。这对肿瘤免疫治疗时代的跨学科患者管理具有重要意义[9]。
既往研究表明irAE 将随时间依次出现,呈现出典型的时间分布模式,不同研究其发生时间各有不同。Eigentler 等[10]研究显示 irAE 发生时间不同,一般在1~6 个月内发生。时间跨度不一致,内分泌毒性恢复时间最长,但大部分irAE 是可逆的。Weber 等[11-12]研究显示最先出现的是皮肤相关不良反应(3 周后),随后出现胃肠道不良反应(5~10 周),内分泌疾病和肝脏相关不良反应则主要在最后出现(9~12 周)。中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南(2019)中irAE 发生时间为:皮肤(2~4 周)、肠胃(5~10 周)、肝脏(8~12 周 )、 肺 (11.2 周 )、内 分 泌 (10 ~24 周 )、肾 脏(12~ 40 周)[7]。本组病例不良反应的发生时间与上述研究基本相符。
PD-1 相关不良反应的处理应按照分级原则进行。1 级毒性可以在密切监测下继续使用PD-1;2级需暂停使用PD-1,直至症状和/或实验室指标恢复至1 级或更低,可以酌情考虑使用糖皮质激素;3级需暂停使用PD-1,并同时开始大剂量糖皮质激素治疗;4 级需要永久停止使用PD-1,建议进行多学科合作,尽早、快速处理好免疫相关性不良反应。1、2 级不良反应临床症状较轻,经对症治疗或口服激素治疗绝大多数患者可以恢复正常。3 级以上不良反应临床症状较重、风险更高,本组病例中3 级以上不良反应8 例,分别是3 级肝毒性3 例,其转氨酶升高大于正常值上限5 倍以上,经常规护肝、降酶治疗后转氨酶逐渐下降,在1 个月后复查时均恢复至正常值,未予激素治疗,其后继续使用PD-1;3级结肠炎 1 例,患者使用 3 次 PD-1 治疗,9 周时出现严重腹泻(10 次左右/d)入院,肠镜提示全大肠糜烂,结合临床病史考虑重度免疫性结肠炎,予甲强龙 2mg·kg-1·d-1冲击治疗 5 d 后症状缓解,后逐步减量过渡至口服激素维持治疗,3 周后症状完全缓解,该患者停止使用 PD-1;3 级皮肤毒性 2 例,1 例为PD-1 治疗2 周后发生严重瘙痒,另1 例为治疗当天出现严重斑丘疹,2 例均给予甲强龙2 mg/kg/d 冲击治疗3~5 d 后症状缓解,其后继续口服激素维持治疗,分别在治疗2 周、4 周后症状完全缓解,经讨论患者的风险/获益比,决定继续予PD-1 治疗,其后未再次发生严重不良反应;4 级肺炎1 例,患者使用4 次PD-1 治疗,5 个月时出现呼吸困难入院,诊断为免疫性肺炎并转重症监护室治疗,予激素冲击治疗、呼吸支持治疗、抗感染治疗2 周后病情缓解出院,患者永久停用PD-1;5 级肺炎死亡1 例,患者间歇使用2 次PD-1 治疗,10 周时出现呼吸困难入院,诊断为免疫性肺炎,患者病情进展迅速,肺炎引起多器官功能衰竭,积极治疗1 周后死亡,本例患者可能与PD-1 治疗后未能按时返院复查导致观察延迟有关,未能尽早发现和治疗免疫性肺炎。以上8 例3 级以上不良反应,7 例患者经激素冲击治疗、维持治疗和对症治疗后不良反应可完全缓解,其中5 例继续使用PD-1、2 例停用。经规范的分级处理治疗方案,大多数不良反应可以得到有效治疗和缓解。
目前,irAE 预测指标的研究尚不够广泛和深入,Fujisawa 等[13]在使用纳武单抗治疗黑色素瘤患者的过程中,发现白细胞计数增高、淋巴细胞计数降低与3、4 级irAE 和肺/胃肠道免疫相关不良反应的发生有关。Diehl 等[14]使用 PD-1 治疗实体瘤时,发现基线时淋巴细胞绝对值>2 000×106/L 患者irAE的发生风险更高。而本组研究未显示出基线资料与irAE 的相关性,irAE 预测指标值得未来进一步研究。
免疫治疗整体反应率较低,irAE 和耐药进一步限制和影响了临床应用,为提高免疫治疗反应率和治疗效果并减少irAE 的发生,在联合介入治疗方面研究显示,TACE、RFA 可使 PD-L1 表达增加[15-17],激活或增强T 细胞应答[18-19],并且也有基础研究显示,PD-1 单抗联合射频消融术(RFA)、不可逆电穿孔消融术(IRE)具有更好的疗效,联合治疗组的小鼠肿瘤内调节性T 细胞(Treg)水平显著降低,从而降低免疫抑制[17,20],而近距离放疗除可增加 PD-L1表达并与之产生协同抗肿瘤作用外,还可减少肿瘤浸润骨髓源抑制细胞(MDSC)的局部聚集[21]。因此,免疫联合介入治疗具有协同作用,临床应用值得期待和进一步研究。
PD-1 给肿瘤患者带来了新的希望,PD-1 引起的irAE 反应谱广泛且复杂。irAE 发生时间不同,一般在6 个月内发生,除内分泌器官不良反应可长期存在外,大部分irAE 是可耐受、可逆的。虽然严重不良反应的发生率较低,但一旦出现,后果比较严重,尤其需要注意的是心包炎、肺和神经系统方面的不良反应。因此,临床医师不仅要关注抗肿瘤疗效,也要重视不良反应的发生。临床医师需熟练掌握各类irAE 的诊断、分级及治疗等,做到早诊断、早治疗,使不良反应控制在较低级别,保证PD-1 应用的安全、顺利进行,为肿瘤患者带来更好的生存获益。
