不同碳源条件下金黄色蝶形担孢酵母发酵合成多糖的动力学及结构差异
2021-01-28赵英杰
赵英杰 程 新
(江西农业大学生物科学与工程学院/江西农业大学应用微生物研究所,江西 南昌 330045)
酵母胞外多糖(exopolysaccharides,EPS)是酵母菌在生长代谢过程中分泌到细胞外的一类水溶性大分子糖类物质[1]。现有研究表明,酵母菌的EPS 具有较好的体外抗氧化[2]、抗肿瘤和抗病毒活性[3-4]以及较高的化学元素结合能力[5],在食品、医药及化妆品生产等领域具有较好的应用前景。
碳源是合成EPS 的关键营养物质,其种类及含量不仅影响EPS 的产量[6-8],而且在不同碳源条件下合成的EPS 在分子结构[9]、活性[10]和理化性质等方面也存在较大差异[11]。张佳佳[12]研究了3 种碳源(葡萄糖、蔗糖、麦芽糖)对海洋假单胞菌(Pseudomonas)FT-8 的EPS 结构及理化性质的影响,所得EPS 产量分别为6.98、6.35 和5.93 g·L-1,扫描电镜显示其EPS 的固态形貌差异较大,分别呈现丝状、片状和絮状结构,同时不同碳源所得EPS 的单糖组成也有一定的差异;Fukuda等[11]研究了碳源对发酵乳杆菌(Lactobacillus fermentum) TDS030603 合成EPS 的影响,EPS 单糖组成均为葡萄糖和半乳糖,但其摩尔比存在差异。
江西农业大学应用微生物研究所前期从云南大理传统乳制品乳扇中筛选到一株高产EPS 的金黄色蝶形担孢酵母(Papiliotrema aurea)DF-12,并对其碳源利用情况进行了初步探究,结果表明在不同碳源条件下,EPS 产量的差异较大,其中葡萄糖和蔗糖产量较高,同时该菌株也能利用糖蜜合成EPS。在前期研究的基础上,本试验首先从动力学角度分析了金黄色蝶形担孢酵母利用不同碳源对其生长、产物合成及底物消耗的差异性,然后用离子交换色谱和凝胶色谱分离纯化EPS,并对其结构特征的差异进行分析比较,以期为金黄色蝶形担孢酵母所产EPS 的进一步开发利用奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种 从云南传统乳扇中筛选的金黄色蝶形担孢酵母(P.aurea)DF-12。
1.1.2 培养基 酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YEPD):葡萄糖20 g、蛋白胨20 g、酵母浸粉10 g、蒸馏水1 L;基础产糖培养基:葡萄糖50 g、硫酸铵2 g、磷酸二氢钾1 g、酵母浸粉1 g、氯化钙0.1 g、吐温-80 1 mL、蒸馏水1 000 mL,pH 值6.0;不同碳源产糖培养基:以相同质量浓度的蔗糖及糖蜜替代基础产糖培养基中的葡萄糖;不同碳源浓度培养基:分别以30、40、50、60 g 葡萄糖、蔗糖及糖蜜代替基础产糖培养基中的碳源;以上培养基均在100 kPa、121℃高压灭菌20 min。
1.2 主要仪器与设备
JW-3022HR 高速冷冻离心机,安徽嘉文仪器装备有限公司;LXJ-IIB 低速大容量多管离心机,上海安亭科学仪器厂;721 可见分光光度计,上海佑科仪器仪表有限公司;LDZX-50KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;LRH-250-C 培养箱,韶关市泰宏医疗器械有限公司;LT1002B 电子天平,常熟市天量仪器有限责任公司;BSZ-100 自动收集器,上海青浦泸西仪器厂;FEI Quanta 250 型扫描电子显微镜、Spectrum Two FT-IR 傅里叶变换红外光谱仪,美国Perkin-Elmer;金普GC8890气相色谱仪,山东金普分析仪器有限公司;HH 恒温水浴锅,金坛市中大仪器厂;LT1002B 电子天平,常熟市天量仪器有限公司;LC-10A 高效液相色谱仪、RID-10A 示差检测器,日本岛津公司。
1.3 试验方法
1.3.1P.aureaDF-12 的分批发酵培养及测定方法
1.3.1.1 培养方法 将酵母菌挑取一环接种于YEPD培养基,培养至对数期,作为种子液。将种子液按2%的接种量接种至相同浓度的不同碳源发酵培养基,于28℃、180 r·min-1摇床培养,定时取样,测定其菌体生物量(OD600)、发酵液pH 值、EPS 产量及残糖浓度。
1.3.1.2 生物量的测定 取适量发酵液,将发酵液于8 000 r·min-1离心10 min,并用无菌水洗涤菌体2 次,复悬,于600 nm 波长处测定其吸光度值(OD600)。
1.3.1.3 EPS 产量的测定 将发酵液于10 000 r·min-1离心10 min,取适量上清液用三氯乙酸法除蛋白,10 000 r·min-1离心10 min,弃去蛋白沉淀后,小心吸取上清液加入3 倍体积的无水乙醇,于4℃冰箱中静置过夜,10 000 r·min-1离心10 min,所得沉淀用适量蒸馏水溶解,用苯酚-硫酸法测定EPS 产量[13]。
1.3.1.4 残糖浓度的测定 葡萄糖作为碳源的培养基,以二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定其残糖浓度[14];以蔗糖和糖蜜为碳源的培养基,残糖浓度用总糖浓度减去EPS 含量表示,总糖浓度用硫酸苯酚测定[13]。
1.3.2 不同碳源条件下所合成EPS 的体外抗氧化活性测定 参照文献测定EPS 的DPPH 自由基清除率[15-16]、羟基自由基清除率[17]、超氧阴离子自由基清除率[17]及还原力[18]。均以维生素C(Vitamin C,Vc)作阳性对照。
1.3.3 不同碳源条件下所合成EPS 的分离纯化
1.3.3.1 粗EPS 的制备 挑取一环酵母菌接种于YEPD 培养基,培养至对数期,作为种子液。将种子液按2%的接种量接种至相同浓度的不同碳源发酵培养基,于28℃、180 r·min-1摇床培养168 h。将发酵液于10 000 r·min-1离心10 min,取适量上清液用三氯乙酸法除蛋白,10 000 r·min-1离心10 min,弃去蛋白沉淀后,小心吸取上清液加入3 倍体积的无水乙醇,于4℃冰箱中静置过夜,10 000 r·min-1离心10 min,将所得沉淀冷冻干燥即为粗EPS[19]。
1.3.3.2 DEAE 纤维素DE-52 离子交换柱层析 取10 mL 10 mg·mL-1粗EPS 溶液,用0.22 μm 的微孔滤膜过滤后,加样于层析柱(2.6 cm×50 cm)中,分别用去离子水(1 ~20 管)、0.1 mol·L-1NaCl(21 ~40 管)、0.3 mol·L-1NaCl(41 ~60 管)和0.5 mol·L-1NaCl(61~80 管)溶液进行梯度洗脱,流速为1 mL·min-1,分别收集洗脱液(10 mL/管),用苯酚-硫酸法跟踪检测,以各管在490 nm 波长处的吸光度值为纵坐标,收集的管数为横坐标作图,得到洗脱曲线[20]。收集不同洗脱梯度下相应的组分,合并相同组分,浓缩后用去离子水透析3 d 以去除小分子杂质,将透析液浓缩后,再真空冷冻干燥,得到EPS 经DEAE 纤维素DE-52 分离的组分。
1.3.3.3 Sephadex G-100 凝胶柱层析 准确称取经DEAE 纤维素DE-52 分离后的各多糖组分1 mg,溶于2 mL 去离子水中,用胶头滴管吸取样品,沿色谱柱柱壁圆周缓缓加入已平衡的Sephdex G-100 层析柱(2.6 cm× 50 cm) 中,用去离子水洗脱,流速为0.2 mL·min-1,分部收集洗脱液(2 mL/管)用苯酚-硫酸法跟踪检测,以各管在490 nm 波长处的吸光度值为纵坐标,收集的管数为横坐标作图,得到洗脱曲线[21]。同时合并各吸收峰的洗脱液,减压浓缩,用去离子水透析3 d 以去除小分子杂质,将透析液真空冷冻干燥,得到纯化后的EPS。
1.3.4 不同碳源条件下所合成EPS 的结构分析
1.3.4.1 分子量测定 采用高效凝胶渗透色谱法测定。精密称取1.3.3.3 纯化后的胞外多糖配制成5 mg·mL-1溶液,12 000 r·min-1离心10 min,上清液用0.22 μm 的微孔滤膜过滤,然后将样品转置于1.8 mL进样小瓶中,进样量20 μL。以不同相对分子质量的葡聚糖(1 152、11 600、23 800、48 600、80 900、148 000、273 000、409 800)作为标准品,做出标准曲线,测定EPS 的纯度及相对分子质量。流动相为0.05 mol·L-1NaCl,流速0.6 mL·min-1,柱温40℃。
1.3.4.2 扫描电镜观察 取少量纯化的EPS 组分冻干物,固定于扫描电镜铜台上,喷金,置于扫描电子显微镜下观察。
1.3.4.3 红外光谱分析 取适量纯化得到的EPS 加入KBr 压片制样,在4 000 ~400 cm-1区间内用傅里叶变换红外光谱仪扫描红外线被吸收的情况[22]。
1.3.4.4 气相色谱分析 称取5 mg 纯化的EPS 置于安瓿瓶中,加入2 mL 2 mol·L-1三氟乙酸,封口后于120℃水解2 h,然后将水解物减压蒸干,反复加入甲醇减压蒸干以除去残留的三氟乙酸。采用糖腈乙酰酯化法,先向减压蒸干的样品中加入0.6 mL 吡啶以溶出样品,然后再加入8 mg 肌醇六乙酰酯和10 mg 盐酸羟胺,90℃水浴30 min 后冷却至室温,再加入1 mL 乙酸酐继续水浴30 min,待冷却至室温后,用0.45 μm 滤膜过滤后采用气相色谱仪分析。单糖标准品同上述操作[23-24]。
1.4 动力学模型[25]
1.4.1 菌体生长动力学模型的建立 利用Logistic 方程建立P.aureaDF-12 的菌体生长动力学模型,Logistic 方程为:

式中,X 为细胞质量浓度,g·L-1;μ为比生长速率,h-1;t表示时间,h;下标max 表示最大值。对式(1)积分,并代入X=X0(下标0 表示t=0 时刻的值),可得到生物量与时间函数:

将X(t)对时间t进行非线性拟合,获得最大比生长速率(μmax)、X0以及Xmax。相关系数(R2)可评价模型拟合程度。
1.4.2 产物合成动力学模型的建立
EPS 合成采用Luedeking-piret 模型:
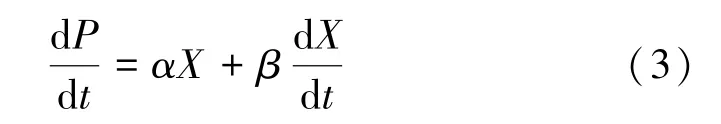
式中,P为产物浓度,g·L-1;α,β是经验常数,和αX分别表示生长关联与非生长关联的EPS 合成速率。将式(2)带入式(3),得:
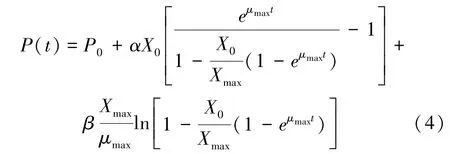
将P(t)对t进行非线性拟合,可获得α、β及初始P0,R2可评价模型拟合程度。多糖比生产速率可由式(3)计算获得。即
1.4.3 底物消耗动力学模型的建立 底物消耗采用Herbert-pirt 方程模型:

式中,ke为细胞维持系数;YX为菌体对基质的得率系数;S为基质浓度,g·L-1;YP为产物对基质的得率系数。将式(3)代入式(5),得:

式中,m,n为常数,和nX分别表示生长关联和非生长关联底物消耗速率。将式(2)代入式(6),积分得:

将S(t)对t进行非线性拟合,可获得模型参数m、n、初始值S0。R2可评价模型拟合程度。底物比消耗速率可由式(6)计算获得。即=-mμ -n。
1.5 数据分析
每个处理设3 个重复,采用OriginPro 9.1 软件进行数据处理及拟合。
2 结果与分析
2.1 不同碳源对P.aurea DF-12 合成EPS 的影响
2.1.1 不同碳源对P.aureaDF-12 生理代谢的影响
由图1 可知,当以葡萄糖或蔗糖作为碳源时,酵母菌的发酵代谢较为一致,且发酵的EPS 的产量较高,均大于4 000 mg·mL-1。而以糖蜜作为碳源时,虽然微生物的生长速度较为迅速,但EPS 产量较低,且发酵特征与葡萄糖、蔗糖相差较大,发酵液pH 值在后期呈明显的上升趋势,且残糖浓度下降得更为迅速,这与Grigorova等[26]的研究结果一致。
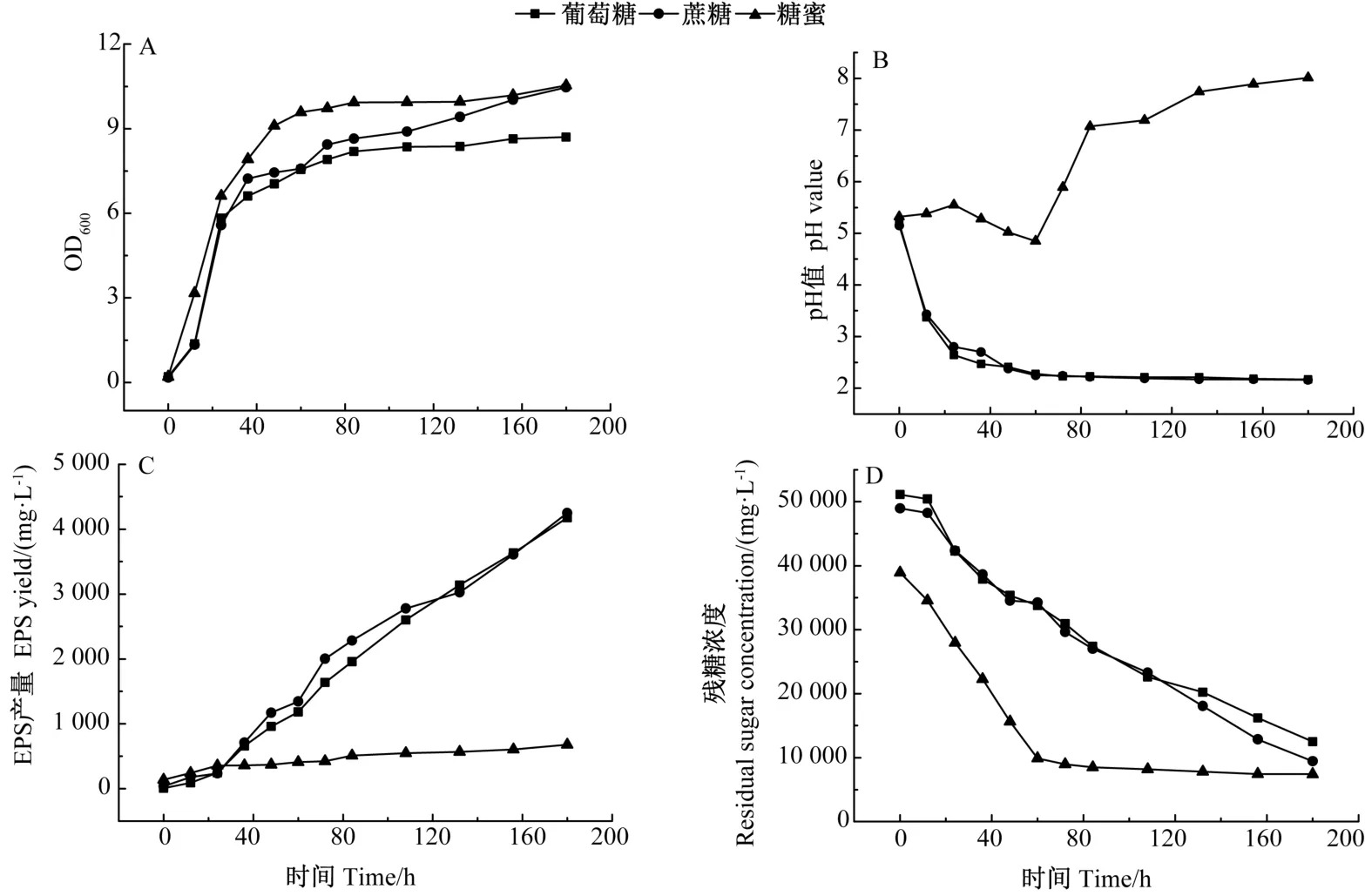
图1 不同碳源条件下P.aurea DF-12 生理代谢特征比较Fig.1 Comparison of physiological and metabolic characteristics of P.aurea DF-12 under different carbon sources
2.1.2 不同碳源条件下的菌体生长、多糖合成及底物消耗动力学模型拟合 分别采用Logistic、Luedeking-Piret 以及Herbert-pirt 方程建立P.aureaDF-12 合成EPS 过程中生物量的变化、产物合成和基质消耗,各模型的参数值见表1,各试验组的模型拟合R2均大于0.9,3 种模型均可以很好地拟合试验值(图2),可以用来描述P.aureaDF-12 动力学特征。
由表1 可知,以葡萄糖为碳源时,P.aureaDF-12的最大比生长速率μmax约为0.15 h-1,而以蔗糖和糖蜜为碳源时,μmax均约为0.11 h-1。在产物合成方面,以蔗糖为碳源能获得最大多糖比生产速率(11.95 h-1),而以糖蜜为碳源时的最大多糖比生产速率仅为2.37 h-1;另外3 种碳源模型中,代表与菌体生长相关的产物形成参数α和代表与菌体生长非相关的产物形成参数β均不为0,说明P.aureaDF-12 的EPS 合成为部分生长偶联型。从底物消耗角度来看,以糖蜜为碳源时,其最大底物比消耗速率较大,达328.73 h-1,而以蔗糖为碳源时最低,为149.36 h-1。
2.1.3 不同碳源浓度对P.aureaDF-12 生理代谢的影响 由图3 可知,碳源浓度对生物量及pH 值均无较大影响,但葡萄糖和蔗糖浓度对EPS 产量有一定的影响,前期EPS 均较快积累,当葡萄糖浓度为30 g·L-1时,发酵72 h 后EPS 产量基本保持不变,最终产量仅为3 000 mg·L-1,当蔗糖浓度为30 g·L-1时,EPS 产量增长也于发酵72 h 后变缓慢,这可能与培养基中碳源被消耗殆尽有关;当碳源浓度为40 ~60 g·L-1时,EPS产量在发酵72 h 后仍呈较快增长趋势,且随着碳源初始浓度的升高,生物量有一定的增加,但EPS 产量并无较大提升,另外,碳源浓度较高的培养基中,所剩残糖较多。此外,在本试验范围内,糖蜜浓度对P.aureaDF-12 的生物量、pH 值及EPS 产量均无较大影响。
由于以糖蜜为碳源时获得的EPS 产量较低,因此选用葡萄糖和蔗糖为酵母菌发酵碳源,对其发酵所得EPS 的性质做进一步分析。
2.1.4P.aureaDF-12 在不同碳源条件下所合成EPS的体外抗氧化活性 以Vc 作为阳性对照,测定在以葡萄糖和蔗糖为碳源时所产EPS(分别简称为G-EPS和S-EPS,下同)对DPPH 自由基清除率、羟基自由基清除率、超氧阴离子自由基清除率及其还原力,结果如图4 所示。随着EPS 浓度的升高,G-EPS 和S-EPS 对3种自由基清除率及其还原力均逐渐增高,但G-EPS 的还原力及其对DPPH 自由基清除率较S-EPS 高,可见碳源种类不同对合成EPS 的抗氧化活性有一定影响。
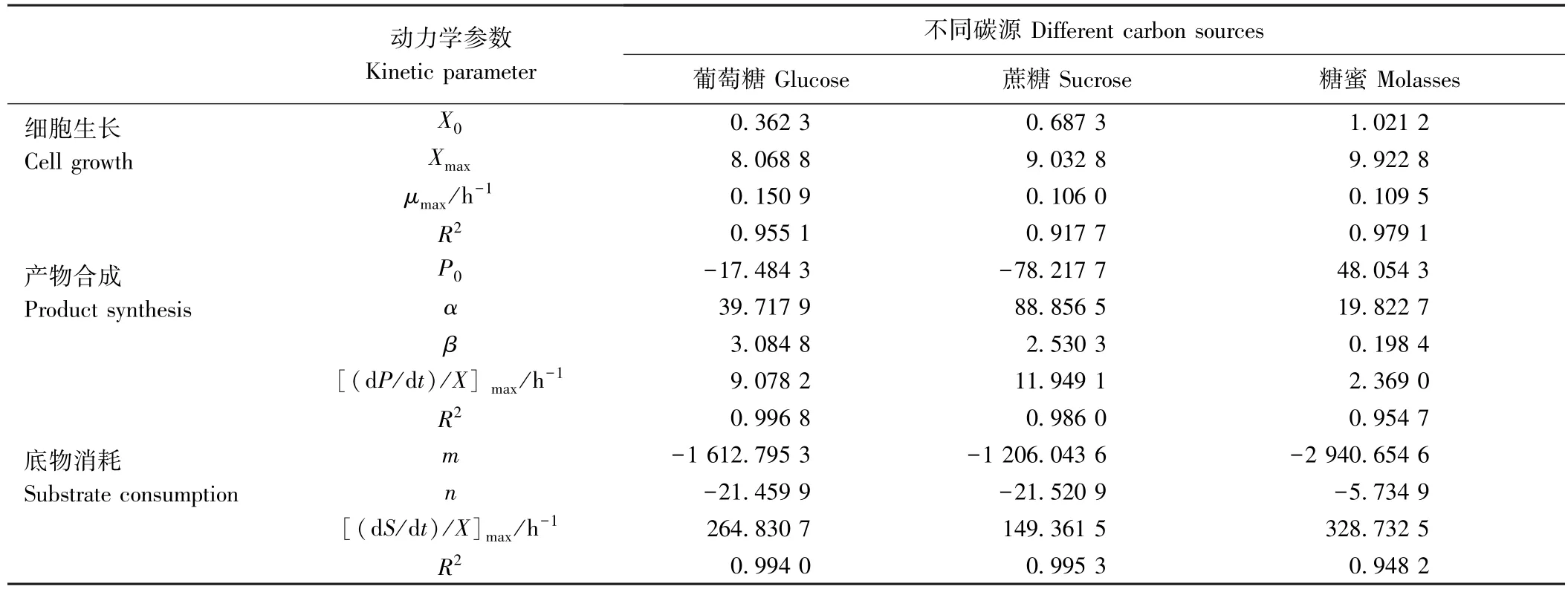
表1 不同碳源对EPS 分批发酵过程动力学参数的影响Table 1 Effects of different carbon sources on kinetic parameters of batch fermentation of EPS

图2 P.aurea DF-12 分批发酵动力学试验值和模型值的比较Fig.2 Comparison of experimental values and model values of batch fermentation kinetics of P.aurea DF-12
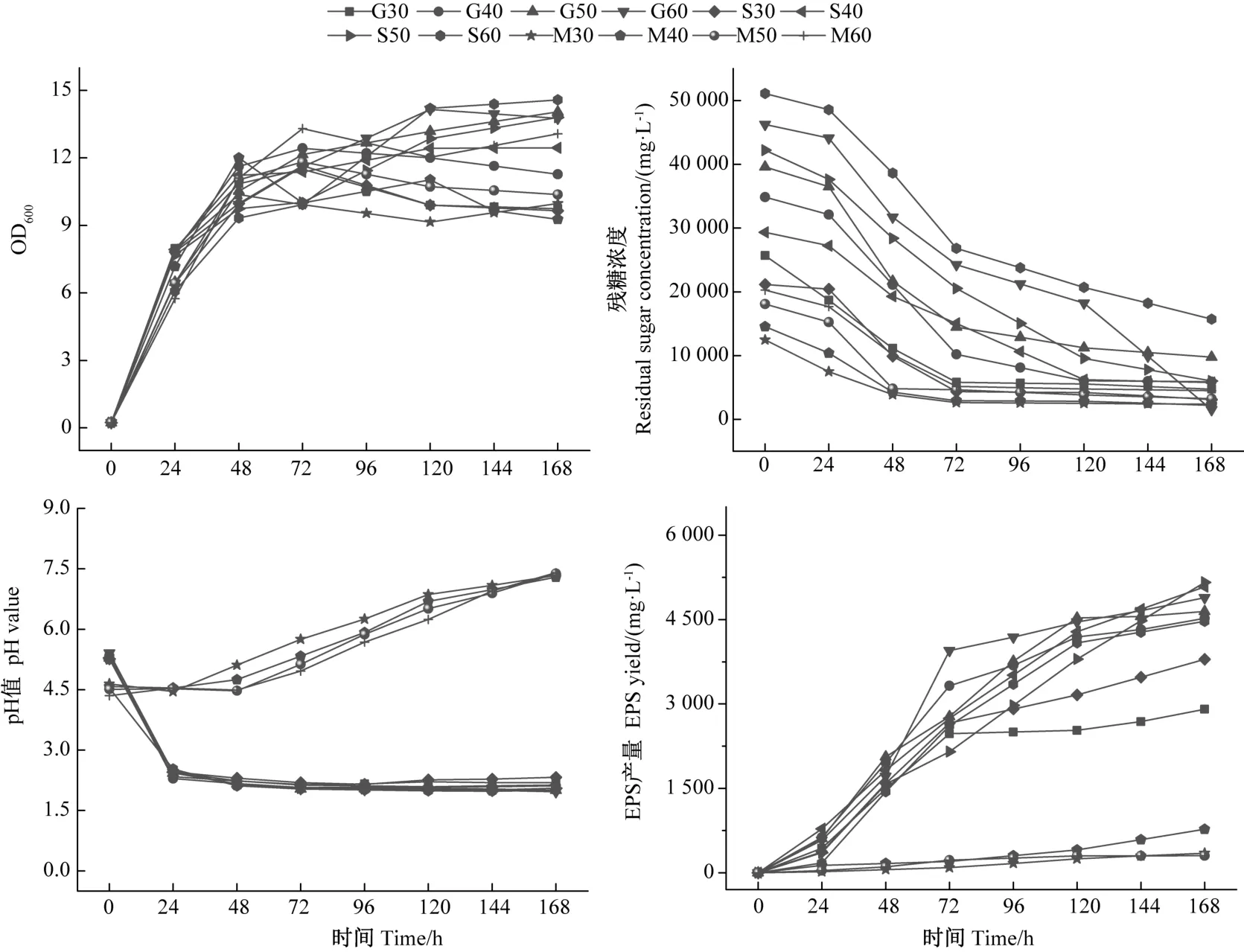
图3 不同碳源浓度条件下P.aurea DF-12 生理代谢特征比较Fig.3 Comparison of physiological Metabolism characteristics of P.aurea DF-12 under different carbon Source concentrations

图4 不同碳源条件下的EPS 对DPPH 自由基清除率、羟基自由基清除率、超氧阴离子自由基清除率及还原力Fig.4 Scavenging rate of DPPH radical,scavenging rate of hydroxyl radical,scavenging rate and reducing ability of superoxide anionic radical by EPS under different carbon sources
2.2 EPS 分离纯化及其结构和单糖组成分析
2.2.1 EPS 经DEAE 纤维素DE-52 离子交换柱层析纯化结果 发酵所得G-EPS 和S-EPS 经DEAE 纤维素DE-52 离子交换柱层析分离后,以各管在490 nm波长处的吸光度值和NaCl 浓度为纵坐标,收集的管数为横坐标作图,得到洗脱曲线如图5 所示。结果表明,经NaCl 溶液梯度洗脱后,G-EPS 分离得到3 种组分:G1、G2、G3(63 含量较少,未做进一步研究)(图5-A),S-EPS 分离得到2 种组分:S1 和S2(图5-B)。G1和S1 均为去离子水洗出,属中性多糖;G2 和S2 为0.1 mol·L-1NaCl 溶液洗出,为酸性多糖。

图5 P.aurea DF-12 的胞外多糖纤维素柱层析的洗脱曲线Fig.5 Eluvial curve of exopolysaccharide cellulose column chromatography for P.aurea DF-12
2.2.2 EPS 经Sephadex G-100 凝胶柱层析纯化结果 2 种碳源合成的EPS 经DEAE 纤维素DE-52 离子交换层析柱梯度洗脱得到的G1、G2、S1 和S2,4 种组分经Sephadex G-100 凝胶柱洗脱曲线见图6,可以看出4 种组分均呈现单一对称峰,表明4 种多糖为分子量相对均一的组分,但出峰时间稍有不同。
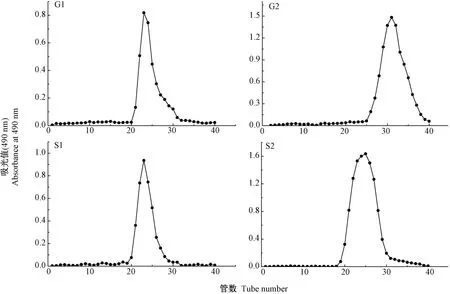
图6 4 种EPS 组分SephadexG-100 柱层析的洗脱曲线Fig.6 SephadexG-100 gel filtration chromatograms of four EPS components
2.2.3 分子量测定 通过高效凝胶渗透色谱测定EPS 组分G1、G2、S1 和S2 分子量和纯度,4 种组分均为单一对称峰,说明其纯度较高。lgMw-RT 校正曲线方程为:y=-0.246 7x+14.099,R2=0.993 1;根据其出峰时间对比葡聚糖分子量标准曲线,得出G1、G2、S1和S2 的重均分子量分别为1.80×106、2.06×106、2.03×106、1.83×106。
2.2.4 扫描电镜 在扫描电镜下放大200 倍和800倍观察以葡萄糖和蔗糖为碳源所合成的EPS 组分G1、G2、S1 和S2 的表面形态(图7),G1 表面呈碎屑状,G2 为较小的絮状,S1 则为较大的片状,S2 为较大的絮状。

图7 扫描电镜观察Fig.7 Scanning electron microscope observation
2.2.5 红外光谱分析 研究表明,糖类C-OH 的OH伸缩振动吸收峰位于3 570 ~3 050 cm-1区域内,在糖类化合物中,由于存在多个羟基,通常出现多个振动吸收峰,形成宽的吸收带。2 925~2 935 cm-1区域内为烯烃CH2伸缩振动,1 730~1 630 cm-1是C=O 的伸缩振动,1 060~1 030 cm-1为S=O 的伸缩振动[27]。由图8可知,4 种组分均存在O-H、CH2、C=O 及S=O 伸缩振动,仅G1 存在1 365 cm-1处的振动,该处为NO2的伸缩振动。
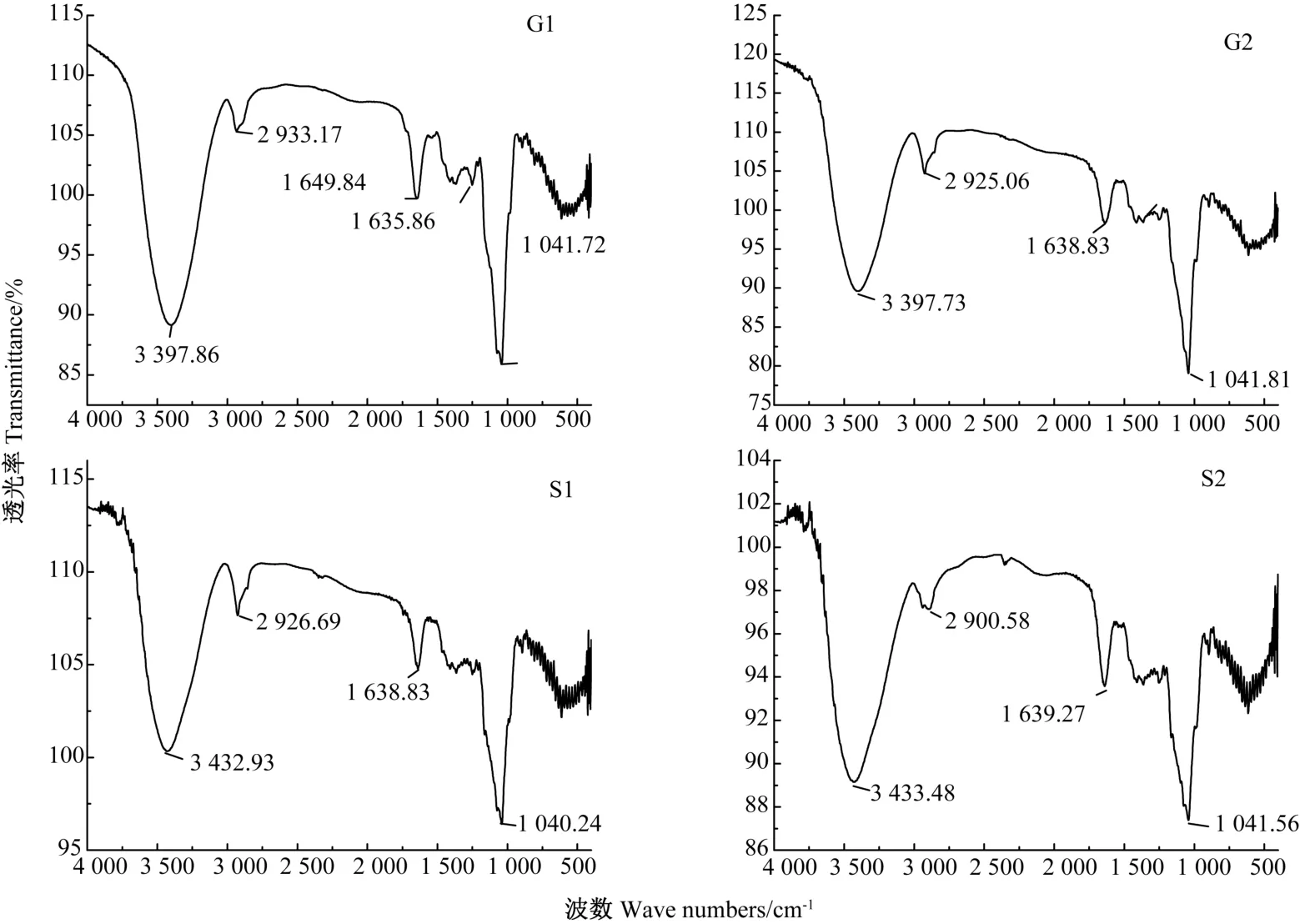
图8 G1、G2、S1 和S2 红外光谱图Fig.8 Fourier transforn infrared spectrum of G1、G2、S1 and S2
2.2.6 单糖组成分析 单糖标品和EPS 组分G1、G2、S1 和S2 完全水解后经糖腈乙酰酯衍生化法的气相色谱图结果如图9 所示,根据保留时间对比可知,4种多糖组分的水解产物对应的单糖从左到右分别是L-岩藻糖、L-鼠李糖、D-甘露糖、D-葡萄糖、肌醇六乙酰酯。根据内标法计算出各组分的摩尔比,结果如表2 所示,4 种EPS 组分的均含有岩藻糖、鼠李糖、甘露糖及葡萄糖,中性多糖组分G1 和S1 均含有较多的甘露糖和葡萄糖,而同为酸性多糖的G2 和S2 中,岩藻糖和鼠李糖占较大比例。
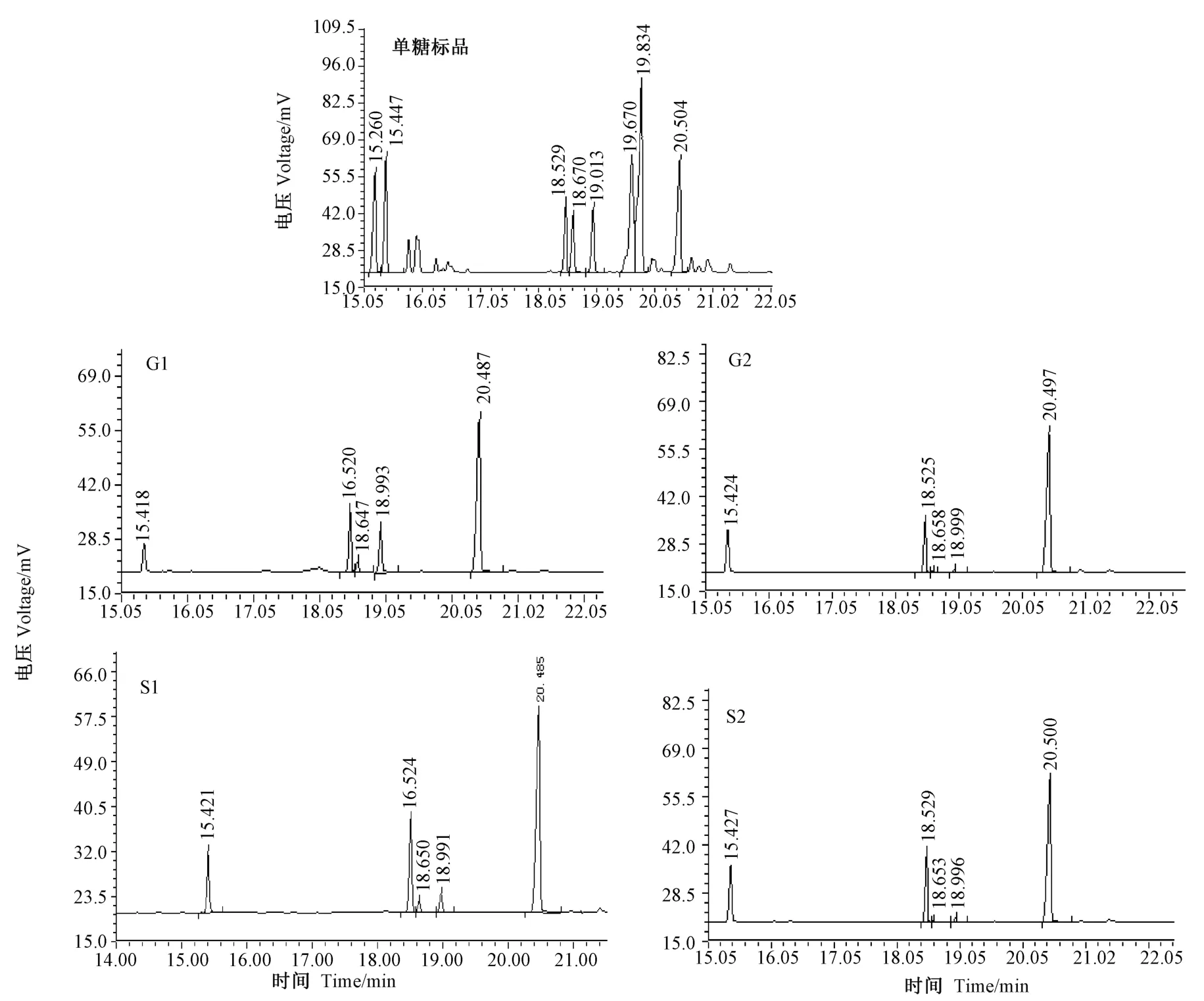
图9 单糖标品、G1、G2、S1 和S2 的气相色谱结果图Fig.9 Gas chromatograms of monosaccharides composition,G1,G2,S1 and S2

表2 G1、G2、S1 和S2 的单糖组成摩尔比Table 2 The molar ratio of monosaccharide to S2,G2,S1 and S2
3 讨论
发酵动力学是研究微生物代谢与环境之间相互作用随时间变化规律的一门学科。通过不同的工艺条件和发酵参数建立菌体生长、产物合成、底物消耗模型,能深入了解菌体的生理代谢特性,为发酵生产工艺的调节控制提供理论依据。通过研究不同碳源对P.aureaDF-12 发酵动力学的影响,发现葡萄糖是P.aureaDF-12 较容易利用的碳源,蔗糖可能是P.aureaDF-12 合成EPS 最优的碳源,糖蜜的多糖比生产速率远低于碳源为葡萄糖和蔗糖时的比生产速率,表明以糖蜜为碳源可能不利于EPS 的合成,因此,为了获取更高的产物合成效率,选择葡萄糖或蔗糖作为碳源。本研究发现,初始碳源浓度对酵母菌体生长及产物合成均有一定的影响,葡萄糖或蔗糖初始浓度较低时不利于EPS 的合成。
细胞内的自由基主要有羟基自由基、超氧阴离子自由基、羧基自由基、酯氧自由基等。细胞内的自由基过量堆积,会引起氧化应激反应,过量的自由基会攻击生物大分子,加快机体衰老。目前已有多种化学分析法可以用来评价产物的体外抗氧化活性,如ABTS 自由基清除、DPPH 自由基清除、超氧阴离子自由基清除、羟基自由基清除、脂质过氧化和还原力测定等试验[28]。已有研究表明,多种酵母EPS 均具有一定清除自由基的能力[29-30]。本研究结果表明碳源的不同对合成EPS 的抗氧化活性有一定影响,可能是与不同碳源条件下合成EPS 的结构不同相关。
现有研究报告大多是对单一碳源条件下酵母EPS的结构及活性进行研究,针对碳源对EPS 结构影响的报道甚少。本研究中,以葡萄糖和蔗糖为碳源合成的EPS 经分离纯化后得到4 种EPS 组分,4 种组分纯度均较高,其分子量无较大差异,组分G1 与S2、G2 与S1分子量大致相同;扫描电镜观察发现,以葡萄糖和蔗糖为碳源合成的EPS 表面结构可能存在一定的差异。通过红外光谱鉴别多糖中存在的化学键和官能团,发现4 种组分均存在O-H、CH2、C=O 及S=O 伸缩振动,仅G1 存在NO2振动。碳源的差异对微生物合成的EPS 单糖组成会产生一定的影响。刘翠平等[31]研究碳源对干酪乳杆菌(Lactobacillus casei)LC2W 合成EPS 组成的影响,发现以葡萄糖为碳源合成EPS 的单糖组成为鼠李糖、 葡萄糖和半乳糖,而以乳糖为碳源合成的EPS 单糖组成为甘露糖、葡萄糖和半乳糖。Smiderle 等[32]研究了不同碳源对肺形侧耳(Pleurotus pulmonarius)合成EPS 的影响,结果表明,碳源对EPS单糖组成无较大影响,所有碳源合成的胞外多糖均含有甘露糖、半乳糖和葡萄糖,但对EPS 产量及单糖摩尔比有一定影响,其中以半乳糖为碳源获得的EPS 产量最高,达0.42 g·L-1;Freitas 等[33]研究发现葡萄糖和木糖合成的EPS 与甘油所产生的EPS 具有相同的糖组分(岩藻糖、葡萄糖、半乳糖和葡萄糖醛酸),但其单糖摩尔比有所不同。本研究的P.aureaDF-12 在不同碳源条件下,合成的EPS 单糖组成一致,但各单糖摩尔比存在一定差异,这与前人研究结果一致。
4 结论
本研究探讨了分别以葡萄糖、蔗糖及糖蜜为碳源条件下,P.aureaDF-12 发酵动力学的差异,结果表明葡萄糖和蔗糖均可获得较好的生长与EPS 合成效率,其中蔗糖是P.aureaDF-12 合成EPS 最优的碳源。体外抗氧化活性试验表明,以葡萄糖为碳源合成的EPS(G-EPS)对DPPH 自由基清除率及其还原力较以蔗糖为碳源合成EPS(S-EPS)稍高,可见碳源的选择对合成的EPS 的抗氧化活性有一定影响。G-EPS 和S-EPS 经离子交换柱层析及葡聚糖凝胶柱层析分离纯化后得到4 种EPS 组分G1、G2、S1 和S2,除扫描电镜有一定差异外,高效液相色谱仪、红外光谱及气相色谱分析发现4 种组分的分子量、化学键、官能团和单糖组成均无较大差异。本研究结果为EPS 发酵生产工艺中碳源的选择及优化提供了一定的理论依据。
