在用医疗设备故障及不良事件监管系统的研究与应用
2021-01-26赵观宇
赵观宇
北京网来天下医疗科技有限责任公司 产品运营部,北京 101312
引言
现阶段,人类疾病的诊治和康复过程中使用到大量的医疗器械,因此社会公民群众开始提起对医疗器械使用质量的重视。医院是医疗器械的主要使用单位,在疑似医疗器械不良事件的调查中具有更重大的责任[1]。为保障患者用械安全,通过对可疑医疗设备和器械不良事件相关质控管理工作,防止不良事件重复发生,降低使用医疗器械的相关风险,医院可疑医疗器械不良事件监测的质控管理工作不容小觑[2]。我国目前已经建立了“国家医疗器械不良事件监测信息系统”,同时各省也已建立了监测中心。但目前我国医疗设备不良事件监测报告仍存在诸多问题,如报告数与实际发生数相差悬殊,应作为报告主体的企业主动调查不良事件比较缺位、报告率过低[3]。个人因素、医院方面、报告程序繁琐、报告制度和流程设计问题是影响医疗安全不良事件上报的主要因素[4]。当前可疑不良事件的上报主要由临床医护人员进行,而临床医护人员存在一些切实的困难,主要包括:工作繁忙,没有空余时间上报;未受到专业培训,不能及时识别医疗设备不良事件;没有上报医疗设备不良事件的动力等。同时,因医院内负责医疗设备不良事件监测工作的医务工作者业务水平较低,对报表填写的重视度不高,导致所填报信息的空缺率较高。
美国作为医疗器械不良事件监测工作起步较早的国家,监管体系较为成熟全面,其中,医疗器械不良事件报告数据库是上市后监测的重要工具之一[5]。美国食品药品监督管理局(Food and Drug Administration,FDA)利用医疗器械不良事件报告(Medical Device Reporting,MDR)来报告发现潜在的器械相关的安全性问题,并对产品进行风险利益评估[6]。FDA的医疗器械不良事件报告分为两类,一种是强制报告,由制造商、进口商及使用单位提交,《美国食品药品和化妆品法》(21CFR803,联邦法规第21款第803部分)赋予FDA收集强制报告的权力;另一种是自愿报告,由公众提交[7]。制造商和使用机构器械使用经历数据库(Manufacturer and User Facility Device Experience(MAUDE)database)对一般公众完全开放,为公众参与提供了渠道和途径。
因此,本文希望借用公众参与的概念,设计一种易于操作的医疗设备故障及不良事件监管系统,让医疗设备不良事件的利益相关者,包括设备管理人员、设备使用人员、受益的病患及其家属都能够参与到医疗器械不良事件的上报工作中来。
1 系统设计
1.1 设计思路
经过长期实践经验,结合本系统的需求和特点,在用医疗设备故障及不良事件监管系统拟采用分层结构,并采用SSH的技术框架进行实现,用分层的方法提高应用程序的可维护性,使其更容易扩展。
1.2 技术架构
在用医疗设备故障及不良事件监管统依托于好医工APP。其中,Web 层和后台系统是 B/S 结构,手机端和后台系统是C/S 结构,后台系统为了支持两种访问方式的接入,可提供统一的访问数据接口。
在用医疗设备故障及不良事件监管系统后台服务器软件基于三层平台结构,即终端接口层、应用逻辑层和数据库服务器层。为了高可用性和反应速度,抛弃原有传统的三层平台结构,在架构上采用分布式的结构,提供稳定可靠、速度快、高可用、可扩容的系统;在用医疗设备故障及不良事件监管系统开发服务后台服务器软件可以实现多个服务器分布式部署并扩容。平台构架设计及基于网络平台的总体构架如图1所示。
整个系统总体上采用三层结构,分别为表示层、应用服务层和数据服务层。通过浏览器或手机调用或访问平台的各子系统。总体构架如图2所示。
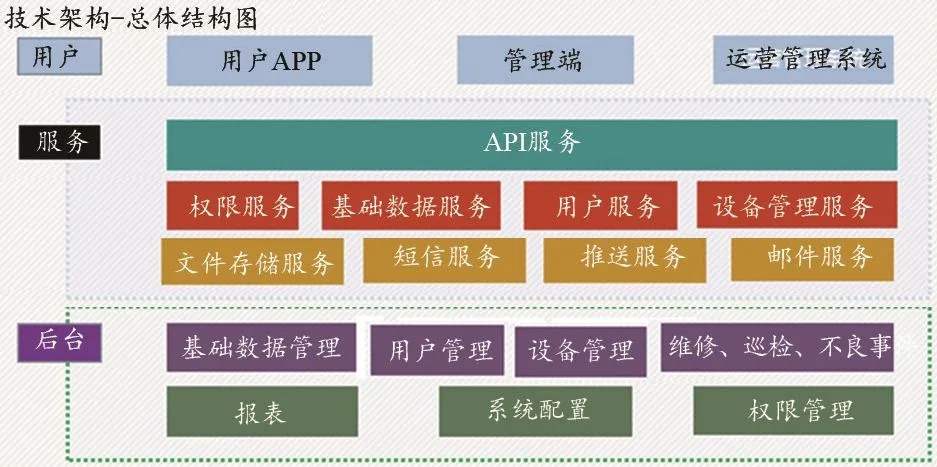
图1 平台构架设计及基于网络平台的总体构架
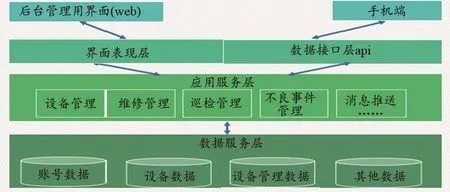
图2 系统总体架构图
2 系统功能介绍
在医院里的每一个科室都有医疗设备的存在,不仅涉及的种类多,而且型号、数量也十分庞大,随着现代医疗设备的发展和完善,医疗设备的更新也不断加快,医院在进行管理的时候也有很多麻烦。如果在现代医疗设备的管理中仍然采用传统的人工记录方式对医疗设备进行管理,不仅工作量大,同时对于各项数据的统计也有很大的不便[8]。
因此,本文对医院的医疗设备管理情况深入研究,从设备信息、日常巡检、故障情况及维修进度、不良事件上报、医疗设备数据统计五个方面设计医疗设备管理系统,对应研发了医院设备管理模块、日常巡检模块、故障维修模块、不良事件模块及数据统计模块五大管理模块(见图3)。
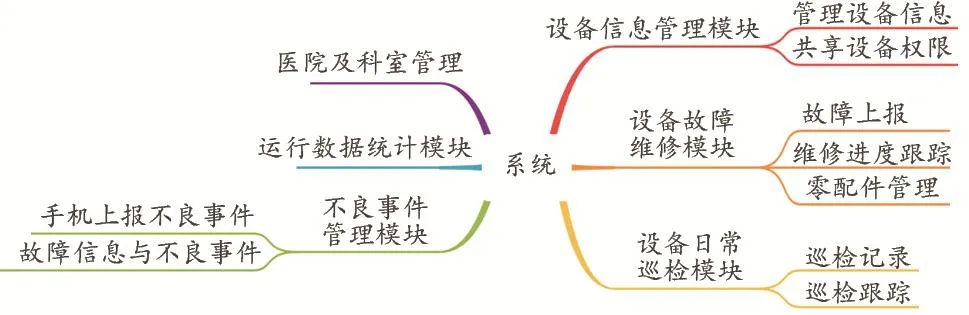
图3 系统五大管理模块思维导图
2.1 设备信息管理模块
设备信息管理模块切合医院实际需求,设计设备信息管理功能。该模块的界面不仅可以清晰展现医院各个设备的名称、品牌、型号、所在科室,也能集中呈现设备的工作状态、在保状态及维修状态(见图4)。各科室工作人员可以设置医院负责人为管理者。此时,医院负责人看到的设备信息可以与各科室人员添加的信息同步,方便统一管理。
点击想要查看的设备,即可进入到此设备的详细界面,在此界面可以看到此设备的相关责任人、不良事件统计、维修记录、巡检记录、质控计量及保修卡状态(见图5)。
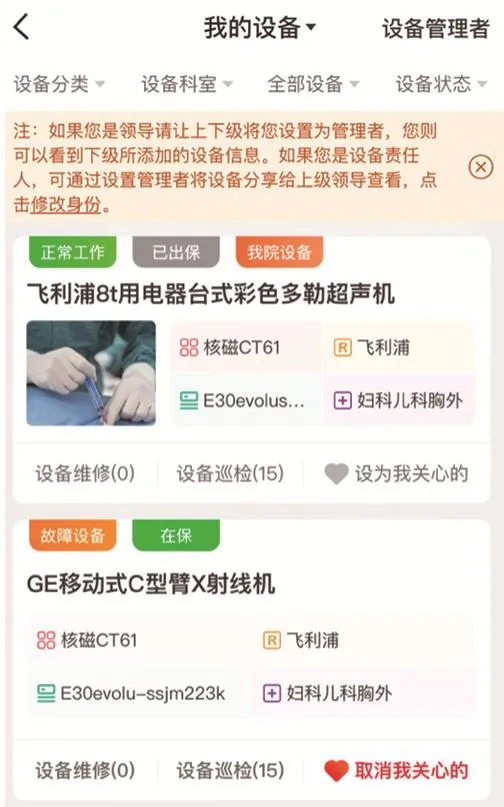
图4 设备信息管理模块界面展示图

图5 单个设备信息一览界面
2.2 设备故障维修模块
设备故障维修模块是本系统开发的重要模块之一,更与各医院设备科的日常维修工作息息相关。设备科工作人员使用此模块可以轻松地为各个设备输入维修记录(包括维修性质、故障现象、故障原因、维修方式、维修费用总计等信息),比起填写纸质维修记录更方便快捷,并且可以随时随地登录系统查询维修记录。具体操作界面见图6~7。
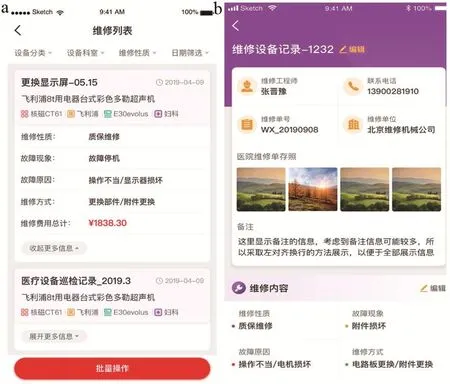
图6 设备故障维修模块界面展示
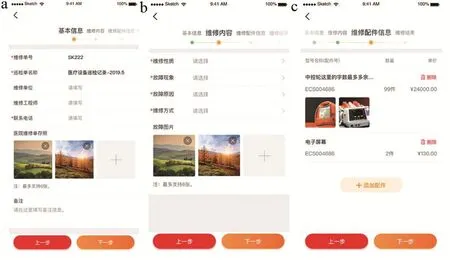
图7 新增故障维修单操作界面
设备故障维修模块可从以下维度呈现设备故障及维修情况:设备工作状态的时间分布;在用医疗设备故障类型的分布;维修进度跟进,维修情况掌握,维修过程可追溯;维修结果及费用呈现,费用透明。
2.3 设备日常巡检模块
医疗设备如果出现故障和问题,将直接影响医疗工作能否正常运行,也关系到医院各项工作能否正常开展。因此,对医疗设备进行周期巡检,降低故障和问题的发生概率以保证医疗设备稳定正常运行很有必要。这就要求医院相关的设备负责人员重视对医疗设备的周期巡检[9]。周期性巡检工作的目标为呼吸机、多参数监护仪、高频电刀、除颤监护仪、输注泵、透析机、B超、DR、CT 以及磁共振等。
设备日常巡检模块界面可以全面展示设备的巡检保养记录(包括巡检员姓名、巡检日期、巡检单号、巡检公司、保养内容、存在的问题等信息)。其中,用户可自行编辑、添加设备保养的内容,如表面清洁、内部除尘、功能检查等(见图 8~9)。
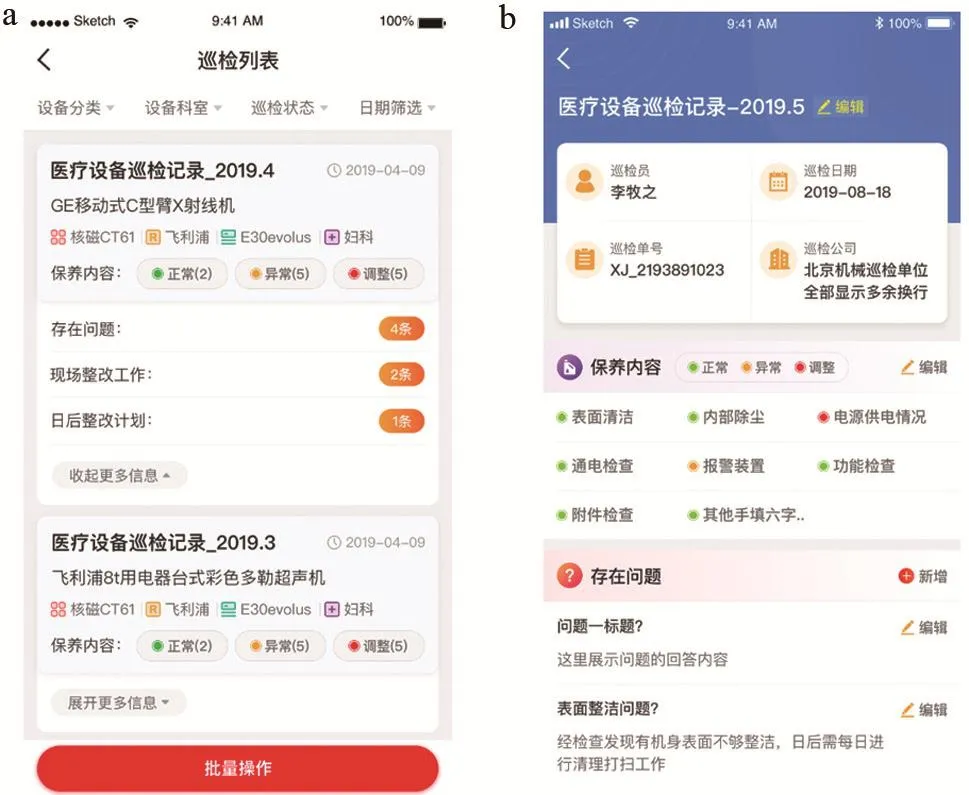
图8 设备日常巡检模块界面展示图
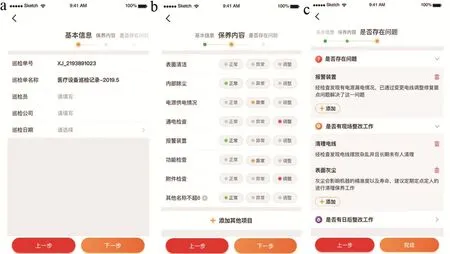
图9 新增巡检记录单界面展示图
2.4 不良事件上报模块
医疗器械是提高医生对患者治疗成功率和有效性等所需要使用的特殊工具,基于目前我国医疗机构管理和监督逐渐完善,医疗器械的使用虽受到了一定的规范,但较多的不良事件仍时常出现[10]。随着医疗器械不良事件监测工作的推进,所收集到的可疑医疗器械不良事件报告已从最初的每年几百份增长到每年40余万份。随着医疗器械不良事件报表数量稳步增长,报表质量存在报表不及时,上报单位未达到《医疗器械不良事件监测和再评价管理办法(试行)》(国食药监械〔2008〕766号)[11]上报时限要求,重复报表,报告内容不完整,报表来源、患者信息、不良事件情况、器械信息,评价处理等重要信息缺失等问题,给后续分析评价和风险防控工作带来不良影响[12]。传统的人工处理方式已经不能满足海量数据快速处理的需要,信息化是不良事件监测工作开展的必然要求。目前,发达国家已基本淘汰纸质报告的信息收集方式,采用网络直报和可疑不良事件的信息化处理方式[13]。
因此,为响应国家不良事件信息化监管工作的开展,优化纸质报表易出现信息缺失等问题,本文设计出不良事件上报模块(见图10~12)。本模块可以通过以下维度呈现不良事件的发生情况:不良事件的时间分布;不良事件的后果类型分布;地图模式直观呈现;不良事件发生数量排行。

图10 不良事件数据统计界面
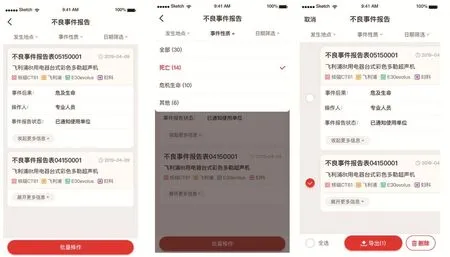
图11 不良事件管理界面
2.5 医疗设备运行数据统计模块
通过计算机网络等现代化手段对医疗器械不良事件进行自发呈报、收集、整理和管理,能准确快速提供医疗器械不良事件的信息和咨询[14]。本模块可以一键导出不良事件上报模块内所产生的数据,供相关管理者进行数据分析使用。医疗器械不良事件监测工作如同大数据分析,通过对不良事件报告的收集、分析,评价一段时间产品的风险水平,得出风险的发展趋势,分析出产品的风险总体状况,并提示风险信号。通过对这些风险信号的调查、分析、评价,发现和确认存在的产品风险,有针对性地采取风险控制措施,从而有效地降低产品风险,达到风险管理的效果[13]。

图12 新增不良事件上报界面
3 应用效果
3.1 系统反应速度快,用户体验好
在用医疗设备故障及不良事件监管系统是一个基于互联网、服务于业主场景的系统,除了高可用性外,系统反应速度快,同时能提供良好的用户体验给用户。
3.2 稳定可靠,能应对业务峰谷压力
平台的用户量及访问量会在短时间内快速增长,该系统在流量、空间、功能上稳定可靠,且能适应业务高峰时的压力。
3.3 面向未来的可增长可扩容的架构
在用医疗设备故障及不良事件监管系统是一个综合平台,项目功能可以逐步实施。随着用户的增长,系统也是可增长、可扩容的,而且增长的架构可以随着业务升级而不断地轻松扩容。
4 讨论
在用医疗设备故障及不良事件监管系统使用方便,操作简洁。解决了原先纸质记录方式的耗时、存储不便以及不能实时查看等弊端。本系统投入上线使用后,可以达成以下预期使用效果:提高医疗设备不良事件的上报数量及效率;强化对在用医疗设备的监督管理,提高医疗设备企业的自我监管意识;强化医疗设备使用人员维修及保养意识;形成医疗设备利益相关人主动上报、互相监管的机制;帮助医疗设备监管部门了解在用医疗设备使用情况。
2003—2017年全国医疗器械不良事件报告数持续增长,复合年均增长率达62.09%。医疗器械不良事件的报告来源中,使用单位占近90%。医疗机构为不良事件主要涉及的实际使用场所,Ⅱ类医疗器械和Ⅲ类医疗器械是引发不良事件的主要医疗器械管理类别。全国医疗器械不良事件整体趋势平稳,建议重点培养和提升相关单位的监测能力,加强不良事件预警和上报的公众宣传[15]。目前,本系统已经开发完成,但还未推广到全国医疗机构中使用。未来,希望此系统可以广泛应用到医疗器械行业领域,让医疗设备的利益相关者都能够参与到医疗器械不良事件的上报工作中来。医院作为医疗器械不良事件监测的重要环节,需要重视医疗器械不良事件监测上报政策的贯彻落实[16]。其次,还希望本系统可以与“国家医疗器械不良事件监测信息系统”相连接,为国家医疗器械监管部门提供一个获取医疗器械不良事件案例的新渠道。
