智能放疗云平台在肝脏结构自动勾画中的应用
2021-01-26秦伟赵紫婷时飞跃王敏魏晓为
秦伟,赵紫婷,时飞跃,2,王敏,魏晓为
1. 南京医科大学附属南京医院(南京市第一医院) a. 肿瘤放疗中心;b. 医疗设备处,江苏 南京 210006;2. 南京医科大学 医学物理研究中心,江苏 南京 210029
引言
现代精确放射治疗要求在肿瘤靶区 进行高剂量精确照射的同时,最大程度减少周围正常组织和危及器官的受照剂量。因此,在影像中准确定义靶区与危及器官至关重要,但手工勾画过程不仅耗时耗力,占用临床医师大量宝贵时间与精力,还在不同医生间存在较大的主观差异[1]。近年来,人工智能在医学领域的应用使得自动勾画技术成为研究热点之一,出现了针对各种器官的自动勾画算法框架。由于肝脏外形复杂,与邻近器官组织,例如心脏、腹壁肌肉、膈肌等在影像上均缺乏良好的灰度对比,难以形成清晰的边界,使得肝脏的自动医学图像分割仍是医学图像处理中的难点之一[2]。目前出现的ABAS、MIM、Raystation、Velocity等基于图谱库的自动勾画软件在骨性标志相对固定的头颈部肿瘤放疗中应用广泛[3-5],但在器官移动度较大的腹部少有研究报道。连心医疗的智能放疗云平台(RAIC.OIS)面向医院放疗科室、第三方影像与放疗中心提供基于人工智能的器官自动勾画、靶区勾画、自动放疗计划、放疗质控等技术工具和云服务。其中的自动勾画工具可实现头、颈、胸、腹和盆腔等多部位的危及器官勾画,我们前期已经对该软件自动勾画食管癌患者心脏结构的准确性进行了研究[6]。本研究以手工勾画结构为参考标准,从准确性和勾画时间两方面测试RAIC.OIS软件自动勾画腹部肿瘤患者肝脏结构的可行性。
1 材料与方法
1.1 病例选择
选取本院肿瘤放疗中心于2018年2月至11月收治的20例腹部肿瘤患者(胃癌10例,转移癌5例,胰腺癌2例,贲门癌2例,十二指肠癌1例)。其中,男15人,女5人,中位年龄为66.5岁(42~76岁)。所有患者均仰卧,经热塑膜固定后由西门子Sensation Open CT模拟机采集定位CT图像,层厚和层间距均为5 mm。将20例患者按照ID号升序的顺序排列,由1至20编号。
1.2 数据采集
自动勾画数据:在Eclipse治疗计划系统中导出上述患者的定位CT图像,传输至RAIC.OIS(v2.0.16)。在RAIC.OIS软件中打开导入的待勾画病例,在腹部的自动危及器官勾画模块中选择肝脏,同时记录自动勾画时长。将全部20例自动勾画生成的结构文件导回Eclipse系统,采集相应的体积与位置数据。
手工勾画数据:根据文献中肝脏的勾画原则和参考图谱[7],在Eclipse中重新手工勾画20例腹部患者的肝脏结构,并记录手工勾画的时间,然后测量并记录相应的体积与位置数据。
1.3 评价指标
定义V1为手工勾画的轮廓体积,V2为自动勾画的轮廓体积,x1和x2分别代表手工和自动两种勾画肝脏结构的几何中心坐标在x方向的坐标值,y和z方向依此类推。计算公式如下。
(1)体积差异ΔV%,见公式(1)。

(2)质心偏差(Deviation Of Centroid,DC),见公式 (2)。
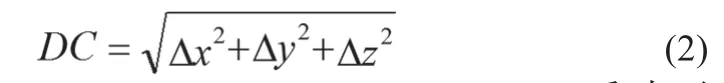
其中,Δx=|x2-x1|,Δy=|y2-y1|,Δz=|z2-z1|。DC反映两种结构的几何中心在空间位置的偏移,数值越大表明两种勾画结构在空间位置的偏移越大[8]。
(3)Dice相 似 性 指 数(Dice Similarity Coeffi cient,DSC),见公式(3)。
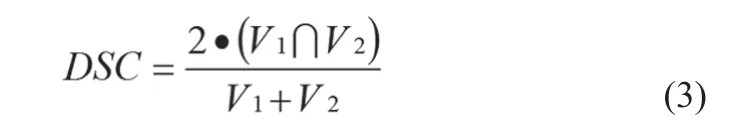
DSC用于评价两个集合之间的重合性,一般认为DSC>0.7时,两个结构的一致性较好[9]。
(4)敏感性指数(Sensitivity Index,SI),见公式(4)。

SI反映自动勾画轮廓与手动勾画轮廓的匹配程度[10]。
(5)包容性指数(Inclusiveness Index,IncI),见公式 (5)。

IncI反映手动勾画轮廓中包含自动勾画轮廓的概率[11]。
(6)Jaccard指数(Jaccard Index,JAC),见公式(6)。
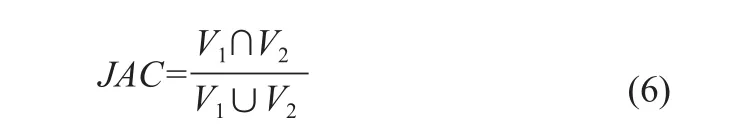
JAC用于度量两个集合之间的相似性,在0~1的范围内,JAC数值越大,相似度越高[12]。
2 结果
肝脏结构的参数及各评价指标的结果列于表1。在20例测试病例中,两种勾画方式的肝脏体积差异平均值>0,表明大多数自动勾画的肝脏体积较手工勾画肝脏体积偏大,平均偏大2.16%左右。
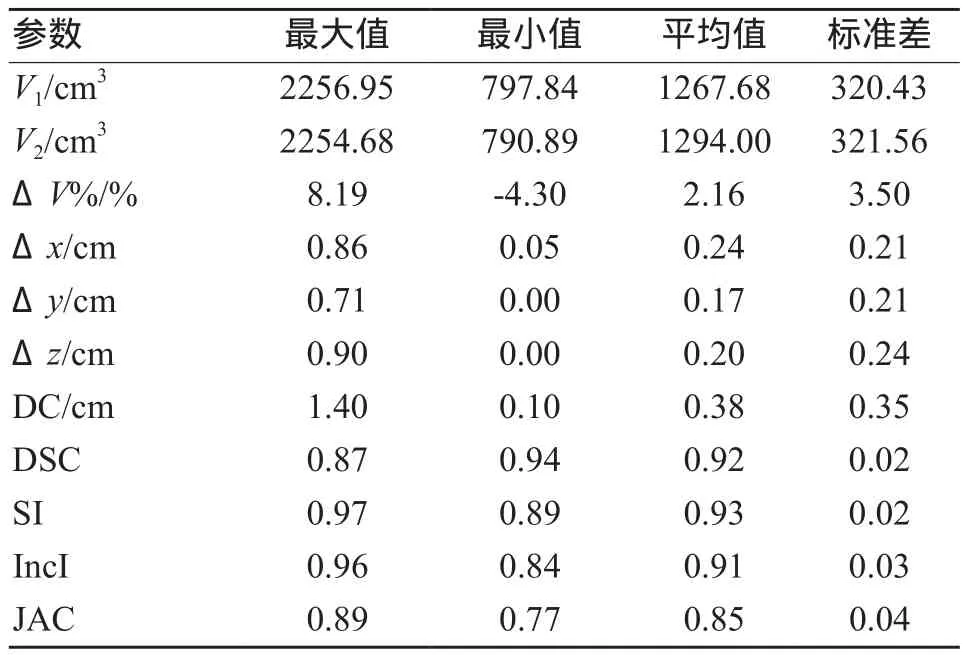
表1 20例患者肝脏结构勾画的统计数据
图1为位置差异数据(Δx、Δy、Δz和DC)。由表1可见,自动勾画肝脏的几何中心与手工勾画的几何中心在三维空间上平均偏移0.38 cm。由图1可见,位置偏差在x轴方向的值最大,为(0.24±0.21)cm,在y、z两个方向上的值分别为(0.17±0.21)cm和(0.20±0.24)cm。
图2所示为20例肝脏结构勾画相关的DSC、SI、IncI与JAC值。由图2和表1可见,20例肝脏结构自动勾画的DSC值均大于0.8,最大值达到0.94,表明自动与手工勾画的肝脏结构形状有较好的吻合性。
对20例患者的两种勾画方式时间进行统计分析和比较,自动勾画和手工勾画时间分别为(4.4±0.4)s和(507±74)s,由两种方式的勾画时间比较可见,使用自动勾画可减少约99%的时间。
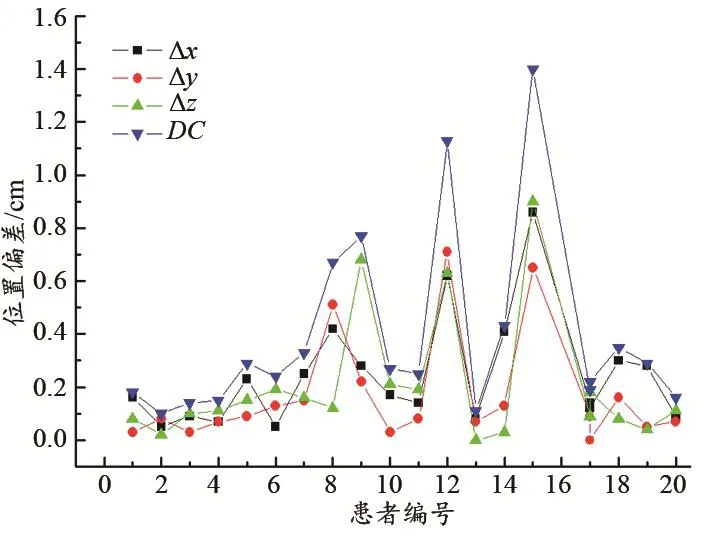
图1 自动和手工两种方式勾画肝脏结构的位置偏差
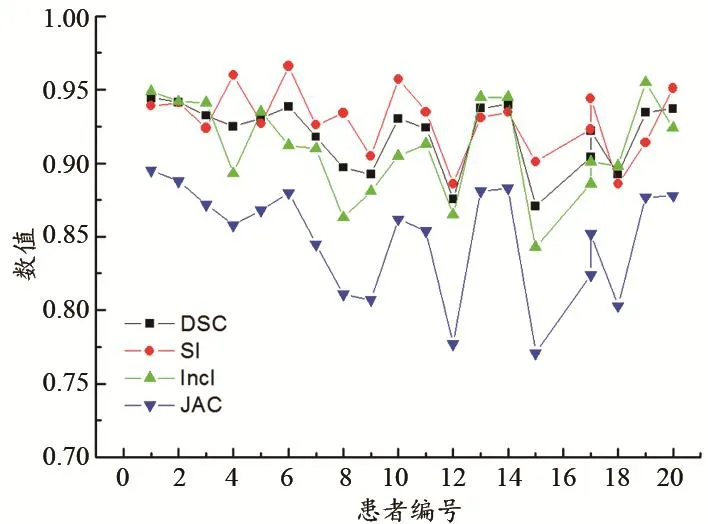
图2 肝脏结构勾画的DSC、SI、IncI和JAC值
对V1(手工勾画的轮廓体积)和V2(自动勾画的轮廓体积)两组数据进行配对t检验,P=0.015<0.05,两组数据有统计学差异。对Δx、Δy、Δz三组数据进行两两比较,结果表明,Δx和Δy有统计学差异(P<0.05),Δx和Δz没有统计学差异,Δy和Δz也没有统计学差异。对DSC和SI、DSC和IncI、DSC和JAC,计算出的Pearson相关系数分别为0.734(强相关)、0.891(极强相关)和0.998(极强相关)。这说明DSC值与其它三个参数有较好的相关性。
3 讨论
随着计算机硬件及软件的发展,使用计算机辅助自动或半自动分割医学图像变成可能,这一技术在放疗领域的应用,不仅将医生从高强度的繁复勾画工作中解脱出来,还有助于减少勾画结果在不同医生间的主观差异[13]。目前,自动勾画方法主要包括基于图谱库、基于模型以及两种方法的结合[14]。基于图谱库的方法使用刚性和(或)形变配准,将已有病例轮廓与测试患者匹配,通过形变配准算法,将形变后的结果映射到测试患者CT图像上,实现自动勾画。由于头颈部骨性标志相对固定,器官移动少,易配准,已有大量基于图谱库的自动勾画软件在头颈肿瘤调强放射治疗的应用研究,包括不同软件勾画准确性比较[15],入库病例数研究[16],及剂量学精度研究等[17]。基于模型的自动勾画使用一定数量的标注数据作为训练集,通过数据增强、机器学习等技术建立模型,使用时无需建立病例图谱库。
张富利等[18]比较了基于深度学习和图谱库方法自动勾画不同部位肿瘤危机器官轮廓的几何学精度,发现前者在总体上更有优势。Macchia等[11]比较了三种基于模板库的自动勾画软件(ABAS、MIM和VelocityAI)在头颈部、胸部、腹部和盆腔肿瘤的危及器官勾画结果。其中,三种软件自动勾画的肝脏结构DSC分别为(0.93±0.02),(0.93±0.03)和(0.90±0.01),SI 分 别 为(0.92±0.02),(0.90±0.03)和(0.92±0.03),IncI分别为(0.93±0.03),(0.95±0.04)和(0.88±0.02)。本研究使用基于人工智能的连心医疗RAIC.OIS软件,自动勾画腹部肿瘤患者肝脏结构,结果显示,在自动勾画的20例病例中,肝脏结构的DSC值为0.92±0.02,表明该软件的自动勾画结果与人工勾画一致性较好。SI与IncI分别为(0.93±0.02)和(0.91±0.03),与上述基于图谱库方法的自动勾画结果相近。这表明两种自动勾画方法在肝脏结构中的应用均能得到较好的结果。
综上所述,在未经任何手工修正的情况下,应用RAIC.OIS自动勾画腹部肿瘤癌患者的肝脏结构,能够达到或接近手工勾画的准确性。临床工作中,放射肿瘤医生认为软件轮廓勾画的DSC达0.95左右时,基本不需要调整,或仅需轻微修改[19]。本研究中自动勾画的肝脏结构DSC平均值达到0.92,已基本接近临床要求。但是需要注意的是,自动勾画结果仍需经过放疗医师审核与手工修改才能用于临床治疗。虽然本研究未将手工修改时间纳入评估指标,但自动与手工勾画时间的比较结果表明,使用该软件能够大大缩短勾画时间,有效提高放疗工作效率。
致谢
衷心感谢连心医疗叶大亮和何飞跃在智能放疗云平台使用中提供的帮助和支持。
