食管癌自适应放疗不同累加方法对危及器官受照剂量的差异比较
2021-01-26许晓燕王沛沛李金凯昌志刚顾宵寰鞠孟阳葛小林孙新臣
许晓燕,王沛沛,李金凯,昌志刚,顾宵寰,鞠孟阳,葛小林,孙新臣
1. 江苏省人民医院(南京医科大学第一附属医院)放射治疗科,江苏 南京 210000;2. 南京医科大学 特种医学系,江苏 南京 211100
引言
随着放疗技术的快速发展,调强放疗(Intensity Modulated Radiation Therapy,IMRT)在肿瘤治疗中的应用日益广泛。IMRT不仅可以提高靶区剂量与均匀性,还可以降低周围正常组织受照剂量[1],减轻放疗不良反应,提高患者生存质量[2-3]。有研究显示,食管癌在放疗过程中,靶区存在不同程度的缩小和移位[4]。因此,为了避免靶区漏照,保护危及器官(Organs at Risk,OARs),通常需在食管癌患者放疗的中后期再次进行CT模拟定位并制定自适应放疗计划。目前常规采用人工计算、治疗计划系统(Treatment Plan System,TPS)或MIM多模态形变配准系统等三种剂量累加方法来评估整个放疗过程中OARs的受照剂量。本研究旨在分析食管癌患者根治性自适应放疗时,三种剂量累加方法对两程计划OARs总受照剂量评估的差异性。
1 材料与方法
1.1 基本资料
收集2018年5月至2020年1月在江苏省人民医院放射治疗科接受根治性放疗的50例食管癌患者,原发灶均经病理学证实,入院KPS评分≥80分。采用仰卧位热塑体模固定,平静呼吸下进行CT扫描,扫描范围自下颌下缘至肝脏下缘,层厚5 mm,CT图像(CT1)通过放疗网络传送至Monaco5.1 TPS。由同一位放疗医师进行靶区勾画,肿瘤靶区(Gross Target Volume,GTV)包括食管病灶和局部肿大淋巴结,临床靶区(Clinical Target Volume,CTV)为GTV前后左右外放0.5 cm,上下外放2.0~3.0 cm,包括转移率较高的淋巴引流区,并根据解剖屏障做相应调整,计划靶区(Planning Target Volume,PTV)为CTV在三维方向上均匀外放0.5 cm,肿瘤计划靶区(PGTV)为GTV在三维方向上均匀外放0.5 cm。OARs包括双肺、心脏和脊髓。放疗设备选择医科达Axesse加速器,配置80对全5 mm高精度多叶光栅。
1.2 治疗计划设计
靶区处方剂量PTV:50 Gy/25 f/5 W,PGTV:60 Gy/30 f/6 W。在放疗20~25 f期间,根据肿瘤靶区退缩情况,重新进行CT模拟定位扫描(CT2)。首程治疗计划Plan1基于CT1治疗25次,采用7野共面照射,射野角度分别为0、30°、50°、160°、200°、310°、330°。二程自适应放疗计划Plan2基于CT2治疗5次,采用5野共面照射,射野角度分别为0、60°、150°、210°、300°。全程放疗计划均采用动态调强技术,最大剂量率600 MU/min。OARs剂量限值:双肺V5≤60%(V5表示双肺受到5 Gy照射的体积占双肺总体积的百分比,下同),V20≤28%;心脏V40≤30%;脊髓Dmax≤45 Gy(Dmax表示脊髓受到的最大剂量)。
1.3 OARs受照剂量计算
分别采用三种剂量累加方法对两程计划中OARs总受照剂量进行计算,具体包括双侧肺V5、V20,心脏V40,脊髓最大剂量Dmax。A组采用人工计算:对两程放疗计划Plan1和Plan2分别进行加权处理,处方剂量归一到60 Gy/30 f获得放疗计划 Plan1’和 Plan2’,将 Plan1’中OARs受照剂量评价指标 ×25/30,Plan2’中 OARs受照剂量评价指标×5/30,两者相加得出OARs总受照剂量。B组TPS计算:首先利用TPS刚性图像配 准算法对CT1和CT2进行图像融合,然后根据图像融合结果基于CT2得到Plan1和Plan2的累加计划Plan_sum,利用剂量体积直方图统计OARs总受照剂量。C组采用MIM多模态形变配准系统计算:利用MIM自带Dose Accumulation-Deformable工作流,基于密度(CT值)形变配准算法得到基于CT2的累加计划 Plan_sum2,将剂量分布转换为剂量体积直方图后统计OARs总受照剂量。
1.4 统计学分析
采用SPSS 26.0软件对各OARs受照剂量进行统计学分析,计量数据采用均值±标准差(±s)表示。三种方法所得OARs总受照剂量组间比较采用方差分析,如存在统计学差异,再用LSD法进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 不同累加方法OARs总受照剂量差异比较
双肺 V5差异有统计学意义(F=8.933,P<0.001),LSD法组间比较:A组分别与B组、C组差异有统计学意义(P<0.05),其中A组数值最小;双肺V20差异无统计学意义(P>0.05)。心脏V40差异有统计学意义(F=3.590,P=0.031),LSD法组间比较:A组分别与B组、C组差异有统计学意义(P<0.05),其中A组数值最大。脊髓Dmax差异有统计学意义(F=5.587,P=0.005),LSD法组间比较:A组分别与B组、C组差异有统计学意义(P<0.05),其中A组数值最大(表1,图1~3)。
表1 不同累加方法OARs总受照剂量差异比较(±s)
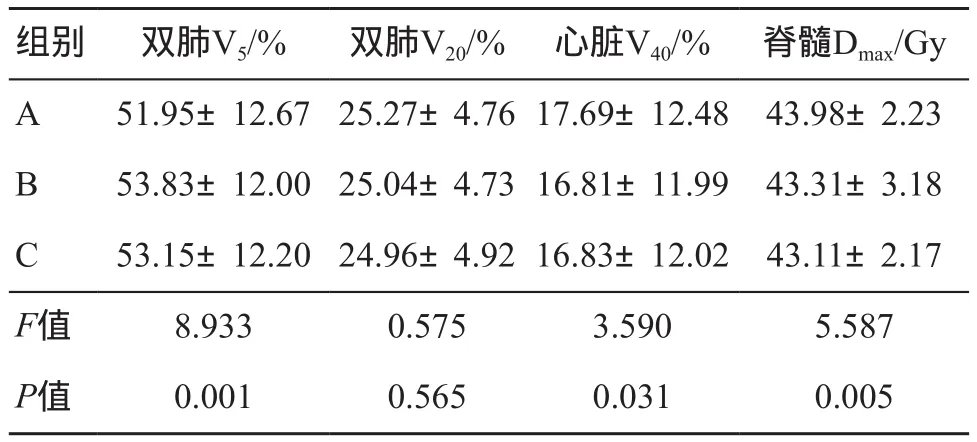
表1 不同累加方法OARs总受照剂量差异比较(±s)
组别 双肺V5/% 双肺V20/% 心脏V40/% 脊髓Dmax/Gy A 51.95±12.67 25.27±4.76 17.69±12.48 43.98±2.23 B 53.83±12.00 25.04±4.73 16.81±11.99 43.31±3.18 C 53.15±12.20 24.96±4.92 16.83±12.02 43.11±2.17 F值 8.933 0.575 3.590 5.587 P值 0.001 0.565 0.031 0.005

图1 三种剂量累加方法,双肺V5差异比较
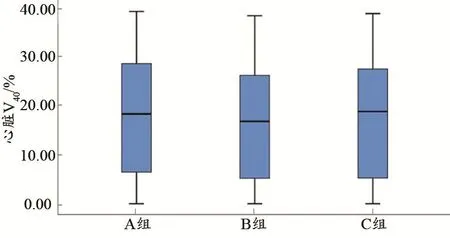
图2 三种剂量累加方法,心脏V40差异比较
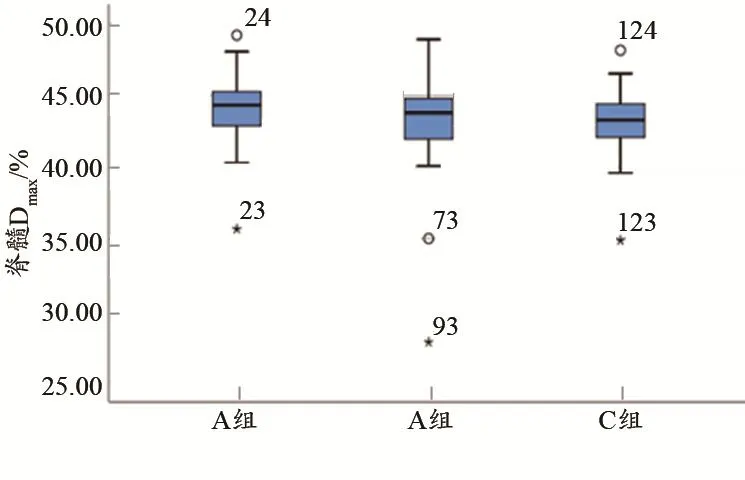
图3 三种剂量累加方法,脊髓Dmax差异比较
3 讨论
在食管癌放疗技术中,IMRT技术在靶区适形度、均匀性以及OARs保护方面已非常成熟[5-7]。有研究指出,食管癌患者在放疗过程中,靶区移位可使95%的PTV受照剂量约减少8.38%[8]。若仍执行原放疗计划,不仅会影响靶区照射剂量也会导致周围正常组织受到不必要照射[9-10]。而自适应放疗依据肿瘤靶区退缩情况,在分次治疗期间获取患者CT图像,重新优化放疗计划,从而提高肿瘤靶区剂量,降低OARs受照剂量,实现降低放疗并发症的发生率,提高患者的生存质量[11-12]。
由于放疗会产生一定的不良反应,而降低并发症的关键是保证肿瘤有效控制剂量前提下,尽可能降低照射剂量和范围[13-14]。因此,准确的评估两程计划中靶区和OARs剂量分布是临床治疗决策的重要依据。目前,很多TPS虽自带配准功能,但配准方式多为刚性配准。而不同分次CT扫描图像间人体解剖结构存在一定形变和旋转,使得TPS配准很多时候无法有效解决临床实际问题。而MIM是一款集多模态图像配准、剂量累加等功能于一体的图像处理系统,能很好的读取主流TPS的图像及剂量,并进行剂量累加操作。有研究证实,与刚性配准方法相比,形变配准更利于医学图像的配准,尤其在图像引导放疗和自适应放疗方面[15]。
本研究发现在双肺V5差异比较中,A组数值最小,并且差异有统计学意义。由于此次收集的50例患者两程计划布野方式均为蝶形野IMRT,因此人工计算仍可作为简单评估双肺受照体积方法,但该方法会低估双肺的低剂量受照体积。如果首程和二程计划布野方式差异较大,人工计算法将不能用于双肺剂量的累加计算,此时需采用TPS计算或MIM多模态形变配准进行评估。由于本研究中,两次CT图像均在患者平静呼吸下获取,因此两次CT图像中双肺的体积、形态会有所差异,而TPS计算并未考虑两次CT模拟定位时患者体型、双肺体积等因素,仅利用刚性配准算法对CT1和CT2进行图像融合,获得累加计划Plan_sum并统计OARs受照剂量。而MIM多模态形变配准可基于密度的自由形变,对双肺的体积和形态进行匹配和融合。因此,MIM多模态形变配准更适合用于评价两程计划融合时双肺的总受照体积。而食管癌放疗的毒副反应中肺炎的发生与V5、V10、V20、V30有关[16],因此,本文认为在三种剂量累加方法中,双肺的总受照体积的评估更适合采用MIM多模态形变配准。
有文献指出,当心脏照射剂量大于40 Gy时,将诱发心脏疾病[17];而脊髓Dmax是判断放射性脊髓炎发生的重要指标[16]。在本次研究中,三种剂量累加方法在心脏V40、脊髓Dmax的差异比较中有统计学意义,其中A组获得的心脏V40和脊髓Dmax数值最大。究其原因,可能是由于采用人工计算法累加脊髓Dmax时,将两程计划中两个脊髓Dmax点的数值进行加权相加,因而所得数值最大,但在实际放疗过程中,两程计划中脊髓Dmax所处的位置并非恰好位于同一位置。石慧烽等[18]研究发现,MIM软件可以完成颈椎配准以及剂量累加工作,并证明了MIM软件脊髓配准的准确性。因此,食管癌自适应放疗在两程计划融合时,人工计算法可简单计算心脏和脊髓的累加受照剂量。若患者体型、双肺体积等变化较大者,可考虑使用MIM多模态形变配准方法。
4 结论
在食管癌患者自适应放疗过程中,人工计算方法会低估双肺的低剂量受照体积,并会高估脊髓的最大受照剂量。采用TPS计算或MIM形变配准,可对双肺、心脏和脊髓等进行相对准确的评估,能有效增加物理师制定再程计划的可调整空间,获得更优计划,从而使患者获益。
