急性高原病的动物模型研究现状
2021-01-26赵安鹏李加忠
霍 妍,赵安鹏,李 雪,李加忠,王 荣
(1. 兰州大学药学院,甘肃 兰州 730000; 2. 中国人民解放军联勤保障部队第940医院全军高原医学重点实验室,甘肃 兰州 730050)
地理学所说的高原一般指海拔大于500 m的地区,在医学上,把海拔大于2 500 m的地区称作高原。我国海拔大于2 500 m的地区超过国土面积的四分之一,是世界上高原面积最广的国家。与平原相比,高原环境具有气压低、氧分压低、寒冷、紫外线强、气候干燥等特点。其中,低氧对机体的功能和代谢产生广泛的、非特异性的影响,是高原环境影响人体的最重要因素。
人体在短时间内由低海拔地区急进高海拔地区时,由于不适应高原环境所导致的各种病理生理反应称为急性高原病。急性高原病分为3种:急性高原反应(acute mountain sickness,AMS)、高原肺水肿(high altitude pulmonary edema,HAPE)和高原脑水肿(high altitude cerebral edema,HACE)。AMS是轻微的、自限性的急性高原病,在急进高原的人群中较为常见,症状一般在急进数天后减轻或消失[1]。HAPE和HACE是严重的急性高原病,发病率低,致死率高,一般无法自愈。
随着西北经济的发展和“一带一路”建设,越来越多的旅游及高原作业人群从平原进入高原地区,急性高原病常常威胁着这些人的活动能力,甚至是生命健康。目前对于急性高原病的预防和治疗没有特效药物,常用药物也是疗效甚微,缓解急性高原病的方法依然是吸氧和降低海拔,但这并不能从根本上解决急进高原人群作业能力下降等问题。因此,开展急性高原病有效防治药物的研究非常必要。而这些研究的基础就是建立复现性好、评价体系健全的急性高原病动物模型。目前,常用的建模方法大多为采用一定的手段模拟高原低氧环境,使动物发生急性高原病症状。本文将从建模环境、建模方法和评价指标等几个方面综述近年来研究中建立应用的急性高原病的模型,以期为建立更好的急性高原病动物模型,深入研究急性高原病的病防治药物及发病机制的提供基础。
1 急性高原病简介
1.1 急性高原反应AMS常在急进至海拔大于2 500 m的高原数小时后出现,表现为头痛、厌食症、恶心、呕吐、头晕、疲劳和睡眠障碍等,少数患者会发展为HACE,出现意识水平的改变和共济失调[2]。急性高原反应的发病率与海拔有密切的关系。在急进至海拔2 500 m的人群中,有10%~25%的人发生AMS,症状通常很轻微,对活动几乎没有影响。然而,在海拔4 500~5 500 m的急进人群中,有50%~85%会发生AMS,并可能影响活动能力。AMS的发病机制尚不明确,是一种多因素的疾病。急进高原后,低氧条件会促使机体会做出反应,首先就是肺通气量增加、呼吸频率加快,其次会使脑血管扩张,颅内压升高。急性低氧条件还会导致副交感神经活动降低、交感神经活动增强,自主神经系统功能抑制,造成心率、血压的改变以及胃肠功能的改变[3-4]。低氧导致的一系列生理变化均是导致AMS的因素。目前用来诊断AMS的方法较为主观,一般用Acute Mountain Sickness-Cerebral评分(AMS-C)和Lake Louise评分(LLS)来判断是否出现AMS,AMS-C≥0.7或LLS≥3并伴有头痛,则表明AMS的发生[5]。
1.2 高原肺水肿高原肺水肿(HAPE)是急进高海拔地区时发生的一种非心源性肺水肿,低氧和劳动被确定为HAPE发生的两个主要因素,其发病率约为1%~2%,多见于海拔大于3 000 m的地区。HAPE起病急,发病快,其症状表现为体力丧失、呼吸困难、肺部湿性啰音、发绀、咳嗽、粉红泡沫痰等[6]。HAPE的发病机制尚不明确,目前认为主要由毛细血管应力衰竭导致,即低氧性肺血管收缩导致肺毛细血管动脉压不均匀增加,其主要原因可能是丘脑交感神经中枢兴奋以及Ca2+通道激活等[7]。HAPE患者基础肺动脉压升高,心率升高[8],胸片和CT扫描显示分布于周围的斑片状水肿,并伴有炎症反应。
1.3 高原脑水肿高原脑水肿(HACE)一般出现在大于3 000 m的地区,发病率较低,致死率高。HACE被认为是AMS的最终阶段,其症状多表现为头痛、恶心、呕吐、意识混乱、共济失调、昏迷等[2]。AMS向HACE转化的原因尚不明确,可能是由于血脑屏障破坏、细胞内水肿、静脉回流障碍等[9],有血管源性水肿和细胞毒性水肿共同存在的可能性[10]。HACE患者的脑部CT和核磁均显示水肿并伴有多个微出血病灶[11]。
2 急性高原病研究模型
急性高原病动物模型建立的关键在于建立高原的低氧环境,主要方法有在高原环境模拟舱内模拟高原低氧环境,建立动物模型,或直接在高原实地建立动物模型。
2.1 建模环境
2.1.1高原环境模拟舱动物模型 建立高原环境模拟舱动物模型即将动物饲养于模拟舱中,以降低舱内气压的方式将模拟舱模拟海拔升至所需的高度,氧气含量、二氧化碳含量、温度、湿度、光照时间等均可设定,持续一定的天数。
低压低氧是造成高原疾病的最主要因素,模拟舱可以模拟高原的低氧条件,因此急性高原病的动物模型可在模拟舱中建立。实验动物高原环境模拟舱分为大型实验动物模拟舱和小型实验动物模拟舱。大型高原环境模拟舱分为饲养舱和实验舱,饲养室可以设置相对较高的海拔(> 4 000 m)用于动物造模,而当实验者需要对动物进行给药、取血等处置时,人员先进入实验舱,考虑到安全或作业能力的因素,实验舱相对海拔较低(3 000~3 500 m),待饲养舱海拔高度降至实验舱高度后,两舱可相通进行实验。在大型实验动物模拟舱中进行实验可避免实验中直接将模拟海拔降至当地海拔后,富氧条件对实验产生影响,目前广泛应用于急性高原病动物模型的建立。小型实验动物模拟舱亦可以将动物置于相应海拔饲养,但实验中可控制的环境因素较少,且对动物进行处置时,也只能将动物从舱中取出,置于当地海拔进行操作。但是,这类设备使用方便、操作简单、成本低,常用于实验中途不需对动物进行处置的实验。
高原环境模拟舱可以在平原地区使用,不需实验人员、实验动物和实验仪器进入高原地区,避免长途运输,较为省时省力,并且模拟舱海拔高度可以自由设定,可以在同一地区模拟不同海拔进行实验。此外,模拟仓的海拔升降速度、温度、湿度等环境因素可控,避免了因地区、季节、运输方式等因素的变化影响实验重复性,便于实验条件的复现,目前广泛应用于急性高原病动物模型的建立。
但是,在急性高原病的实验研究中,常需在实验中途对动物进行处置,即使在大型模拟舱内,对动物进行处置时也需将饲养舱模拟海拔降至不影响人类活动的高度,这便不能保证整个实验过程中动物始终处于稳定的海拔。
2.1.2高原实地动物模型 高原实地动物模型的建立方法为将动物由平原急进高原或由低海拔高原急进至高海拔高原,饲养一定的天数。
高原疾病主要由高原的低氧环境所致,但是在高原实地建立动物模型时,难以避免由于气候、季节、急进方式等因素引起的误差,在高原实地建立动物模型的方法尚不常用。因此,在高原环境下建立SPF级动物实验室以及完善实验动物急进高原的流程对于在高原实地建立急性高原病动物模型十分重要,现于我国青海玉树已经建立有全军高原医学实验室和全军高原环境损伤防治重点实验室。目前,虽然在高原实地实验室内建立的急性高原疾病动物模型较少,但已经开展了多项高原药物代谢动力学的实验,并取得重大进展。例如,王昌等[12]发现,大鼠由上海(海拔55 m)急进至青海玛多(海拔4 300 m)后,左氧氟沙星在大鼠体内代谢过程发生明显变化;李文斌[13]使大鼠由上海(海拔55 m)急进至甘肃玛曲高原(海拔4 010 m),发现在高原条件下,普萘洛尔的药代动力学参数发生了显著变化。
高原实地实验目前广泛应用于高原药物代谢动力学的研究,有望应用于急性高原病动物模型的建立。也可以应用于慢性高原病的研究,并且可以开展人体的高原药物代谢动力学研究。
2.2 建模方法
2.2.1单纯饲养 单纯饲养建立动物模型时所需的海拔较高,常在模拟舱中进行,一般将饲养舱模拟海拔设置在6 000~8 000 m,天数不等。需要对动物处置时,模拟海拔一般为3 000~4 000 m,防止海拔过高对实验人员造成伤害,或过低对所建模型产生影响。Yu等[14]将大鼠暴露在模拟海拔8 000 m的氧舱内,24 h后其脑含水量升高,并发现提前给药银杏内酯B能够显著降低脑含水量,有潜在的预防HACE的作用(Tab 1)。Huang等[15]在模拟6 000 m海拔的模拟舱内,发现小鼠的脑含水量升高、血脑屏障通透性升高、脑组织切片显示组织损伤、水迷宫试验中逃脱潜伏期增长,提示小鼠发生高原脑水肿。Wang等[16]在模拟6 000 m海拔下,测得大鼠缺氧48 h后,脑含水量升高、血清内TNF-α、IL-6水平上升、脑组织切片显示组织损伤、水迷宫试验中逃脱潜伏期增长,指示高原脑水肿的发生,并发现给药乙酰唑胺以及葛根素能够明显改善上述指标。Lee等[17]在模拟海拔8 000 m的减压室内使大鼠暴露9 h,测得大鼠肺含水量升高、肺泡灌洗液内出现蛋白渗漏、肺组织有明显损伤,证明出现高原肺水肿,预防给药红景天提取物可以缓解急性缺氧导致的上述指标的改变。

Tab 1 Modeling of animal model of acute plateau disease
2.2.2跑台力竭运动 在高原条件下,单纯饲养建立急性高原病动物模型在目前的研究中应用十分普遍,但单纯饲养所建立的HAPE动物模型成功率低、表征不明显,且复现性不良。因此,使实验动物在低压、低氧环境中进行力竭运动来建立HAPE动物模型的方法被广泛应用。其次,高原条件下的力竭运动能够类比人类在高原地区的登山、劳作等活动,使该模型的建立更加契合人类急性高原病的发生过程。力竭运动模型的建立所需海拔较低,表征更明显。Sheppard等[18]在验证运动是否会增加HAPE的发病率的实验中,比较了常氧、常氧运动、低氧、低氧运动对大鼠肺含水量、肺通透性、肺组织形态产生的影响,结果显示常氧和常氧运动组未出现明显差异,证明常氧条件下的运动不会导致肺水肿的发生。
建立跑台力竭运动动物模型,一般在4 000~6 000 m的海拔下,时间多为48 h,使用实验动物跑台让动物进行连续运动,在3 000~4 000 m海拔下对动物进行处置。Zhou等[19]使大鼠在4 500 m的模拟海拔下进行力竭运动,之后将海拔升至6 000 m处,48 h后测得肺含水量上升、肺泡灌洗液蛋白含量升高、血清内细胞因子TNF、IL-1b、IL-6、IL-8水平上升,切片检查可见肺组织损伤,电镜显示超微结构被破坏,指示有高原肺水肿发生,给药地塞米松或索那肽后,上述损伤能够得到有效缓解。She等[20]使小鼠在5 000 m的模拟海拔下进行力竭训练,48 h后测得肺含水量升高、肺泡灌洗液有细胞和蛋白渗漏,组织学分析可见明显损伤,提示小鼠发生HAPE;并发现大鼠在模拟海拔4 700 m进行力竭训练后,肺泡毛细血管渗透率也会升高,进一步验证HAPE的发生,并证明了角质细胞生长因子-2 可以缓解低氧运动造成的肺部损伤,有潜在的治疗HAPE的作用[21]。
目前对于HAPE的研究中,通过跑台力竭运动来建立动物模型的方法使用最多,成功率最高,复现性最好,并且方便可行。建立跑台力竭运动动物模型所需的海拔相对较低,在模拟舱和高原实地均有实施的可能性。
3 模型评价指标
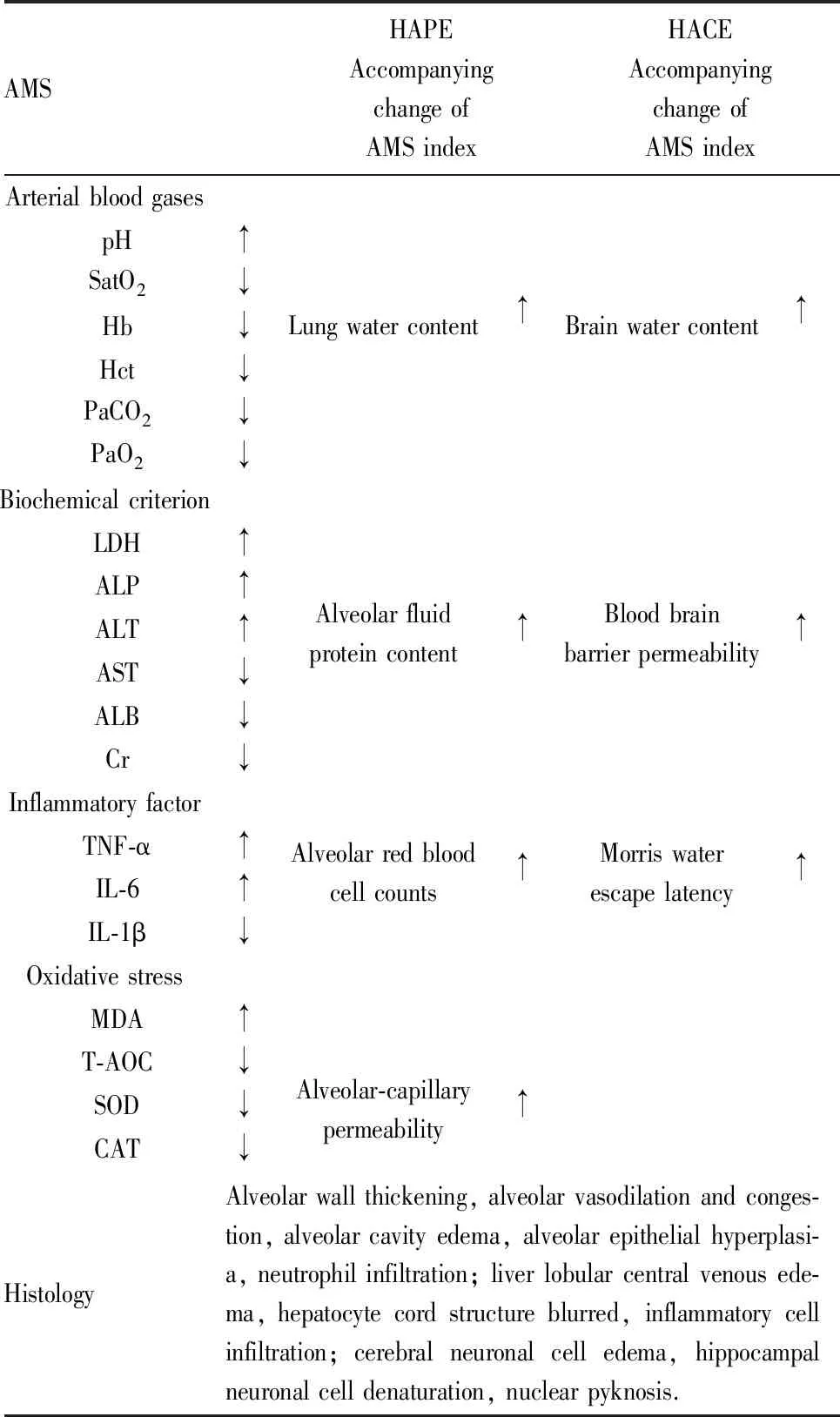
3.1 AMS临床上AMS的诊断方法为询问患者的主观感受,但是在动物实验中难以准确获得动物的主观感受,目前并没有准确的指示实验动物发生AMS的办法。在出现AMS的症状时,高原低氧会导致动物血气及血常规异常、血清生化指标异常、氧化应激损伤和炎症现象[22-24]等,现有研究中一般以这些指标来评价低氧损伤的程度,间接反映AMS的发生。但到目前为止,并没有明确的评价指标证实AMS动物模型建立成功。
动物急性暴露于高原低氧条件后,可发现动脉血气的改变,主要表现为pH降低、血氧饱和度下降等;血常规检测中可见白细胞、红细胞及血红蛋白含量异常等;机体主要组织器官出现轻微或明显的损伤,氧化应激指标发生改变;血清中生化指标改变,炎症因子TNF-α、IL-1β、IL-6、IL-8含量上升,指示伴随炎症反应发生[25](Tab 2)。但低氧损伤并不等同于出现AMS,AMS动物模型的建立方法有待进一步确立。
3.2 HAPE发生HAPE的动物中除了可以检测出上述AMS模型检测指标的变化外,还可检测出肺含水量升高,肺泡灌洗液(BALF)中总蛋白和白蛋白含量上升且存在细胞渗漏,肺泡毛细管渗透率升高,组织切片可见肺血管充血、肺泡间隔增厚、肺泡腔内有红细胞和粉红色蛋白物质。现有模型中多以上述指标的变化来表示HAPE的发生,但与临床诊断指标并不完全匹配,可增加小动物肺部CT来证明HAPE发生。
3.3 HACE出现HACE的动物也可以检测出AMS模型检测指标的变化,另外还会出现脑含水量升高,血脑屏障通透性升高,组织切片可见细胞间隙明显扩大、皮质血管扩张、神经元萎缩、细胞核呈暗色固缩,水迷宫试验逃脱潜伏期增长等。小动物脑部CT可用于诊断HACE,但现有研究中鲜有使用。
4 结语
我国高原面积广大,由于各种原因需要进入高原的人数也日益增多,进行急性高原病的防治研究和基础研究都十分重要。急性高原病包括急性高原反应、高原肺水肿、高原脑水肿,海拔高度、上升速率、个体易感性都会影响发病率及严重程度[26-27]。AMS的发病率较高,但症状较轻微,典型症状为头痛,一般不影响活动,多用红景天或乙酰唑胺预防[28-29]。大多在急进高原后数天可适应,或在降低海拔后自愈,少数会发展为更加严重的HACE。急进高原并伴有剧烈运动时,易发生HAPE,HAPE发病率低,但起病急,发病快,多见于海拔3 000 m以上地区,CT检查可见肺部病变,现临床多以降低海拔配合硝苯地平治疗HAPE。HACE被认为是AMS的最终阶段,发病率低,致死率高,见于海拔3 000 m以上地区,CT检查可见脑部病变,降低海拔加以地塞米松可缓解其症状[30]。
Tab 2 Evaluation index of animal model of acute plateau disease
目前对于急性高原病的治疗都是以降低海拔、吸氧并辅以药物治疗的方法,单纯使用药物进行预防或治疗效果甚微,这给急进高原人群带来了很大的不变,因此急需开发针对急性高原病的特效药物。急性高原病主要由高原低压低氧环境所诱导,但其发病机制尚未明确,对于急性高原病的基础研究也有待深入。虽然现已有不少成功建立出HAPE和HACE动物模型的案例,但大多指向性不强、复现性不好,对于AMS的动物模型的建立也尚未有结果,这给急性高原病的深入研究带来很多困难。
虽然在现有研究中,有不少急性高原病动物模型建立并应用于研究中,但仍有一些问题有待深入研究,例如(1)AMS动物模型没有明确的评价指标;(2)HAPE和HACE的临床诊断多用CT,而在建立动物模型时并未用CT证明疾病的发生,与临床诊断方法不完全匹配;(3)现有急性高原病动物模型多在高原环境模拟舱建立,高原地区SPF级实验室少,在实地建立的案例很少,实地力竭运动的动物模型有待建立。