表面活性剂对琼式不动杆菌LH-1-1降解溴氰菊酯的影响
2021-01-22吴敏唐洁胡琼雷丹张庆
吴敏 唐洁 胡琼 雷丹 张庆
(1. 西华大学食品与生物工程学院,成都 610039;2. 西华大学食品与生物工程学院古法发酵生物技术研究所,成都 610039)
溴氰菊酯(Deltamethrin,DM)属二代(II型)拟除虫菊酯类杀虫剂,具有低毒、高效和持久性低的特点,在农业和林业中广泛使用[1]。但随着DM的大范围使用和有关拟除虫菊酯农药检测技术的进一步提高,DM残留问题逐渐暴露。研究发现其对多种水生生物具有神经、心血管和生殖毒性[1-3]。面对日趋严重的残留问题,微生物修复因其高效、无毒、无二次污染,易于操作,成本低等优点成为解决DM残留问题的首选方法[4-6]。但由于DM是一种疏水性有机物,不容易被微生物菌株吸附并降解。为了增加疏水性污染物的溶解,增大其与微生物的接触机会,从而提高其生物降解率,表面活性剂强化微生物降解修复是一个有效的方法[7-8]。近年来,已有大量表面活性剂用于疏水性污染物的生物修复中,证实在β-氯氰菊酯[5,9]、柴油[10]、苯酚[11]、染料[12-13]、石油[14]、正己烷[15]、菲[16-17]及DDT[18]等的生物降解体系中添加表面活性剂对提高生物修复效率十分有效。但表面活性剂在DM生物降解中的应用还鲜见报道,因此具有研究意义。
黄敏等[14]、姜霞等[19]、Zhong等[20]的研究表明不同类型的表面活性剂不仅可影响疏水性污染物的溶解度,还可能对菌株的生长呈现抑制作用,进而影响污染物的降解效率。因此对表面活性剂的类型选择是重要的。Tween-20是被广泛用于制药和食品等工业的乳化剂,CTAB和AES是洗化产品的主要成分,也广泛存在于生活环境中。此外,王为中等[21]测定水体中DM残留量时,在萃取体系中加入Tween-20提高了DM的萃取率;Ahmad等[22]利用CTAB改性膨润土(CTAB-BT)能显著提高对DM的吸附作用。因此,选择上述3种表面活性剂作为研究对象。
黄敏等[14]、Wei等[15]的研究表明在表面活性剂的不同CMC作用下,对微生物降解疏水性污染物的效果有较大差别。CMC是表面活性剂发挥增溶作用的重要指标,是DM能否与菌株更好接触的关键。当表面活性剂浓度稍大于CMC时会形成具有疏水内核的胶束,此时才能有效增强疏水性污染物在水中的溶解度,促使污染物与微生物更好的接触与吸附,从而提高生物修复效率[7,10,16,23];有研究表明,当表面活性剂浓度为CMC时,菌株对促进苯酚的降解达到最佳效果[11]。而且CMC易受到电解质、温度、表面活性剂结构、增溶物结构等影响[24],故在DM同一降解体系中测定表面活性剂的CMC,以确定其最佳添加量是尤为重要的。
综上,本研究采用前期筛选到具备DM较高降解能力的Acinetobacter juniiLH-1-1为目标菌株,通过荧光光谱法测定了DM同一降解体系中阳离子表面活性剂十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium bromide,CTAB)、阴离子表面活性剂脂肪醇醚硫酸钠(Fatty alcohol ether sulfate,AES)非离子表面活性剂聚氧乙烯(20)山梨醇酐单月桂酸酯(Tween-20)的CMC,并进一步探讨了3种表面活性剂在各CMC对菌株生长、DM增溶作用和菌株降解DM的影响,以期为表面活性剂在DM的高效生物降解中的应用提供理论支持。
1 材料与方法
1.1 材料
1.1.1 菌株 琼式不动杆菌LH-1-1(A. juniiLH-1-1):本实验室前期从长期受拟除虫菊酯类农药污染的草莓根系土壤中筛选得到,培养96 h对75 mg/L的DM降解率达到82.36%[25];保存于西华大学食品与生物工程学院微生物实验室。
1.1.2 培养基 Luria-Bertani(LB)培养基、最佳降解培养基(Optimal medium,OM)[25];LB-DM培养基、OM-DM培养基:分别向LB培养基和OM培养基中加入一定量DM母液制成,使DM最终浓度为75 mg/L,121℃灭菌15 min。
1.2 方法
1.2.1 菌悬液的制备 将菌株LH-1-1接种至LB培养基,30℃、180 r/min振荡培养48 h后转接至LB-DM培养基中,30℃、180 r/min振荡培养48 h。将培养液于4℃、10000 r/min离心10 min,收集沉淀菌体,以无菌生理盐水重悬,调整菌体细胞浓度,制成OD600≈1.0的菌悬液。
1.2.2 DM的检测 样品处理、检测方法:参照胡琼等[25]的方法。
1.2.3 临界胶束浓度的测定 测定方法[26-27]:溶剂为甲醇,配制浓度为4×10-3mol/L的芘溶液;用OM培养基分别配制50 mmol/L浓度的CTAB、AES和Tween-20溶液。分别吸取0.1 mL芘溶液于10个100 mL容量瓶,待甲醇挥发后加入不同体积的CTAB、AES和Tween-20溶液,用OM培养基定容,使芘的最终浓度为4×10-6mol/L,配制10 个不同浓度的CTAB、AES和Tween-20溶液(0.004、0.06、0.2、0.8、1.0、2.0、4.0、6.0、10.0和14.0 mmol/L)。将所有样品超声混匀30 min后,于35℃水浴20 min,室温静置过夜,测定各体系的荧光光谱。重复3次。
1.2.4 表面活性剂对菌株LH-1-1生长的影响 分别 配 制 一 系 列 含CMC(0、0.05、0.1、0.5、1.0、1.5、2.0和5.0 CMC)表面活性剂(CTAB、AES和Tween-20)的OM培养基,以不含表面活性剂的OM培养基作为空白对照,每组实验重复3次。分别将200 mL OM培养基装入500 mL锥形瓶中,接入1.0 mL菌悬液,于30℃、180 r/min振荡培养定时取样测定生物量(以OD600表示)。
1.2.5 表面活性剂对DM增溶作用的影响 分别配制一系列含CMC(0、0.05、0.1、0.5、1.0、1.5、2.0和5.0)表面活性剂(CTAB、AES和Tween-20)的OM培养基,取5 mL装于 50 mL锥形瓶中,加入1.0 mg DM,40 kHz、300 W超声辅助溶解30 min,30℃、180 r/min振 荡24 h,10000 r/min离 心10 min,去除沉淀(未溶解DM)。HPLC法检测上清液中DM含量,即DM在不同表面活性剂溶液中的溶解度。以加入5 mL OM培养基溶解DM的样品作为空白对照,每组实验重复3次。
1.2.6 表面活性剂对菌株LH-1-1降解DM的影响 分别配制一系列含CMC(0、0.05、0.1、0.5、1.0、1.5、2.0和5.0)表面活性剂(CTAB、AES和Tween-20)的OM培养基,以不含表面活性剂的OM-DM培养基做阳性对照,不接种菌悬液而接入等体积无菌水的OM-DM培养基做阴性空白对照,每组实验重复3次。分别将25 mL OM-DM培养基装于50 mL锥形瓶中,接入体积分数为5%菌悬液,30℃、180 r/min振荡培养72 h。HPLC法测定培养液中的DM含量,按下式计算DM降解率。
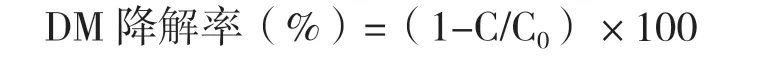
式中:C0为未接入菌悬液的培养基中DM的含量;C为接入菌悬液的培养基中DM的含量
2 结果
2.1 临界胶束浓度的测定
芘在不同浓度的表面活性剂(CTAB、AES和Tween-20)溶液中经335 nm的光激发后的荧光光谱如图1所示,横坐标为荧光发射波长(λ),纵坐标为荧光光强(I)。373 nm处峰的荧光强度I1和384 nm处峰的荧光强度I3之比强烈依赖于体系的极性,故可用I1/I3值表示体系的微极性,并用于表面活性剂(CTAB、AES和Tween-20)CMC的测定。
用I1/I3比值与(CTAB、AES和Tween-20)浓度的负对数-lnc作图,得到I1/I3随-lnc变化关系曲线(图2)。从图中可看出当表面活性剂浓度较低时(低于CMC),I1/I3的比值基本不变,此时表面活性剂分子在溶液中几乎以单体形式存在,胶束聚集体数量极少;但随着表面活性剂浓度大于CMC时,其在溶液中以胶束形式存在,I1/I3值发生突变。所以分别从高、低浓度两端作曲线的切线,得到2条切线的交点即为CMC。得到CTAB、AES和Tween20的CMC分别0.793 mmol/L、0.547 mmol/L和0.031 mmol/L。
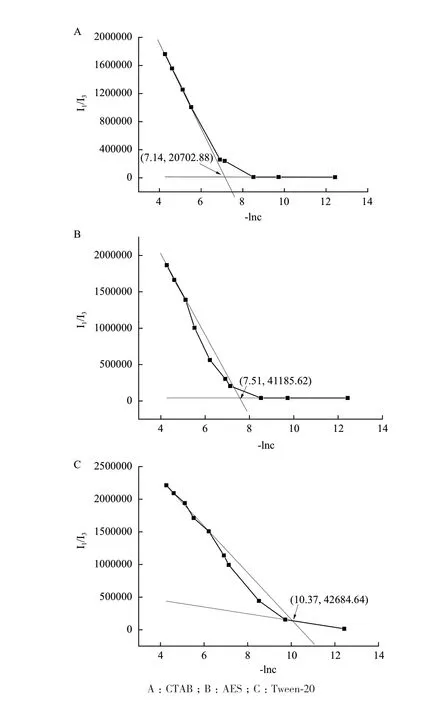
图2 I1/I3随-lnc(底物)变化曲线
2.2 表面活性剂对菌株LH-1-1 生长的影响
菌株的生物量是降解DM的重要因素之一,得到不同CMC表面活性剂的培养基中菌株LH-1-1的OD600值如图3所示。低浓度阳离子表面活性剂CTAB对菌株的生长略有促进作用;阴离子表面活性剂AES对菌株生长有抑制作用,不利于菌株LH-1-1生长,且随着表面活性剂浓度的增加抑制作用更加显著;高浓度的非离子表面活性剂Tween-20对微生物的生长有一定的促进作用。
2.3 表面活性剂对DM增溶作用的影响
DM在3种不同类型表面活性剂溶液中的溶解度,如图4所示。当表面活性剂浓度小于CMC时胶束未形成,表面活性剂对DM增溶作用不明显。在1-2 CMC的条件下DM增溶效果最为明显,且随着表面活性剂浓度增加DM的溶解度增大,其中CTAB增溶效果最好,当CTAB浓度为2 CMC和5 CMC时,DM溶解度分别达到16.24 mg/L和17.43 mg/L,分别促进了14.56 mg和15.75 mg的DM溶解(空白组DM溶解度为1.68 mg/L);Tween-20增溶效果次之,在5 CMC时,溶解度为14.35 mg/L;AES增溶效果最差,在5 CMC时,溶解度为9.86 mg/L。
2.4 表面活性剂对菌株LH-1-1降解DM的影响
培养72 h时各CMC表面活性剂培养液中菌株LH-1-1对DM的降解率,如图5所示。从图中可以看出,含有CTAB的培养基中菌株对DM的降解能力最高;CTAB含量在1.5 CMC、2 CMC、5 CMC时DM降解率分别为96.89%、98.20%和98.54%,随着CTAB含量的增加,DM降解率也随之提高。综合经济成本和环境保护考虑,CTAB含量在2 CMC时降解效果最好,且较未添加表面活性剂的阳性对照组(73.89%)降解率提高了24.31%。Tween-20对菌株降解DM影响较小,在较高CMC时有略有促进作用。而含有AES的培养基中DM降解率较空白低,且随着AES含量的增大,抑制作用更明显。
3 讨论
DM在环境中累积的毒性引起广泛关注,要对污染的环境进行有效的生物修复,除了对降解污染物的微生物进行探索和研究外,通过添加适宜浓度的表面活性剂利用其增溶等作用辅助去除环境中难降解、难被利用和难溶的污染物,增加污染物的生物利用度用于改善其生物降解也十分重要[28-30]。当体系中表面活性剂浓度大于CMC时,溶液中才会形成具有疏水内核的胶束,从而增大DM在水溶液中的溶解度[7]。但CMC受诸多环境因素的影响,为保证实验研究的准确性,本研究通过荧光光谱仪测定了3种表面活性剂的CMC,得到CTAB、AES和Tween-20的CMC分 别 为0.793 mmol/L、0.547 mmol/L、0.031 mmol/L。
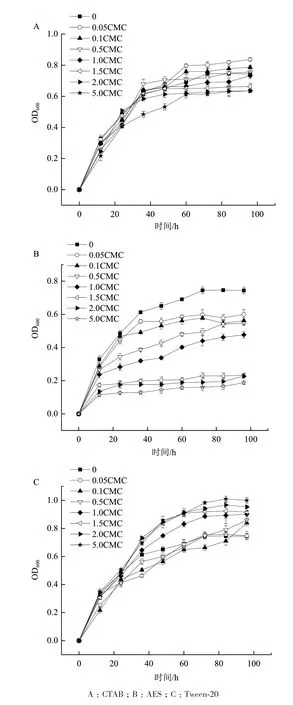
图3 表面活性剂对菌株LH-1-1生长的影响
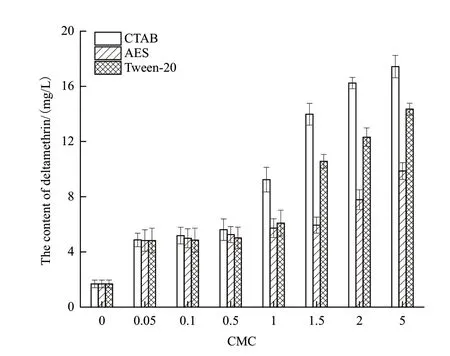
图4 表面活性剂对DM的增溶作用
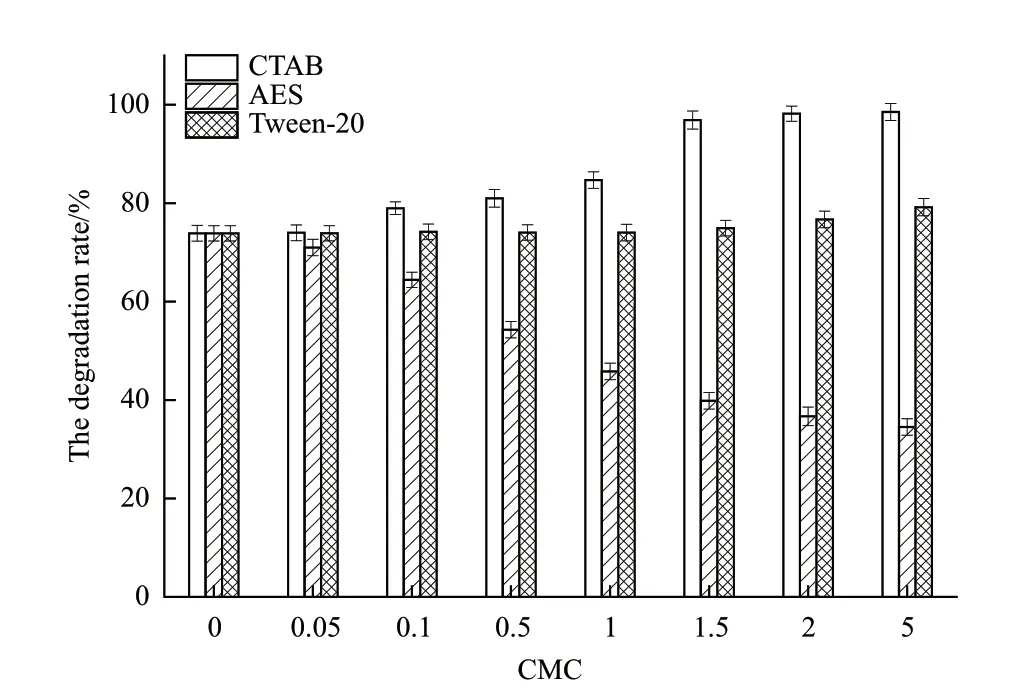
图5 表面活性剂对DM降解的影响
同时,探究了3种不同类型表面活性剂各CMC对A. juniiLH-1-1生长、DM增溶作用和菌株降解DM的影响。本研究结果显示各CMC的CTAB对菌株的生长无明显影响;AES对菌株生长有抑制作用,不利于菌株LH-1-1生长,且随着表面活性剂浓度的增加抑制作用更加显著,可能是这种阴离子表面活性剂使培养基环境中的电荷密度发生改变,从而导致微生物细胞膜变性,影响微生物的正常分裂繁殖[5];高浓度Tween-20对菌株的生长有一定的促进作用,可能是微生物优先利用Tween-20作为生长的能源物质[5]。同时CTAB、AES和Tween-20对DM均具有较强的增溶作用,且随着表面活性剂含量增加,DM溶解度也随之增加,这与疏水性染料溶解度随表面活性剂浓度的增大而增加的趋势是一致的[31]。其中CTAB对DM的增溶作用最明显,可能是由于稍高浓度的CTAB对DM具有较强的增溶作用,同时对菌株生长无显著影响,增加了DM与菌株之间的接触,DM的可利用度增加,故而降解率更高[28]。也可能是因为在3种表面活性剂中,CTAB的直链烷烃链最长,有利于胶束聚集数的增大,从而形成体积更大的胶束,对疏水性污染物的溶解能力更好[24];Wei等[15]和Lee等[32]的研究结果也表明具有较长直链疏水烷基链的表面活性剂,对疏水性污染物的增溶和吸附作用最显著。González等[33]研究证明在土壤中添加CTAB能更好地溶解农药;Lu等[34]的调查研究也证明在稻田中加入阳离子表面活性剂十二烷基溴化吡啶(1-Dodecylpyridinium bromide,DDPB)会促进多环芳烃物质溶解;闫瑞和余晖等[35]研究也表明季铵盐型阳离子表面活性剂对多环芳烃菲和芘有较好的增溶效果。
本实验在菌株LH-1-1降解DM的体系中添加2 CMC阳离子表面活性剂CTAB,可明显促进菌株对DM的降解,培养72 h 对75 mg/L DM的降解率达到98.20%,且降解率随表面活性剂浓度的增加而增大。目前已有报道多食鞘氨醇杆菌SW(Sphingobacterium multivorum)培养120 h 对1.0 mg/L DM的降解率为76.4%[4];赖氨酸芽孢杆菌ZJ6(Lysinibacillussp.)培养7 d 可降解57.2%浓度为100 mg/L-200 mg/L的DM[6];蜡状芽孢杆菌Y1(Bacillus cereus)96 h对100 mg/L DM降解率为22.8%[36];嗜麦芽寡养单胞菌XQ08(Stenotropomonas maltophilia)培养5 d 对50 mg/L DM的降解率为66.7%[37];阴沟肠杆菌X09(Enterobacter cloacae)和荧光假单胞菌X20(Pseudomonas fluorescens)培养96 h对50 mg/L DM降解率分别为65%和69.3%[38];假单胞菌属DE29(Pseudomonassp.)培养7 d 对100 mg/L DM的降解率为96.32%[39]。本研究结果说明添加表面活性剂不仅能提高DM的降解率,也缩短了DM降解所需时间,为高效生物修复DM污染环境奠定重要的实验理论基础。表明表面活性剂在生物修复受拟除虫菊酯类农药污染的环境方面具有一定的应用价值,且其作用机理等也值得进一步研究。
4 结论
本研究测定了3种不同类型表面活性剂(CTAB、AES和Tween-20)在同一DM降解体系中的CMC分别 为0.793 mmol/L、0.547 mmol/L和0.031 mmol/L。在各CMC条件下发现CTAB对A. juniiLH-1-1的生长无明显影响,AES对菌株生长有抑制作用,Tween-20对A. juniiLH-1-1的生长有一定的促进作用;CTAB、AES和Tween-20对DM均具有较强的增溶作用;其中CTAB可显著提高A. juniiLH-1-1对DM的降解率,当其含量为2 CMC,72 h时DM降解率达到98.20%,较未添加表面活性剂的对照组(阳性)降解率提高了24.31%。
