新型冠状病毒肺炎疫情防控相关进展
2021-01-22李兰娟朱雪灵
李兰娟 朱雪灵
2019年12月,一种不明原因的肺炎在湖北武汉爆发,并在全国各地大面积传播[1-2]。2020年1月初,科学家们将这一病毒从感染患者中分离出;2月11日,国际病毒分类委员会将该病毒命名为2019新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARSCoV-2);2月11日,WHO正式将这一疾病命名为新型冠状病毒肺炎(corona virus disease 2019,COVID-19)[3]。3月11日,WHO认定COVID-19为大流行病。为应对这一重大突发传染病,1月3日凌晨国家卫生健康委员会派出专家组制定了《武汉不明原因的病毒性肺炎诊疗方案(试行)》。截至8月19日,我国COVID-19诊疗方案已更新到第八版。同时WHO也不断细化和完善关于COVID-19疫情防控的指导文件。
目前,全球范围内第二波COVID-19疫情来势凶猛。根据WHO11月18日发布的数据显示,全球单日新增病例达45万例[4],许多国家重新封城,而我国境外输入病例逐渐增多,COVID-19的防控工作进入到新的阶段。虽然我国对于如何筛查、确诊和治疗COVID-19感染患者已经有了一套相对成熟的诊疗方案,但仍迫切需要全面了解COVID-19发病机制并研制出针对病毒的特效药和预防病毒感染的疫苗等。本文就COVID-19疫情防控相关进展作一述评。
1 病原学
1.1 病毒结构 SARS-CoV-2是一种新型的β属的有包膜的冠状正链单链RNA病毒[5-6],是已知的、可以感染人类的第7种冠状病毒。该病毒含有4种结构蛋白,分别是核蛋白(N蛋白)、病毒包膜(E蛋白)、基质蛋白(M蛋白)和刺突蛋白(S蛋白)[7]。N蛋白包裹RNA基因组形成核衣壳,M蛋白与核衣壳形成核心结构,同时与E蛋白、S蛋白共同形成病毒包膜[8]。与严重急性呼吸综合征冠状病毒(SARS-CoV)相似,SARS-CoV-2的S蛋白包含负责与宿主细胞受体结合的S1亚基和负责病毒包膜与细胞膜融合的S2亚单位,通过S1的受体结合域(RBD)与细胞表面受体血管紧张素转化酶2(ACE2)结合,从而使病毒进入细胞[9],因此S蛋白是感染后产生中和抗体的主要靶抗原,也是药物治疗和疫苗设计的靶标[10]。
科学家们发现SARS-CoV-2的S蛋白有1个Furin裂解位点,S蛋白的活化需要通过Furin样蛋白酶裂解S1/S2,该位点使得SARS-CoV-2的S蛋白有别于SARS-CoV的S蛋白,可能增加SARS-CoV-2的传播性并改变其致病性[10]。通过冷冻电子显微镜,科学家们发现SARS-CoV-2的S蛋白三聚体存在多种构象状态,3个RBD分别显示出“向上”或“向下”2种不同的方向。当S1亚基的RBD处于“向下”构象状态时,病毒与细胞无法结合;而当S1亚基的RBD处于“向上”构象状态时,S1亚基可以与细胞受体相结合,从而破坏S蛋白三聚体融合前构象的稳定性,导致S1亚基脱落,并从S2亚基过度到融合后的针状构象,具有3个同轴缠绕的螺旋[10-12]。
最近,浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟院士的课题组与清华大学生命科学学院李赛研究员的课题组进行合作,利用高分辨冷冻电镜断层成像技术揭示了SARS-CoV-2的分子结构,原位解析了病毒表面S蛋白的数量、天然构象、分布及糖基化组成,开创性地揭示了SARS-CoV-2核糖N蛋白复合物(RNPs)的天然结构及其分子组装机制[13]。该研究发现,相比于其他囊膜病毒,SARS-CoV-2的S蛋白在病毒表面分布随机且拷贝数较少,平均约30个,仅为流感病毒的1/10~1/5。S蛋白在靠近病毒囊膜的茎部区柔性较大,使其能够在病毒表面自由旋转甚至可能游走,就像“链锤”一样。这个特性使得SARS-CoV-2在侵染细胞时,或可自由调整S蛋白的方位,方便与单个甚至多个受体结合,这可能是它高传染性的原因之一。S蛋白在天然病毒表面可呈现两种状态,其中97%处于融合前状态,3%处于融合后状态。融合前状态又有RBD闭合(54%)、抬起(46%)两种子状态,只有抬起状态的RBD才能和ACE2受体结合。一般而言,S蛋白只有受到pH变化、受体结合等因子触发时,才会向融合后状态转变,而SARS-CoV-2带有疑似“自发”的融合后状态。这种状态的S蛋白已经缺失了其S1亚基,剩下的S2亚基已经发生较大的形变。该研究也指出,SARSCoV-2的RNPs呈串珠状,在病毒体内以六聚型、正四面体型两种结构排列,有序地将约30 kB的超长RNA包装到直径约80 nm的病毒管腔中。目前,科学家们仍在不断深入探索SARS-CoV-2的分子结构,这对于了解SARS-CoV-2的生物特性、研究中和抗体、设计疫苗、研发抗病毒药物等具有重要意义。
1.2 病毒的基因组学 SARS-CoV-2具有最大的RNA病毒基因组,长度为26~32 kB[6]。它具有5′端甲基化帽子结构和3′端poly(A)尾结构,由结构蛋白复合体包被,形成冠状的包被病毒[8]。SARS-CoV-2的基因组按以下顺序排列:5′端帽子结构-复制酶(开放阅读框ORF 1a/b)-结构蛋白(S蛋白-E蛋白-M蛋白-N蛋白)-辅助蛋白(如 ORF 3、6、7a、7b、8 和 9b)-3′端 poly(A)尾结构[8]。通过对SARS-CoV-2的基因组序列进行比较与分析,科学家们发现它与几种蝙蝠冠状病毒的基因组非常相似[14]。SARS-CoV-2与BatCoV基因组的序列相似度高达96.2%[15],提示它可能也来源于蝙蝠这一SARS样冠状病毒天然储存库[16]。同时SARS-CoV-2与穿山甲所携带的病毒基因组序列也有着很高的相似性(91.02%),提示穿山甲也可能是SARS-CoV-2样冠状病毒的天然储存库[17]。之后的研究提出了穿山甲是SARS-CoV-2中间宿主的可能性[18],但是确切的结论仍不可知。
SARS-CoV-2作为RNA病毒,具有易出错的RNA依赖性RNA聚合酶,这使得该病毒易发生基因突变和基因重组[19]。对SARS-CoV-2基因组进行分析后,科学家们根据单核苷酸多态性的不同,建议将该病毒分为S、L两个主要的亚型;与原始的S型相比,L型病毒更具侵袭性和传染性[20]。科学家们正不断地从COVID-19患者中实时收集SARS-CoV-2基因组序列数据。截至2020年11月18日,GISAID数据库已收集205 493条人类冠状病毒完整序列[21]。李兰娟院士团队研究发现,SARS-CoV-2的自然突变会严重影响病毒的复制能力和感染能力,不同毒株之间的滴度差异最高可达1 500倍,并影响感染者病情的严重程度[22]。SARS-CoV-2无症状感染也可能与其基因突变相关[23]。
2 流行病学
2.1 传染源、传播途径和中间宿主 SARS-CoV-2的传染源主要是感染患者和无症状感染者,重症患者相对轻症患者更具传染性,尤其要警惕无症状感染者的传染性[24]。此外,目前已有恢复期患者呼吸道标本核酸检测持续阳性的案例,这些患者仍是病毒携带者[25],这也增加了疫情防控工作的难度。国家卫生健康委员会颁布的《COVID-19诊疗方案(试行第八版)》建议,通过抗体检测、病毒培养分离等方法对核酸检测持续阳性超过4周的恢复期患者的传染性进行综合评估,判断是否出院,并且建议出院后继续隔离14 d。
SARS-CoV-2的主要传播途径是呼吸道飞沫传播和密切接触传播。当处于相对封闭的环境中且长时间暴露于高浓度气溶胶时,也存在经气溶胶传播的可能。此外,由于在确诊患者的粪便、尿液标本中也可分离出SARS-CoV-2,因此也存在其环境污染造成接触传播或气溶胶传播的可能[26-28]。
到目前为止,SARS-CoV-2的中间宿主尚未明确。通过实验,科学家们发现SARS-CoV-2具有感染多种哺乳动物的能力,包括黑猩猩、猫、牛和恒河猴等,这些都是可能的中间宿主;同时,科学家们也可以利用这些动物模型进一步研究防治COVID-19的疫苗和特效药[29]。
当SARS-CoV-2处于温度21~23℃、相对湿度40%的环境中,在物品表面有较长的存活时间,具有潜在的传播风险[30]。天津市卫生健康委员会近期报道的SARS-CoV-2无症状感染者为当地冷库运输人员,天津市疾病预防控制中心对该患者的呼吸道标本和相关冷库环境样本进行了SARS-CoV-2全基因组高通量测序和序列分析,结果显示:与北美3至6月份流行毒株高度近似,属于L基因型欧洲家系分支Ⅱ(北美分支)[31-32]。因此,进口冷链食品也是一大传染方式。为此,我国出台了《进口冷链食品预防性全面消毒工作方案》[33]。
研究表明,早在2019年12月湖北武汉出现COVID-19疫情之前,SARS-CoV-2可能已经出现[34]。WHO在2020年11月23日COVID-19媒体通报会上指出,武汉可能只是病毒传播的扩散地,寻找世界首例SARS-CoV-2感染病例是流行病学调查的重要内容,对疫情防治工作具有重要意义。
2.2 全球大流行 截至2020年11月22日,全球共报道COVID-19确诊患者5 800多万例[35],见表1。
(3)在投标时也有了相应的实时成本资料。招投标阶段,企业定额对投标单位有很高的参考价值,投标单位可以根据企业定额快速制定投标方案并报价。
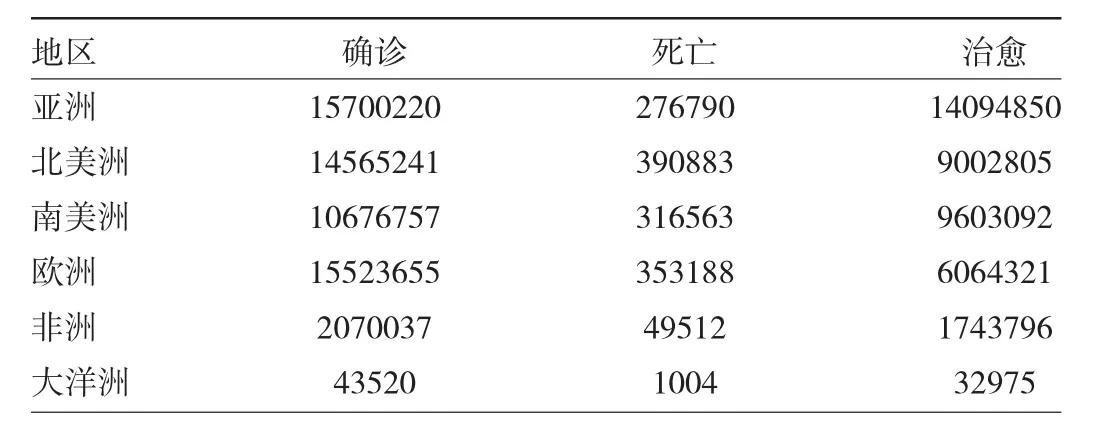
表1 截至2020年11月22日更新的全球COVID-19疫情数据(例)
2.3 发病机制 目前,关于COVID-19的发病机制尚未完全明确。已知SARS-CoV-2通过ACE2进入细胞,而ACE2在鼻黏膜、支气管、肺、心脏、食管、肾脏、胃、膀胱和回肠中广泛表达,推测病毒可能会感染各个器官[36]。COVID-19患者可能出现急性呼吸窘迫综合征(ARDS),存在严重的呼吸衰竭,最终死亡[37]。研究表明,SARSCoV-2感染期间,人体内存在较强的免疫应答,危重时甚至引发细胞因子风暴[38],引起肺毛细血管内皮细胞和肺泡上皮细胞的弥漫性损伤,分泌物大量积聚而阻塞气道,从而导致ARDS,最终出现严重的呼吸衰竭、死亡[37,39]。最新研究提出,COVID-19的发病机制可能存在两个阶段:第一阶段包括免疫系统抑制、紧密连接蛋白受损以及大规模的代谢紊乱;第二阶段部分免疫应答激活,进一步可能导致细胞因子风暴和器官损伤的发生[40]。
2.4 临床表现 随着对COVID-19研究的逐渐深入[28,41],目前已知COVID-19最常见症状有发热、干咳和乏力。轻症患者可表现出低热、轻微乏力、嗅觉及味觉障碍等症状,重症患者多在发病1周后出现呼吸困难和(或)低氧血症,危重症患者可快速进展为ARDS、脓毒症休克、难以纠正的代谢性酸中毒、出凝血功能障碍、多器官功能衰竭等。重症及危重症患者可能出现中低热,甚至无明显发热症状。少数患者伴有鼻塞、流涕、咽痛、结膜炎、肌痛、腹泻等症状,极少数患者还可能出现中枢神经系统受累、肢端缺血性坏死等临床表现。目前有越来越多患者感染SARS-CoV-2后可无明显临床症状。
3 诊断检测方法
为了应对当下SARS-CoV-2大流行的情况,WHO发布了临时指导文件《SARS-CoV-2的诊断检测》[42],提出了多种快速诊断COVID-19的方法,包括核酸扩增检测、抗体检测、抗原检测。
根据目前的报道,最常见的核酸扩增检测方法是RT-PCR,其他还有高通量测序技术、等温核酸扩增技术(包括逆转录环介导等温扩增、转录介导扩增、重组酶辅助扩增、针对规律成簇间隔短回文重复的检测等)、分子微阵列分析等[43-45]。
抗体检测也是目前常用的方法。它可以同时用于感染进展情况以及机体对感染的免疫状态的评估。特异性免疫球蛋白M(IgM)通常用于提示早期感染,特异性免疫球蛋白G(IgG)则提示现症感染或既往感染。抗体检测技术包括ELISA、横向流动免疫测定、化学发光免疫测定等[43]。
目前,抗原检测技术也正在研究中。WHO指出,与核酸扩增检测相比,抗原检测的目标没有扩增,检测不太灵敏,可能出现假阴性。同时,抗原检测可能会识别其他冠状病毒,出现假阳性[42]。针对SARS-CoV-2的各项检测技术仍需要不断的完善和优化,以应对大规模病毒筛查的需求。
4 病毒载量和病毒阴转时间
研究指出,COVID-19患者在症状发作1周内,上呼吸道样本中病毒载量达到峰值,提示疾病早期病毒脱落的程度较高,传染性较强[46-47]。SARS-CoV-2感染患者的传染性病毒脱落时间一般持续7~14 d[48-49],少数患者的传染性病毒脱落时间长达近20 d[50]。尽管病毒在疾病恢复期无法从上呼吸道样本中分离出来,核酸检测结果可能仍保持阳性[50]。最近1个真实案例报道了1例患有慢性淋巴细胞白血病、低丙种球蛋白血症的71岁老年女性患者,其传染性病毒脱落时间至少长达70 d,且在感染后70 d时仍有较强的传染性,而她的核酸检测直到感染后第105天才转阴[51]。当核酸检测转阴后,仍有复阳的可能,但大多数患者的呼吸道样本中不存在病毒复制[52]。因此,仍需重视康复出院患者的后续隔离、随访工作,避免出现成为传染源的可能性。
一些研究发现COVID-19重症患者呼吸道样本的病毒载量较轻症患者高[53],入院时基线病毒载量较高的患者病情进展可能更为迅速[54],提示病毒载量可能与疾病预后相关。相反的,另有研究指出疾病的严重程度与病毒载量之间不存在关联[46,55-56]。而病毒阴转时间延长可能与年龄、性别、起病至住院间隔时间、是否采取机械通气、是否淋巴细胞减少等存在关联[57-59]。然而,如何迅速降低病毒载量,缩短病毒阴转时间,加快患者康复进程,仍需进一步深入研究。
5 COVID-19血清学研究
研究发现,COVID-19起病后第7天,约50%的患者出现血清转化,产生IgM、IgG;而到第14天时,所有患者发生血清转化[48]。一些研究发现患者体内IgG可以同时或早于IgM升高,也有研究发现IgM血清转化早于IgG,这可能是检测方法的灵敏度不同所致[47,60]。目前发现,总抗体检测的灵敏度高于IgM和IgG。总抗体检测方法可被认为是所有抗体的集合,包括IgM、IgG等,鉴于它的高灵敏度,可被应用于临床中[60-61]。
冰岛科学家曾于9月初报道过COVID-19患者体内的抗病毒抗体在疾病确诊后至少能稳定保持4个月[62]。最新研究发现,90%的患者体内SARS-CoV-2中和抗体在感染后5个月时仍维持在高于1∶320滴度的水平,其中超过70%的患者体内SARS-CoV-2中和抗体滴度在1∶960以上,这提示自然感染或接种SARSCoV-2疫苗,可能会显著降低再次感染的风险[63]。然而,多个病例报道发现SARS-CoV-2存在二次感染,对于基础免疫力低下的患者,甚至存在二次感染后死亡的风险[64-66]。研究者们推测,发生二次感染的原因可能包括以下 4 个:(1)二次感染接触的病毒量更高[67];(2)二次感染的病毒毒力增强;(3)患者体内抗体滴度下降,免疫力下降[65-66];(4)存在抗体依赖性增强机制[68]。因此,即使已经通过自然感染或接种疫苗获得免疫力者,在日常生活中仍有必要采取防护措施,避免再次感染。
Solidarity Ⅱ项目是由WHO组织的、以收集全球SARS-CoV-2感染患者血液样本抗体数据为目的的全球合作项目,旨在促进全球范围内SARS-CoV-2血清学研究,以期更好地了解和应对COVID-19全球大流行[69]。
6 治疗与预防
目前尚无治疗COVID-19的特效药,治疗方案仍以综合治疗为主。浙江大学医学院附属第一医院医疗团队在人感染H7N9禽流感患者救治过程中累积经验总结出的“四抗二平衡”治疗策略,依然适用于COVID-19患者的临床救治[70]。“四抗二平衡”治疗策略具体指的是抗病毒、抗休克、抗低氧血症、抗继发感染、维持水电解质酸碱平衡、维持微生态平衡。目前仍然可以试用的抗病毒药物包括利巴韦林、磷酸氯喹、阿比多尔等[28]。人工肝血液净化系统可以清除炎症因子,阻断“细胞因子风暴”,减轻炎症反应对机体的损伤,已被证明在人感染H7N9禽流感重症患者的救治中具有重要作用[71-72]。而接受人工肝血液净化系统治疗的重型、危重型COVID-19患者预后良好[70]。具体方法见《人工肝血液净化系统应用于重型、危重型新型冠状病毒肺炎治疗的专家共识》[73]。研究发现,COVID-19患者肠道内菌群多样性较低,链球菌等机会致病菌的相对丰度显著增加,提示SARS-CoV-2可能会破坏肠道微生态平衡[74]。然而,肠道微生态与COVID-19之间的联系仍需要更深入的研究明确,规范的益生菌疗法仍需更多临床试验进行探索。
2020年12月1日,中国科学院生物物理研究所王祥喜研究员、浙江大学医学院附属第一医院李兰娟院士、军事医学科学院微生物流行病研究所秦成峰研究员、江苏省疾病预防控制中心朱凤才研究员、四川大学华西医院李为民教授以及三优生物医药有限公司等联合研究团队提出了抗SARS-CoV-2的中和抗体鸡尾酒疗法[75-76]。该研究发现了一种高效的SARS-CoV-2特异性的中和抗体p17,并与团队前期筛选到的1株对冠状病毒β家族有广谱中和作用的人源化单克隆抗体H014联合使用[77],可以阻止SARS-CoV-2的S蛋白与细胞结合时的构象变化,从而阻止病毒入侵。p17与H014的鸡尾酒疗法可将抗体的保护效力提高3~10倍。随着研究的不断深入,有望发现更多可能有效治疗COVID-19的方法。
6.1 COVID-19药物临床试验 目前有超过4 000个关于COVID-19的临床试验正在进行中[78]。开展的药物临床试验包括抗病毒药物、免疫调节药物、与肾素-血管紧张素系统相关药物等;其他临床试验包括细胞疗法、氧气疗法和呼吸机支持、血浆疗法、中草药、生物制剂和疫苗等[79-80]。Solidarity项目是由WHO组织的、目前规模最大的全球性COVID-19治疗随机对照试验。根据WHO发布的中期结果,瑞德西韦、羟氯喹、洛匹那韦/利托那韦、干扰素疗法对COVID-19住院患者28 d病死率和住院病程的影响很小或没有影响,目前没有一种治疗方法能绝对降低患者病死率、改善肺通气功能或缩短住院时间等[81]。尽管如此,这项试验的成功开展也让我们看到了在SARS-CoV-2大流行期间开展大规模国际试验的可能性,同时这种模式可以帮助我们迅速评估新治疗方案的有效性。目前还有许多老药新用的临床试验正在开展。近期,美国报道的一项临床Ⅱ期试验结果发现,5-羟色胺再摄取抑制剂氟伏沙明或能通过免疫调节机制有效预防出现症状的COVID-19患者病情加重[82]。尽管这一临床试验尚需大规模验证,但提示了寻找避免COVID-19轻症患者病情进一步加重的方法的重要性。
6.2 预防COVID-19的疫苗 目前全球有超过200种SARS-CoV-2疫苗正在研发中[83]。疫苗的品种包括复制和非复制的重组病毒载体疫苗、病毒样颗粒疫苗(包括减毒活疫苗、灭活疫苗、类毒素疫苗等)、DNA疫苗、RNA疫苗、重组蛋白疫苗等[83]。陈薇院士团队研制的以腺病毒Ad5为载体的SARS-CoV-2疫苗,经随机双盲对照试验证实了其免疫原性和安全性[84]。最新报道称,美国辉瑞公司与德国BioNTech公司共同研制的BNT162b2 mRNA疫苗和美国Moderna公司研制的mRNA-1273疫苗或能将SARS-CoV-2感染病例减少90%以上[85-86]。这两种mRNA疫苗均含有一段经过优化的SARS-CoV-2的S蛋白mRNA,可以与人体细胞表面的ACE2受体相结合,诱导人体产生中和抗体,进而阻止SARS-CoV-2感染人体细胞[83]。
截至2020年12月2日,共有51种疫苗进入临床试验阶段,其中14种来自中国;共有14种疫苗进入Ⅲ期临床试验阶段,其中6种来自中国。这6种进入Ⅲ期临床试验阶段的疫苗中,4种为灭活疫苗,分别来自中国生物北京所、中国生物武汉所、科兴中维、中国医学科学院[87]。尽管疫苗的研制正在大规模开展并不断传来利好消息,我们仍需意识到SARS-CoV-2存在自然突变,可表现出不同的传播特性,可能对目前正在研制的SARS-CoV-2疫苗不敏感。
7 小结
距离COVID-19疫情爆发即将满1年,人类对SARS-CoV-2的认识正在不断完善,对COVID-19的有效防治方法正在不断探索中。尽管国内疫情暂时得到有效防控,但国际形势仍不容乐观。因此,迫切需要集合全球的力量,共同探索、研究SARS-CoV-2,尽快找到治疗COVID-19的特效药以及预防病毒感染的方法,早日恢复正常生产及生活秩序。
(浙江大学医学院附属第一医院传染病诊治国家重点实验室杨仕贵研究员、姚航平研究员、徐小微主任医师、徐凯进主任医师对该研究给予帮助,特此致谢)
