BHK-21细胞用于塞内卡病毒培养最高代次范围研究
2021-01-19李建华张智明何世岷窦海燕
李建华,张智明,何世岷,窦海燕,方 超,刘 旭
(哈药集团生物疫苗有限公司,哈尔滨 150069)
1 材料与方法
1.1 试验材料与试验动物
BHK-21细胞F11代,由哈药集团生物疫苗有限公司保存和提供。猪细小病毒L 株生产种子批E8代,由哈药集团生物疫苗有限公司制备、鉴定和保存。DMEM 培养基和0.25%胰酶,购自美国GIBCO公司;新生牛血清,购自美国Clark 公司。猪瘟病毒(CSFV)、细小病毒(PPV)和牛腹泻病毒(BVDV)荧光抗体均由中国兽医药品监察所提供。无菌检验用培养基:TG(硫乙醇酸盐培养基)、GA(酪胨琼脂)、GP(葡萄糖蛋白胨汤),均由哈药集团生物疫苗有限公司提供。支原体检验培养基购自北京海淀中海动物保健科技公司。0.5%豚鼠红细胞悬液按现行《中国兽药典》制备。40只2~4日龄裸鼠,购自哈尔滨医科大学附属第一医院动物室。
1.2 细胞传代
将生长良好的细胞单层,弃去上清,按培养液10%体积比加入0.25%胰酶-EDTA溶液,置37 ℃消化2~3 min,单层细胞分散后,去消化液,用含10%血清DMEM培养液冲洗瓶壁上细胞,稀释成每毫升含2.0×105个细胞后分装到细胞瓶中。按以上方法将BHK-21 细胞连续传代至F52代。取F11、F21、F31及F42代细胞进行细胞形态、无菌检验、支原体检验及外源病毒检测;取F31、F42及F52代细胞进行胞核学检查、细胞致瘤性检验及病毒培养适应性检验[1-6]。
1.3 细胞形态观察
用倒置显微镜进行细胞形态观察。
1.4 无菌检验和支原体检验
按现行《中国兽药典》附录进行无菌检验和支原体检验。
1.5 外源病毒检测
1.5.1 样品处理
取各代次细胞3 支,经3 次冻融后混合作为检品。
1.5.2 接种的细胞与样品的培养
(1)接种的细胞:将检品接种以下细胞:Vero细胞、MDBK细胞、PK15细胞。
(2)样品的接种与培养:将1.0 mL已处理的被检样品接种到已长成单层的上述细胞,另设一瓶未接种的正常细胞对照,并培养不少于14 d,其间至少继代1次。最后一次继代的细胞单层数量和培养面积应符合荧光抗体检查法、致细胞病变检查法和红细胞吸附性外源病毒检验的要求。
(3)判定:在至少14 d的培养期内,对细胞培养物进行常规检查,如果培养期间出现细胞病变,即判定为不符合规定。如无细胞病变,培养结束时,细胞单层应按以下方法检验。
1.5.3 检查方法
(1)荧光抗体检查法:最后一次继代的细胞单层培养5~7 d后用于荧光抗体检查。对每一种特定外源病毒的检验应至少包含三组细胞:①被检样品处理细胞;②最后一次继代时接种100~300 FAID50特定病毒的阳性对照细胞;③未加样品的阴性对照细胞。每一组细胞单层检查面积应不小于6 cm2。每一组细胞应按下列规定选择特异的抗病毒荧光抗体。①所有细胞均应检验:牛病毒性腹泻病毒(BVDV);②猪源细胞:猪细小病毒(PPV)、猪瘟病毒(CSFV)。
细胞单层样品经甲醇定后,用适宜的荧光抗体染色,检查每一组细胞单层是否存在特定外源病毒的荧光。阳性对照出现特异荧光,正常细胞无荧光时,如果被检样品出现外源性病毒特异性荧光,判为存在相应病毒污染而样品不合格。如果阳性对照组荧光不明显,或者正常细胞出现明显荧光,判为无结果,应重检。
(2)致细胞病变检查法:取经传代后培养至少7 d 敏感细胞单层(每个至少6 cm2)进行检验。用适宜染色液对细胞单层进行染色。观察细胞,检查包涵体、细胞融合形成的巨细胞、局部细胞坏死脱落或其他由外源病毒引起的CPE 出现情况。如果出现外源病毒所致的特异性CPE,判为样品不合格;如果疑有外源病毒污染,又不能通过其他试验排除这种可能性时,则判为样品不合格。
(3)红细胞吸附性外源病毒检验:取经传代后培养至少7 d的敏感细胞单层(每个至少6 cm2)进行检验。以PBS(pH 7.2,下同)洗涤细胞单层2~3次。加入适量0.2%的豚鼠红细胞和鸡红细胞的等量混合悬液,以覆盖单层表面为准,红细胞悬液可以分别滴加于不同的细胞单层上。选2个细胞单层,分别在2~8 ℃和20~25 ℃放置30 min 后,用PBS洗涤,检查红细胞吸附情况。如果出现外源病毒所致的红细胞吸附现象,判为样品不合格;如果疑有外源病毒污染,又不能通过其他试验排除这种可能性时,则判为样品不合格。
1.6 胞核学检查
取各代次细胞,分别加入含0.1 μg·mL-1秋水仙素的培养液作用2~4 h,离心弃去培养液。用Eargle's等渗盐水清洗,离心弃去液体,加入含1%酚红的低渗液(1 L 水加入4 滴1 mol·L-1NaHCO3),37 ℃作用30 min。加入醋酸/甲醛固定液,与细胞反应25 min。在加热板上加热至60 ℃左右,滴加1 mol·L-1盐酸作用10 min。用姬姆萨染色液染色后油镜下观察,取50 个处于有丝分裂中期的细胞进行检查,对染色体计数,观察染色体组型。
1.7 细胞致瘤性检验
1.7.1 试验分组
用裸鼠20 只,随机分成3 组。第1 组10 只裸鼠,皮下接种107 个待检细胞;第2 组5 只裸鼠,皮下接种107 个人宫颈癌细胞(HeLa)作为阳性对照;第3 组5 只裸鼠,皮下接种107 个人胚肺成纤维细胞(MRC-5)作为阴性对照。以上细胞均悬浮于200 μL细胞培养液。
1.7.2 观察与剖检
接种后每日观察有无结节或肿瘤形成,21 d剖检第1 组裸鼠5 只;剩余5 只裸鼠,继续观察,12周后全部剖检。阳性和阴性对照组观察21 d全部剖检,剖检后观察淋巴结和器官有无结节形成。
1.8 病毒培养适应性检验
1.8.1 病毒培养
按培养液体积0.5%比例,将毒种接种到各代次长满单层的BHK-21 细胞,置37 ℃中吸附1 h,加入含2%新生牛血清的DMEM培养液。置37 ℃含5% CO2培养箱培养,当细胞病变达到80%以上时,收获细胞及细胞培养物。
1.8.2 病毒含量
将BHK-21细胞制备为单细胞悬液铺于96孔细胞培养板,每孔100 μL(细胞含量7.0×104个·mL-1,置37 ℃含5%CO2培养箱中培养24 h。将收获的病毒液用DMEM 培养基作10 倍系列稀释,取10-6、10-7、10-8、10-94个稀释度,各加入培养24 h的96孔细胞培养板,每个稀释度接种96孔细胞培养板6孔,每孔100 μL,同时设立正常细胞6孔为阴性对照。上述细胞孔加入含2%新生牛血清的DMEM 培养液,每孔100 μL。置37 ℃含5%CO2培养箱中培养4 d,每天观察和记录各孔中病毒感染情况,按Reed-Muench法,计算病毒的致半数细胞感染滴度(TCID50)。
2 结果与分析
2.1 细胞形态
各代次BHK-21细胞置显微镜下观察,细胞轮廓清晰,呈梭形、多边形等多种形态、胞体大小基本一致。
2.2 无菌检验结果
按现行《中国兽药典》附录进行检验,各代次BHK-21细胞检验结果均为阴性,见表1。
2.3 支原体检验结果
按现行《中国兽药典》附录进行检验,各代次BHK-21细胞检验结果均为支原体阴性,见表2。
2.4 外源病毒检测结果
2.4.1 荧光抗体检查法检测结果
按现行《中国兽药典》附录进行各代次BHK-21细胞检测,结果见表3。
表1 无菌检验结果

表2 支原体检验结果

表3 荧光抗体法检测结果
2.4.2 致细胞病变法检测结果
按现行《中国兽药典》附录进行,各代次BHK-21细胞检测,结果见表4。

表4 致细胞病变法检测结果
2.4.3 红细胞吸附性外源病毒检测结果
按现行《中国兽药典》附录进行,各代次BHK-21细胞检测,结果见表5。

表5 红细胞吸附性外源病毒检测结果
2.5 胞核学检查
将各代次细胞染色体标本经姬姆萨染色,取50 个处于有丝分裂中期的细胞进行检查,结果显示,所有细胞的染色体模式数均不高于15%,核型相同。
2.6 细胞致瘤性检验
将各代次BHK-21 细胞颈部皮下接种裸鼠,21 d 及12 周剖检裸鼠,裸鼠各淋巴结和器官均无结节形成,阳性对照组5/5出现明显肿瘤,阴性对照组裸鼠均无结节形成,剖检结果见表6。
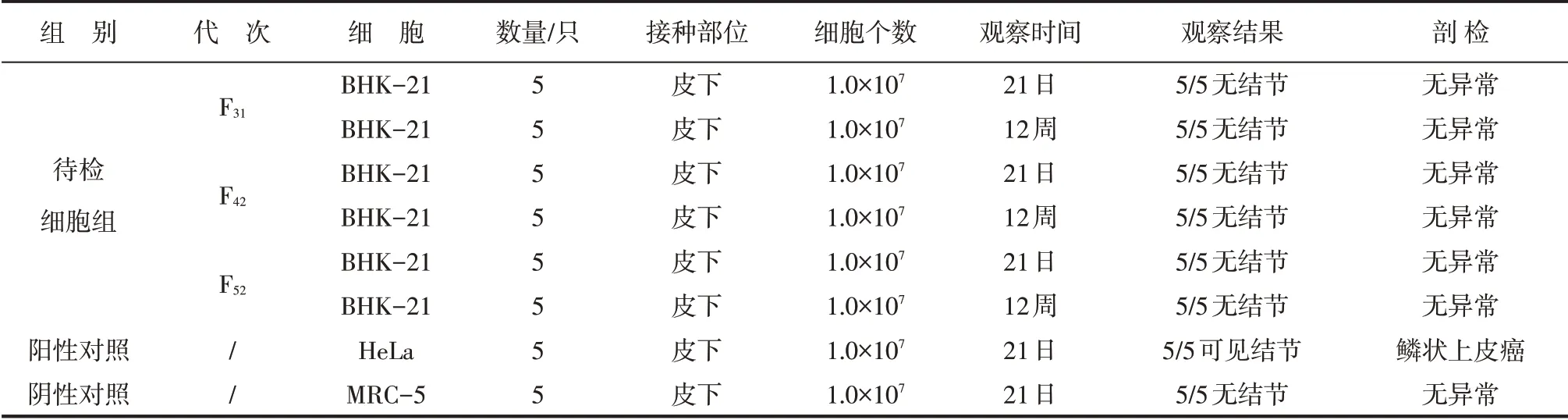
表6 细胞致瘤性检验剖检结果
2.7 病毒培养适应性检验结果
将基础细胞库中各代次BHK-21细胞接种猪塞内卡病毒HLJ株,对收获的病毒液进行病毒含量测定,结果见表7。

表7 病毒含量(TCID50)测定结果
3 结 论
BHK-21 细胞F11~F52代各指标鉴定结果符合《制造及检验试行规程》要求。为确保细胞稳定性,建议疫苗生产用细胞限定在F43代以内。
