碱土金属氧化物及氧化还原值对低铝玻璃表面渗锡的影响
2021-01-18田英良陈鑫鑫蔡礼貌李彦涛李聚锋刘亚茹王伟来
田英良,陈鑫鑫,蔡礼貌,李彦涛,李聚锋,刘亚茹,王伟来
(1.北京工业大学材料科学与工程学院,北京 100124; 2.河北视窗玻璃有限公司,河北 廊坊 065000)
自20世纪50年代末,英国皮尔金顿玻璃公司发明浮法生产工艺,使平板玻璃生产技术和产品质量得到飞跃发展[1].对于浮法工艺而言,锡槽是十分关键的成形装备,锡槽成形温度范围所对应的玻璃黏度范围为103.7~1012dPa·s.为了防止锡液氧化,锡槽内须通入N2和H2保护气体,尽管如此,依然会发生锡液氧化生成锡离子,导致锡离子渗到平板玻璃下表面,使玻璃表面产生“颠簸”或者“隆起”等质量缺陷,造成平板玻璃表面粗糙度增大,使浮法平板玻璃外观质量下降,影响产品加工质量[2].
目前,国内外通过调整锡槽结构设计,改变工艺制度参数等外在因素来减少浮法平板玻璃表面渗锡缺陷的研究已经很多[3-4].但是由于玻璃原料加工和配合料制备期间不可避免地引入铁及铁化合物,在玻璃熔制过程,铁以Fe2 +(二价铁/亚铁或还原态)和Fe3 +(三价铁或氧化态)的2种价态形式存在,Fe3+的存在将会使Sn2+氧化成Sn4+,引起渗锡[5].Williams等[6]研究发现,化学组成中含铁元素的玻璃在进行渗锡时,玻璃表面存在的Fe3+将表面容易扩散的Sn2+氧化为结合紧密不易扩散的Sn4+,从而使得Sn2+浓度降低,Fe3+浓度越高,Sn2+浓度就越低.刘世民等[7]对浮法玻璃本体中不同质量分数的铁对玻璃下表面渗锡量的影响进行了相关研究,结果表明玻璃表面的渗锡量随着铁质量分数的增加而降低.目前,大多数研究主要集中在碱金属离子(Na+、K+等),但是玻璃组成中碱土金属氧化物(CaO、MgO)和玻璃氧化还原值(oxidation-reduction,REDOX)对玻璃渗锡的影响鲜有人研究[8].低铝玻璃相较于钠钙玻璃具有易化学强化、表面硬度高、抗冲击性能好的特点,在屏幕保护玻璃行业中得到应用和发展,但是低铝玻璃在浮法生产过程中产生的渗锡缺陷相比普通钠钙玻璃增多[9-10],因此本文探究低铝玻璃化学组成中的碱土金属氧化物及配合料氧化还原值对锡离子渗入深度、浓度的影响作用规律,为改善低铝玻璃产品质量提供解决方案.
1 实验
1.1 玻璃试样制备
本文以SiO2(x=70.0%)-Al2O3(x=4.5%)-(CaO+MgO)(x=10.5%)-Na2O(x=13.5%)-K2O(x=1.5%)为基础,控制碱土金属氧化物CaO和MgO总量的摩尔分数为10.5%,将CaO与MgO进行替代,设计4种摩尔分数组成不同的玻璃,见表1所示.
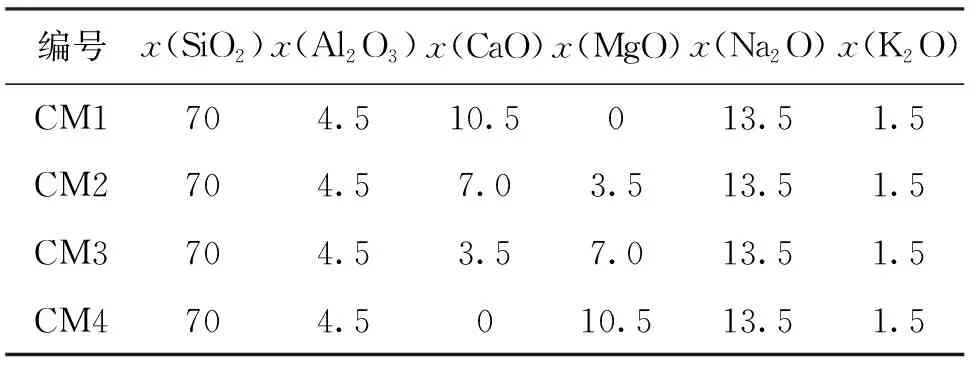
表1 实验设计的4种玻璃的化学组成及其摩尔分数
按表1 化学组成选择玻璃原料,计算玻璃配方,称量并配制400 g配合料,混合均匀,将配合料分3次加入到500 mL铂铑合金坩埚内,进行熔制浇注成型,并将成型的玻璃试块转入马弗炉退火处理,玻璃制备温度制度如图1所示.
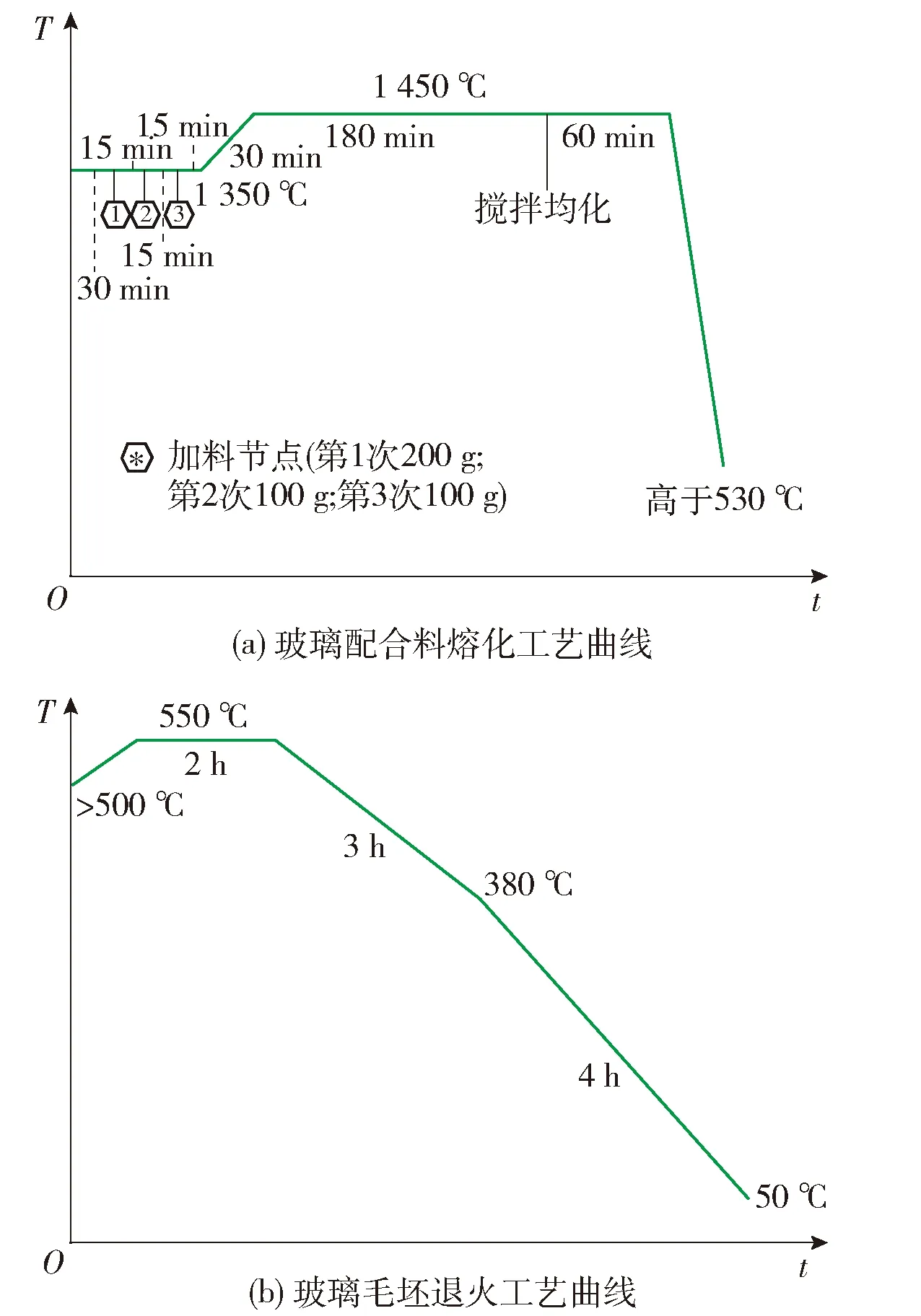
图1 玻璃熔制温度制度Fig.1 Graph of glass melting process
1.2 渗锡模拟
本实验所用渗锡模拟实验装置(型号SS- 1350,北京旭辉科技有限公司制造)包括加热系统、气氛系统、控制系统,如图2所示.低铝玻璃的供料温度T3.7约为1 100 ℃,将该温度作为渗锡模拟温度,确保玻璃试样可以快速转变成熔体,并能铺展在模拟锡液表面.石墨坩埚作为模拟容器,其尺寸规格40 mm×40 mm×40 mm.首先将高纯锡块(150±10)g装入石墨坩埚;其次将(40±2) g玻璃试样放在锡块上方.当渗锡模拟实验装置升温至1 100 ℃,向炉内通N2(φ=95%)-H2(φ=5%)保护气体,通气5 min确保炉内氧气被充分消耗,打开炉门迅速将盛装锡块及玻璃试样的石墨坩埚送入炉内,关闭炉门,持续通入保护气体,保温25 min后将石墨坩埚移出模拟实验炉,待冷却后,玻璃试样与锡块分离,获得渗锡模拟的玻璃试样.

图2 渗锡模拟装置Fig.2 Tin infiltration simulator
1.3 渗锡测量
采用JXA-8230电子探针分析仪(electro-probe microanalyzer,EPMA),对经过渗锡模拟实验的玻璃试样进行断面扫描,测量锡离子渗透深度和锡离子渗入浓度值.
2 结果与讨论
2.1 碱土金属氧化物对玻璃表面渗锡影响
锡扩散进入玻璃的初始阶段是锡单质被氧化成Sn2+,尽管锡槽内通有N2和H2保护气,依然会有微量O2渗入锡槽,当残余O2体积分数接近10-4,在锡槽温度环境(600~1 100 ℃)下易导致锡液发生氧化反应,生成Sn2+和Sn4+,由于Sn2+比Sn4+的扩散系数大,而且Sn2+更易与玻璃熔体表面的碱土金属离子(Ca2+、Mg2+)等发生离子交换,因此碱土金属离子(Ca2+、Mg2+)从玻璃熔体表层迁移进入到锡液中,则锡离子从锡液扩散进入玻璃表层中,进而形成玻璃表面渗锡层[11-12].渗入到玻璃表层中的Sn2+被Fe3+氧化成Sn4+,而锡槽保护气体H2会部分溶解在锡液中,致使玻璃表面存在的部分Sn4+和Fe3+被还原成Sn2+和Fe2+,最终导致玻璃的近表层为Sn2+,更深处为Sn4+[13-14],渗锡作用机理如图3所示.由于硅氧四面体[SiO4]是构成硅酸盐玻璃的基本结构单元,硅和氧的电负性差值决定硅氧四面体是比较稳固的,由它组成骨架的玻璃具有较高的熔化温度[11].当加入碱金属氧化物或碱土金属氧化物作为调整剂时,硅氧四面体仍保持不变,但是玻璃网络三维连接遭到破坏,导致玻璃结构局部断网.玻璃的硅氧骨架实际上是一种大分子聚合体,因此可以认为,硅酸盐玻璃是以硅氧四面体为结构单元的高聚合阴离子骨架与单体阳离子结合而成的,这种阳离子通常为碱金属离子或碱土金属离子Na+、K+、Mg2+、Ca2+等,它们与骨架之间的结合键呈现出较强的离子性,因而属于离子键,键的结合力是比较弱的[15].当玻璃在锡槽中温度高于软化点温度时,这种与玻璃骨架网络结合力较弱的阳离子处于活化状态,如果与接触相之间存在着同类离子的浓度差,便可能发生这些离子的扩散和交换[16],如图3所示.
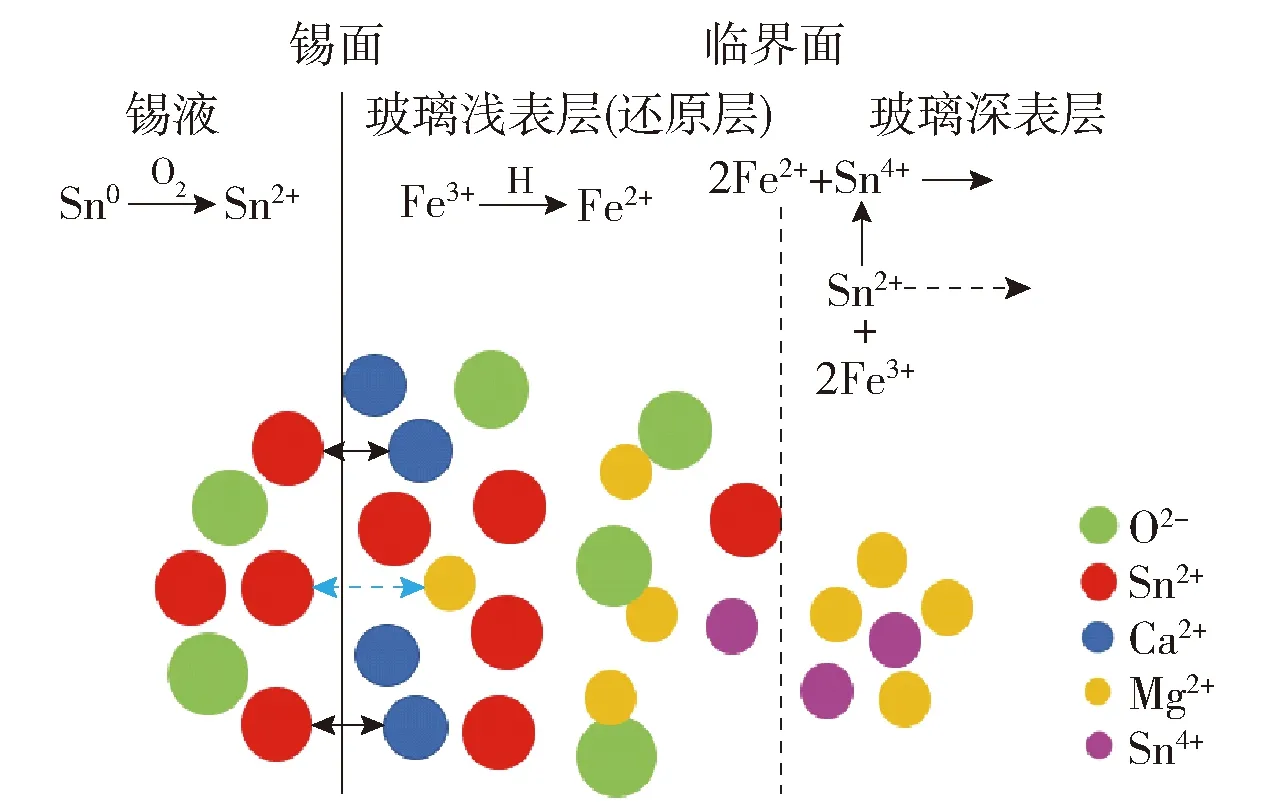
图3 浮法过程中锡进入玻璃的扩散机制示意图Fig.3 Diagram of diffusion mechanism of tin into glass during floatation
低铝玻璃的碱土金属氧化物(RO)中CaO和MgO总的摩尔分数恒定为10.5%时,对于CM1~CM4玻璃试样,随着MgO摩尔分数的增加,渗锡深度逐渐减小,CM1渗锡深度达134 μm,CM2渗锡深度达95 μm,CM3渗锡深度达72 μm,CM4渗锡深度达68 μm,如图4所示,结果表明CaO促进渗锡、MgO抑制渗锡,主要原因在于低铝玻璃熔体在1 100 ℃高温条件下,玻璃结构因受热导致结构疏松,碱土金属氧化物这些玻璃网络外体会变得离子性十分活跃,易于脱离氧离子的共价键束缚[17-18].锡属于低温易熔活跃金属,在锡槽微量氧的氧化作用下易氧化生成Sn2+和Sn4+,Sn2+进入玻璃体中与碱土金属离子Mg2+、Ca2+等发生离子交换.如图5所示,Ca2+与Mg2+相比,由于Mg2+半径较小(0.076 nm)、Ca2+半径较大(0.099 nm),且Mg2+场强大(2.90),导致Mg2+与玻璃中的O2-联接能力较强,因此Mg—O键强大[11],减缓和降低Mg2+与Sn2+发生离子交换的速率,因此Mg2+扩散能力相对较弱,最终导致Sn2+渗锡深度减小;与Mg2+相比,Ca2+场强较小(1.67),Ca2+与玻璃中的O2-联接能力相对弱一些,使Ca2+表现较为活跃,易与Sn2+发生离子交换,离子扩散能力强,渗锡深度更大,导致渗锡量相对增加[19-20].此外,低铝玻璃受澄清剂元明粉中SO3的影响赋予玻璃体一定的氧化性[21],当Sn2+进入玻璃体后很容易被氧化为Sn4+,Sn4+半径更小,仅有0.071 nm,Sn2+若要进一步进入玻璃体中,需要玻璃结构中拥有合适“孔洞”提供离子交换条件.另外,Mg2+半径与Sn4+半径相当,它可以占据大量适合Sn4+进入玻璃的“孔洞”,有效阻碍渗锡的进行.综合而言,如表1和图4所示,在低铝玻璃的CaO和MgO总量不变时,随着x(MgO)/x(CaO)逐渐增大,渗锡深度逐渐降低,当MgO完全取代CaO时,渗锡深度仅为68 μm,所以玻璃中的碱土金属(MgO和CaO)的总摩尔分数(10.5%)一定的情况下,Mg2+物质的量增加有助于降低Sn2+在玻璃中的渗透深度.
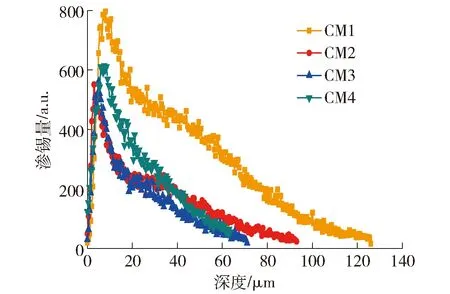
图4 CM1~CM4的渗锡曲线Fig.4 Tin penetration curve of CM1-CM4
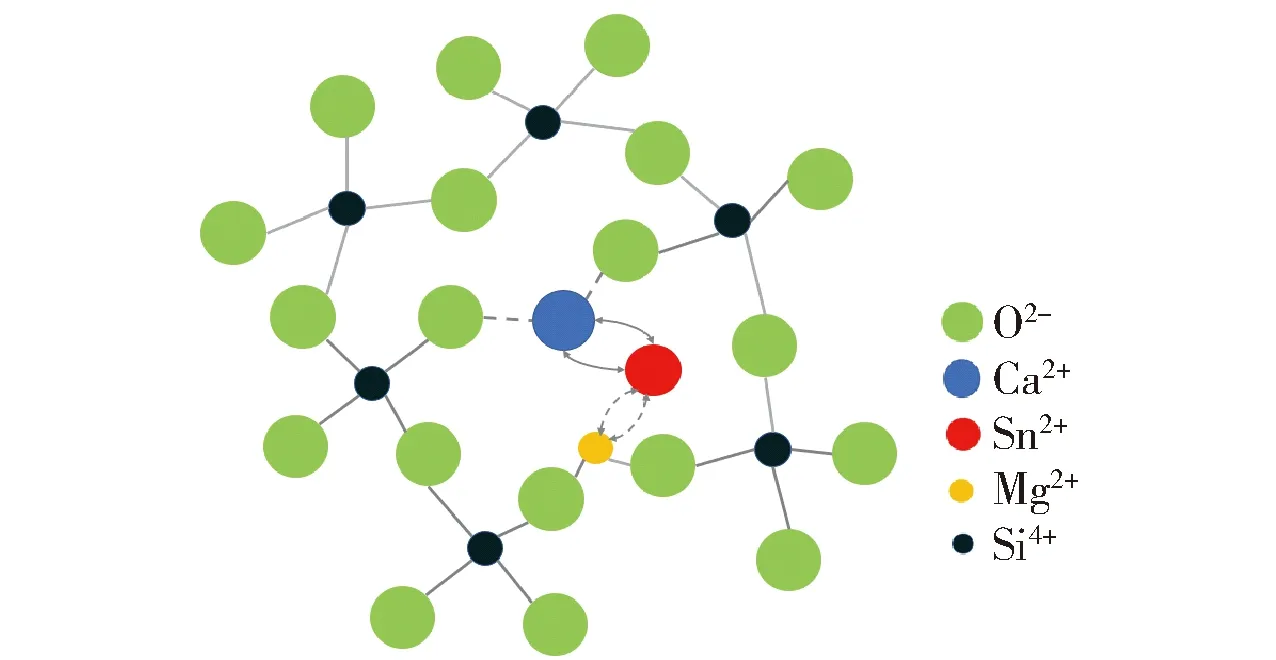
图5 浮法生产过程中碱土金属离子(R2+)与锡离子 (Sn2+)的交换模型Fig.5 Exchange model of alkaline earth metal ions (R2 +) and tin ions (Sn2+) in float process
2.2 氧化还原性对玻璃表面渗锡影响
配合料或玻璃液的氧化还原程度即REDOX用来衡量配合料或玻璃液的氧化性或还原性.正值为氧化性,数值越大氧化性越强;负值为还原性,数值越小还原性越强[22-23].玻璃液的氧化还原程度由配合料氧化还原值和熔化条件决定,配合料REDOX是重要影响因素,对于玻璃生产至关重要,因此必须保持配合料的氧化还原指数的稳定性和可控性[24].
本文以CM3玻璃化学组成为基础,在此配合料中分别添加还原剂(炭粉)和氧化剂(元明粉),通过添加量来调控REDOX,CM3-0、CM3-1、CM3-2的REDOX分别为9.53、4.29、-2.99,氧化性依次减弱,还原性依次增强,见表2所示.
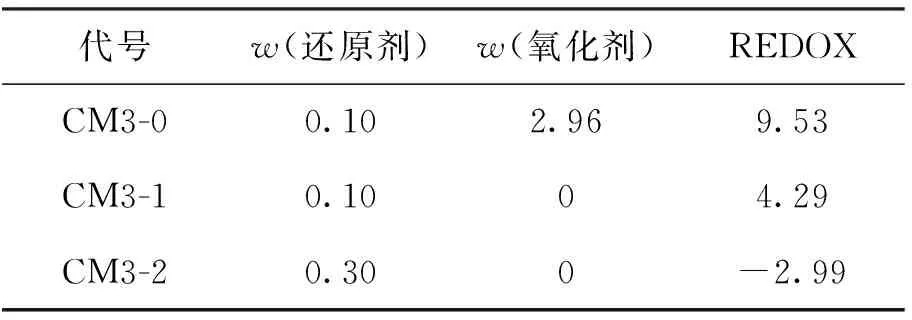
表2 调节配合料的氧化还原值
如图6所示,在距离玻璃表面6~8 μm处,随着CM3-0~CM3-2玻璃试样的氧化性减弱,玻璃表面渗锡的最大峰值强度逐渐减少,CM3-1玻璃试样的渗锡峰值强度比CM3-0降低7.2%,而CM3-2玻璃试样的渗锡峰值强度比CM3-0减低62.5%,可见配合料的REDOX越低,最大渗锡峰值强度降低越明显,尤其REDOX为负值时,玻璃呈现出还原性,渗锡峰值强度出现大幅衰减,说明玻璃本体内部缺乏氧化条件,不能使锡单质被充分氧化生成锡离子(Snn+,n=2,4),将会减少Snn+与碱性金属离子(R+、R2+)发生离子交换,渗锡量越小即渗锡峰值浓度越小[14].另外,图6的3个玻璃试样的渗锡深度实际相差不大,当REDOX减小即还原性增强时,渗锡深度虽然呈现降低趋势,从80 μm降低到75 μm,总体降低幅度不显著,仅有5 μm渗锡深度差别,相比图4的渗锡深度差异明显减少,这主要在于玻璃组成没有发生变化,对于所发生的离子交换的浓度条件没有改变,所以不影响离子交换速率,导致Sn2+离子扩散深度相差不大,说明配合料REDOX变化仅对玻璃表层的离子交换强度有影响,基本不影响离子交换深度.
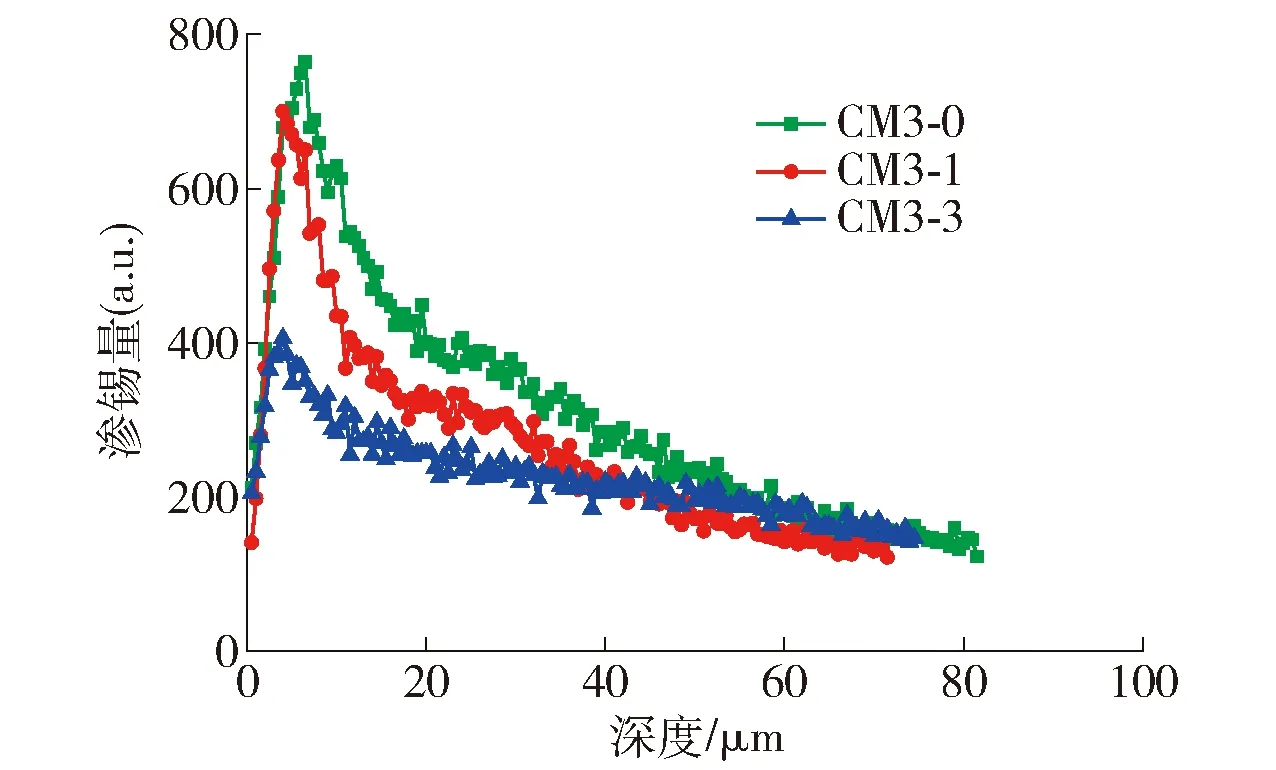
图6 氧化还原值对渗锡深度和浓度影响Fig.6 Effect of redox value on tin penetration depth and concentration
3 结论
本文以低铝玻璃为研究对象,控制CaO和MgO碱土金属氧化物总量的摩尔分数为10.5%,进行CaO与MgO相互替代;改变玻璃配合料REDOX,模拟浮法玻璃表面渗锡.
1) 玻璃组成中的MgO对渗锡深度有较强有抑制作用.当MgO摩尔分数增加,Sn2+渗透深度明显减小,主要受氧化物键强影响,Mg—O键强大,Mg2+不易与玻璃网络结构分离,进而减缓和降低与Sn2+的离子交换.
2) 玻璃配合料REDOX增加会导致玻璃表面层渗锡峰值浓度增大,但对渗锡深度影响不大.原因在于玻璃熔体氧化性使锡单质被氧化成Sn2+、Sn4+导致了玻璃表面层的R+和R2+与Sn4+发生强烈的离子交换,降低配合料REDOX有利于降低玻璃表面层渗锡浓度.
