黄土高原退耕还草地植物群落动态对生态系统碳储量的影响
2021-01-16董凌勃海旭莹汪晓珍李斌斌刘玉林李继伟李妙宇吕文文上官周平
董凌勃, 海旭莹, 汪晓珍, 邓 蕾,,*, 李斌斌, 刘玉林, 李继伟, 李妙宇, 吕文文, 上官周平,
1 西北农林科技大学水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室, 杨凌 712100
2 中国科学院水利部水土保持研究所, 杨凌 712100
3 水利部水土保持监测中心, 北京 100053
全球气候变暖是目前人类面临的重要问题,人类活动造成温室气体排放的增加是全球气候变暖的主要原因[1]。大气中的温室气体主要包括CO2、CH4和N2O等,其中CO2约占60%[2]。由于历史上的人为活动,全世界土壤已向大气输送了0.133 Pg碳[3]。为了应对减排压力,目前国际上都在寻找各自的减排途径,其中,通过植被恢复对碳的吸收来减少CO2排放是最有效的途径之一,而且植被恢复还能提高土壤质量,防止土地退化[4]。
草地是陆地生态系统重要组成部分,约占陆地总面积的20%,其碳储量达200—300 Pg[5]。研究发现,草地通过自然恢复能显著增加植被盖度,地上生物量和碳储量[6]。Jing等[7]认为植被恢复20 a后物种密度、多样性、丰富度和地上生物量均呈现降低趋势。李永强等[8]表明土壤有机碳呈现出先降低后增加的变化规律,虽然恢复33 a增加了土壤碳储量,但尚未恢复到初始农田的碳储量水平。然而,赵威[9]等发现土壤碳储量在第3年开始上升,并在第8年恢复到农田水平。由于初始土壤退化程度和恢复时间长短等因素存在差异,土壤碳储量恢复到最佳水平的时间不同。另外,目前的工作较多的关注在土壤碳储量的时间动态变化上,尚缺少对整个生态系统碳储量的系统研究。植被恢复后植物群落组成等对生态系统碳储量的影响仍有较多不确定性,也需要进一步探讨。
黄土高原是世界上侵蚀最严重、黄土沉积最深厚的地区之一[10],为了减少土壤水分、碳流失和土壤侵蚀,我国政府在20世纪80年代启动了一系列生态恢复工程[11- 12]。比如,自1999年起,实施的“退耕还林(草)”工程,将农田转化为林地或草地,是覆盖范围最广的生态恢复工程之一[4]。大规模造林植草改变森林和草地面积,使植被覆盖显著增加,必然改变陆地生态系统的固碳能力[13- 16]。退耕还草地是黄土高原地区土地利用变化较大的植被恢复类型之一,深入研究农田弃耕后草地的碳汇能力对科学研究和地方决策者都很重要。
本研究通过探讨退耕还草地恢复过程中草地生态系统碳储量以及植被群落组成的变化,以及研究草地恢复后植被群落组成对生态系统碳储量的影响,以期为黄土高原地区生态恢复及其固碳管理提供理论依据和数据参考。
1 研究地区与研究方法
1.1 研究区概况
研究区位于陕西省延安市安塞区纸坊沟流域(36 ° 44 ′ — 36 ° 51 ′ N, 109 °15 ′ —109 °18 ′ E),海拔为1144—1307 m。该地区气候属中温带大陆性半干旱季风气候区,四季长短不等,干湿分明。常年平均气温9.1 ℃,最高温36.8 ℃,最低温-23.6 ℃,年平均降水量503 mm,最多为645 mm,最少为296.6 mm,夏季约占全年降水量70%,年蒸发量大于1400 mm,年日照时数为2300—2400 h,全年无霜期160 d。土壤主要为黄土母质发育形成的黄绵土,是黄土高原地区分布最广的土壤类型。研究区草地的天然植被主要以长芒草(Stipabungeana)、白羊草(Bothriochloaischaemum)、赖草(Leymussecalinus)、铁杆蒿(Artemisiagmelinii)、茭蒿(Artemisiagiraldii)、达乌里胡枝子(Lespedezadaurica)、异叶败酱(Patriniaheterophylla)等为主,退化农田以玉米(Zeamays)地为主。
1.2 实验设计与样品采集
本文采用空间代替时间法,于2015年8月选取农田(玉米地)、农田弃耕后自然恢复8、15、25、35 a草地为研究对象(表1)。每个恢复年限选取3块草地,每块草地设置为20 m × 20 m样地,沿对角线方向分别设置3个1 m×1 m的样方。由于在恢复草地样地中发现有灌木幼苗,植株较小尚未形成群落,因此在调查时与草本植物同时调查。在每个样方内,调查每个样方内的植株高度、多度、盖度和物种组成。采用剪刀齐地减去地上部分作为地上生物量,去除地上的鲜活植物后收集地表的枯落物,将土壤表面的覆盖物清理干净,采用直径为9 cm的根钻采集0—10、10—20、20—30 cm土层内的根系生物量,每个样方沿对角线方向取3钻,混合后用干筛法获取根系。使用直径为5 cm的土钻,沿每个样方的对角线方向自下而上进行取样,按0—10、10—20、20—30 cm 3个土层,共取5钻土。同一土层的5钻土混合均匀后合并成一个土样,然后过2 mm筛,以除去植物残体、砾石等杂物,在室温下风干后用于测定土壤理化指标。在每个样方旁用100 cm3环刀在0—10、10—20、20—30 cm 3个土层,采集未搅动的自然状态土样,用于测量土壤容重,每个样地3个重复。
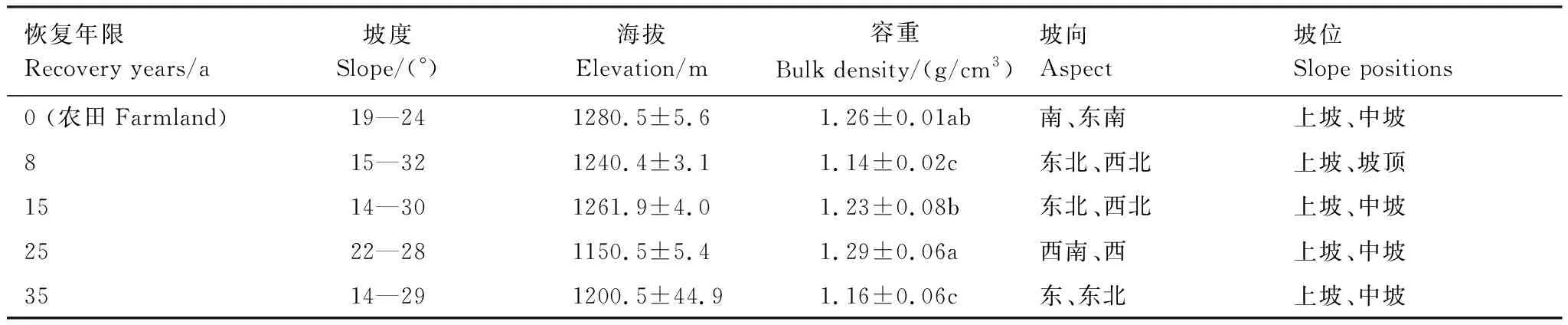
表1 不同恢复年限样地地理特征Table 1 Geographical characteristics of different recovery years
1.3 测定方法
将地上植被、凋落物和根系用去离子水冲洗,105 ℃杀青30 min后在65 ℃下烘干至恒重,取其干重用以计算地上植被、凋落物和根系的碳储量。土壤有机碳、植被碳和凋落物碳采用K2Cr2O7-H2SO4氧化法测定[17],土壤容重采用称量法进行测定。
1.4 数据处理
(1)土壤有机碳的计算公式[18]
式中:CS为土壤有机碳储量(Mg/hm2);SOC为土壤有机碳含量(g/kg);BD为土壤容重(g/cm3);D为土层厚度(cm)。
(2)植被碳储量计算公式[18]
CP=B×Cf
CP是植被碳储量(Mg/hm2);B是植被生物量(Mg/hm2);Cf是植物生物量碳含量(%)。
(3)多样性指数计算[19]
R=S
J=SW/lnS
R是Patrick物种丰富度指数,SW是Shannon-Wiener多样性指数,D是Simpson辛普森指数,J是Pielow均匀度指数,S是该样地的总物种数,i是物种i,Pi是物种i的相对重要值。
重要值、相对频度、相对盖度、相对高度、相对密度计算方法[19]。
重要值=(相对频度+相对盖度+相对高度+相对密度)/400
相对频度=(某个种的频度/所有种的频度)×100
相对盖度=(某个种的盖度/所有种盖度之和)×100
相对高度=(某个种的平均高度/所有种的平均高度之和)×100
相对密度=(某种植物个体数目/全部植物个体数目)×100
1.5 数据分析
采用单因素方差分析(One-way ANOVA)比较不同恢复年限生物多样性、生物量和碳储量的差异;采用Pearson相关分析对植物生活型、功能群、生物多样性和碳储量之间的关系进行分析。使用Origin2018 软件作图,图表中数据为平均值±标准差。采用SPSS 25.0软件对数据进行统计分析。
2 结果
2.1 植被恢复中植物群落特征的变化
随着植被恢复,群落高度波动较大(表2),第25年与第8、35年之间有显著差异(P<0.05),在恢复后的第8年群落高度最高(64.14 cm)。群落盖度随着恢复年限的增加总体呈上升的趋势,第8年与第15、35年之间差异显著(P<0.05),群落盖度在第35年达到最高(64.0%),分别是第8、15、25年的2.1、1.2、1.5倍(表2)。随着植被恢复,该地区的优势种由达乌里胡枝子(L.davurica)、赖草(L.secalinus)、茵陈蒿(Artemisiacapillaris)等逐渐演替为长芒草、铁杆蒿(A.gmelinii)等草种。Shannon-Weiner指数与Patrick指数均呈先上升后下降的趋势(表2),其范围分别为1.61—1.92、6.00—8.22,均在第15年达到最大值,分别为1.92、8.22。Shannon-Weiner指数在第15年显著高于其他恢复年限(P<0.05),Patrick指数在第15年和第35年差异显著(P<0.05),Simpson指数与Pielow指数随着植被恢复年限的增加无显著变化(P>0.05)(表2)。在自然恢复后的第15年植被多样性最高,物种丰富,结构稳定,最有利于退化土地的恢复(表2)。
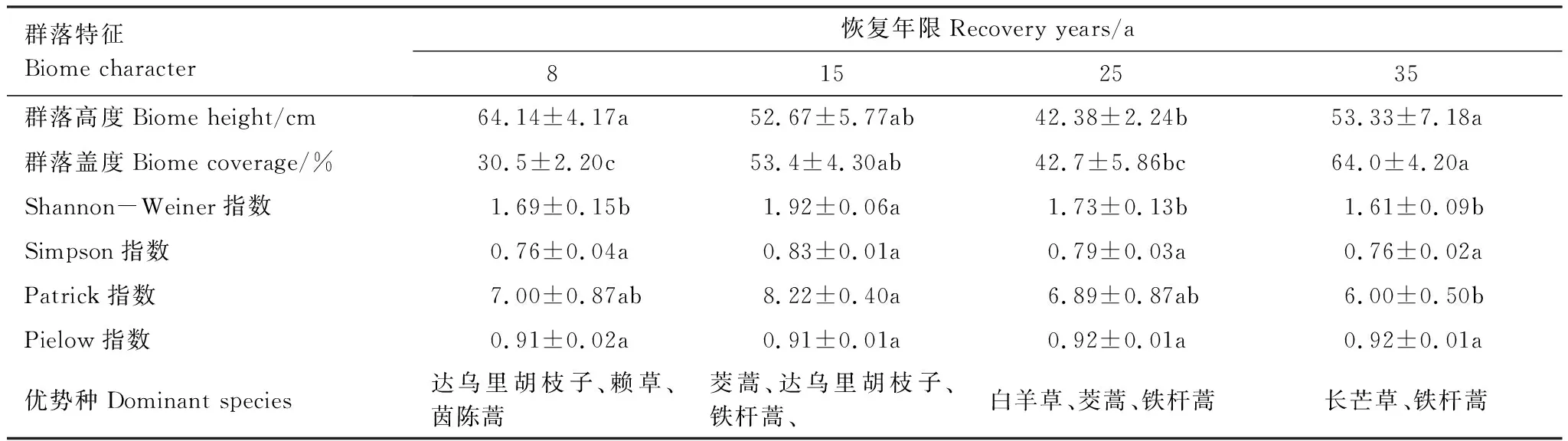
表2 不同恢复年限植物群落特征Table 2 Plant community characteristics for different recovery years
随着植被恢复,一年生植物重要值总体呈下降的趋势(图1),并在第35年达到最小值(3.4%),仅为第8年的16.9%。多年生植物却与之相反,总体呈上升趋势,在第35年最大(80.3%),第35年的多年生植物重要值分别为第8、15、25年的1.1、1.0、1.2倍;灌木也随着恢复年限的增加总体呈增加趋势。随着植被恢复,杂草类草本总体呈现下降的趋势(图1),其重要值从59.2%下降到25.3%,下降了57.2%。禾草类草本重要值总体呈上升趋势,第8年仅为37.1%,但第35年达到59.1%,增加了59.2%。豆科类呈现先上升后下降的趋势,在第15年最高,重要值达到26.8%,约为第8年的7.3倍,之后豆科类植物呈减少的趋势,在第35年重要值仅为15.6%。
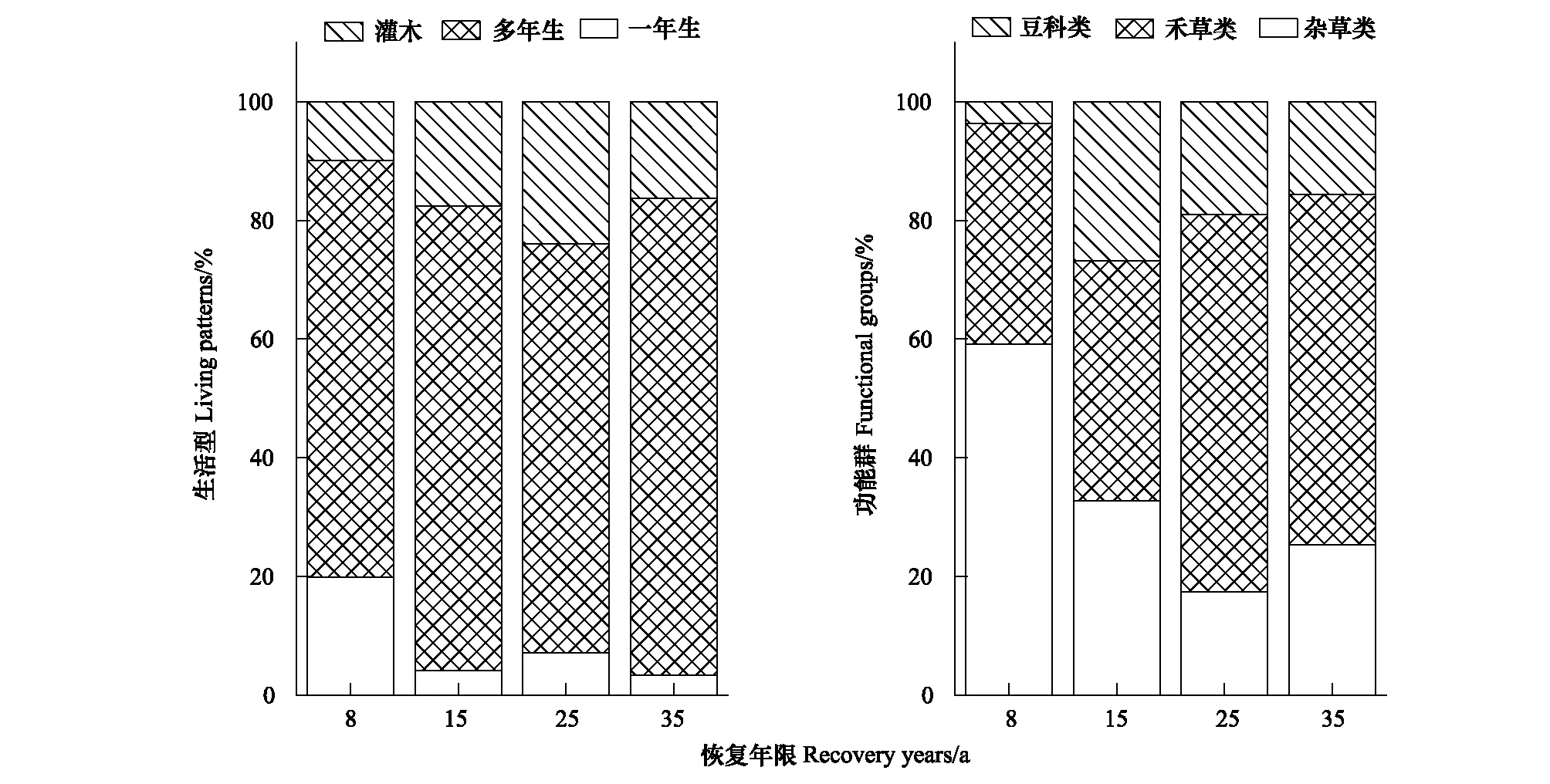
图1 不同恢复年限植物生活型与功能群的变化Fig.1 Changes in living patterns and functional groups in different recovery years since grassland restoration一年生 Annual herbs; 多年生 Perennials herbs; 灌木 Shrubs; 杂草 Forbs; 禾草 Grasses; 豆科 Leguminous
2.2 植被恢复中植被碳储量的变化
地上生物量随着恢复年限的增加呈上升的趋势(表3),并在第35年达到最大值,为196.8 g/m2,约为第0、8、15、25年的6.5、2.1、1.3、1.3倍,第0 (农田)、8、15年之间差异显著(P<0.05),但第15、25、35年之间无显著差异(P>0.05)。地下生物量总体呈上升趋势,在第35年达到最大值484.1 g/m2,约为第0、8、15、25年的69.2、1.2、2.4、1.6倍,第0、15、35年之间存在显著差异(P<0.05)。凋落物生物量总体呈上升趋势,第8年与第15、25、35年之间存在显著差异(P<0.05),植被恢复15 a后,凋落物生物量变化不显著(P>0.05)。
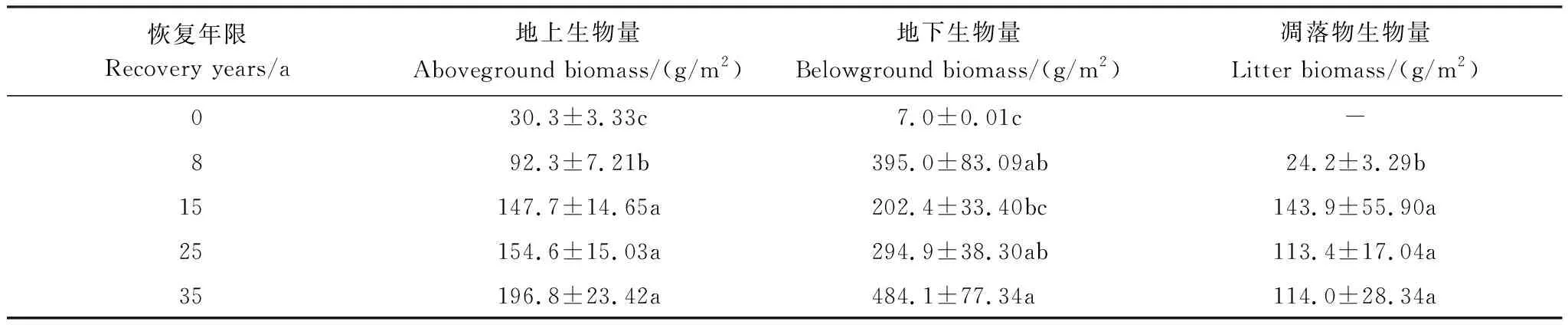
表3 不同恢复年限生物量的变化Table 3 Changes in plant biomasses in different recovery years
随着植被恢复,地上与地下植被碳储量均呈上升的趋势(图2),且均在第35年达最大值,分别从第0年的0.11 Mg C/hm2、0.02 Mg C/hm2增加到0.83 Mg C/hm2、1.49 Mg C/hm2,地上和地下植被碳储量分别是农田阶段的7.5和74.5倍。地上植被碳储量第8年与第15年之间差异显著(P<0.05),但第15、25、35年之间差异不显著(P>0.05)。地下生物量碳在第0、8、35年间差异显著,在整个恢复过程中地下生物量碳显著增加,但在8、15、25 a间无显著差异。凋落物碳储量总体呈上升的趋势(图2),在第8、15年之间存在显著差异(P<0.05),第15年后无显著差异(P>0.05)。第15、25、35年凋落物碳储量为0.37 Mg C/hm2、0.40 Mg C/hm2、0.35 Mg C/hm2,分别为第8年的4.9、5.3、4.7倍。
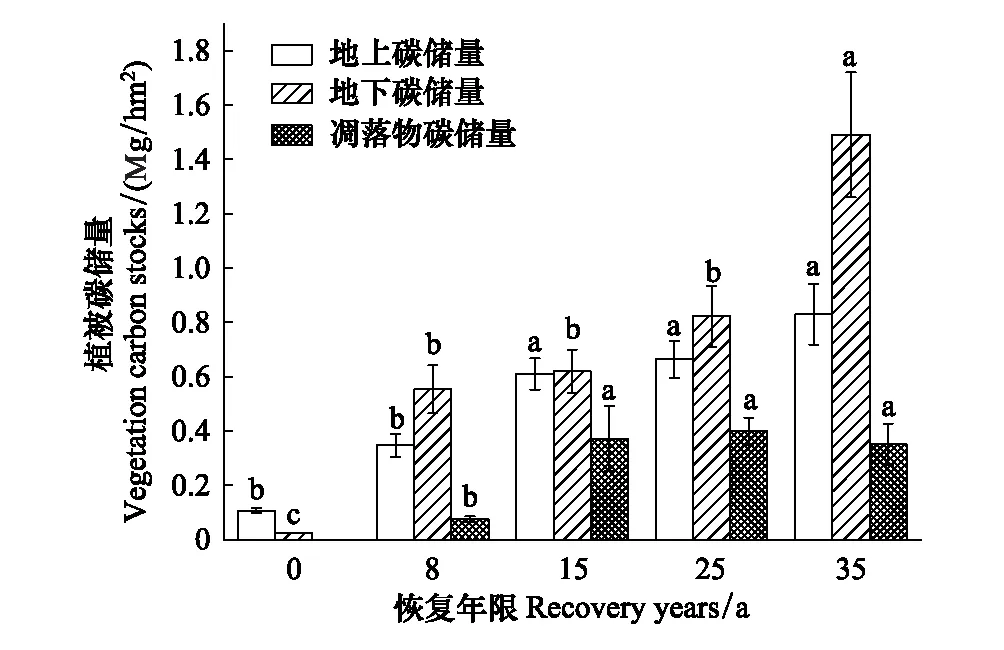
图2 不同恢复年限植被碳储量Fig.2 Vegetation carbon stocks in different recovery years地上碳储量 Aboveground biomass carbon stocks; 地下碳储量Belowground biomass carbon stocks; 凋落物碳储量Litter biomass carbon stocks; 不同小写字母表示不同恢复年限之间存在显著差异(P<0.05)
2.3 植被恢复中土壤碳储量的变化
恢复年限显著影响土壤碳含量与碳储量(图3),土壤的碳含量和碳储量均呈现出先降低后上升的趋势,且在第35年达到最大值,0—30 cm碳含量和碳储量分别为11.89 g/kg、41.03 Mg C/hm2,相对于农田分别增加了27.3%和16.8%。第35年 0—30 cm的土壤碳储量分别是第0、8、15、25年的1.2、1.7、1.2、1.6倍,第8年是碳储量最低的年限(23.34 Mg C/hm2)。除了第15年 0—10 cm的碳储量高于农田,第8、15、25与第35年的各土层土壤碳储量存在显著差异(P<0.05),植被恢复后第8、15、25年 0—30 cm的碳储量均未达到农田水平(图3)。土壤的碳含量和碳储量均随着土层的加深而减少,且0—10 cm土壤碳储量约占0—30 cm碳储量的38.9%—50.3%,呈表聚现象。

图3 不同恢复年限各土层碳含量和碳储量的变化Fig.3 Changes in soil carbon contents and stocks in different recovery years不同小写字母表示不同恢复年限之间存在显著差异(P<0.05)
2.4 植物恢复中生态系统碳储量的变化
随着植被恢复,生态系统碳储量总体呈先下降后上升的趋势(图4)。在第8年最低为24.32 Mg C/hm2,在第35年到达最大值43.70 Mg C/hm2,第35年碳储量约为第0、8、15、25年的1.2、1.8、1.2、1.6倍,第35年的生态系统碳储量显著高于其他年限且超过农田的水平。虽然第15年的碳储量已经基本达到农田的水平,且与农田生态系统碳储量无显著差异,但第25年的碳储量显著低于农田的生态系统碳储量(P<0.05)。
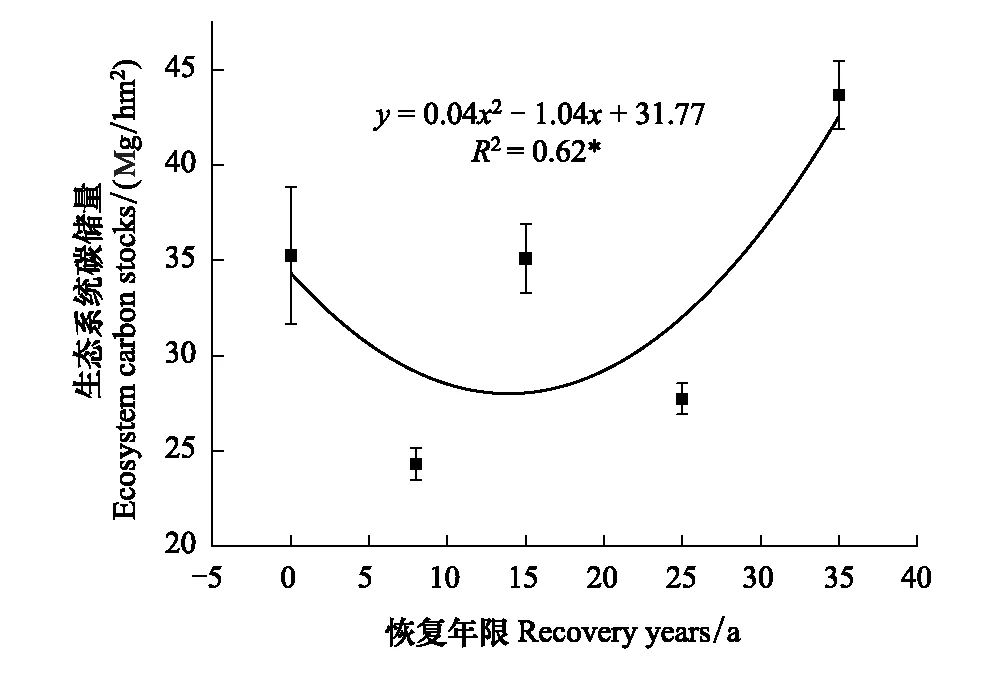
图4 不同恢复年限生态系统碳储量的变化Fig.4 Changes in carbon stocks in ecosystems during different recovery years
2.5 植物恢复中植物群落组成对生态系统碳储量的影响
群落盖度、地上生物量、地下生物量与禾草、多年生草本和灌木重要值与植被碳储量呈显著正相关(P<0.05),杂草和一年生草本重要值与植被碳储量呈显著负相关(P<0.05)。群落盖度和多年生草本重要值与整个土层的土壤碳储量呈显著正相关(P<0.05),而一年生草本重要值与土壤碳储量呈显著负相关(P<0.05)。凋落物生物量仅与0—20 cm土层的土壤碳储量呈显著正相关(P<0.05),而杂草和禾草的重要值与10—30cm土层土壤碳储量分别呈显著负相关和显著正相关(P<0.05)。群落盖度、地上生物量、凋落物生物量、禾草、豆科以及多年生植物与生态系统碳储量呈显著正相关(P<0.05),杂草和一年生植物与生态系统碳储量呈显著负相关(P<0.05),且群落盖度、凋落物生物量和杂草、一年生、多年生植物的重要值均达到极显著水平(P<0.01)。
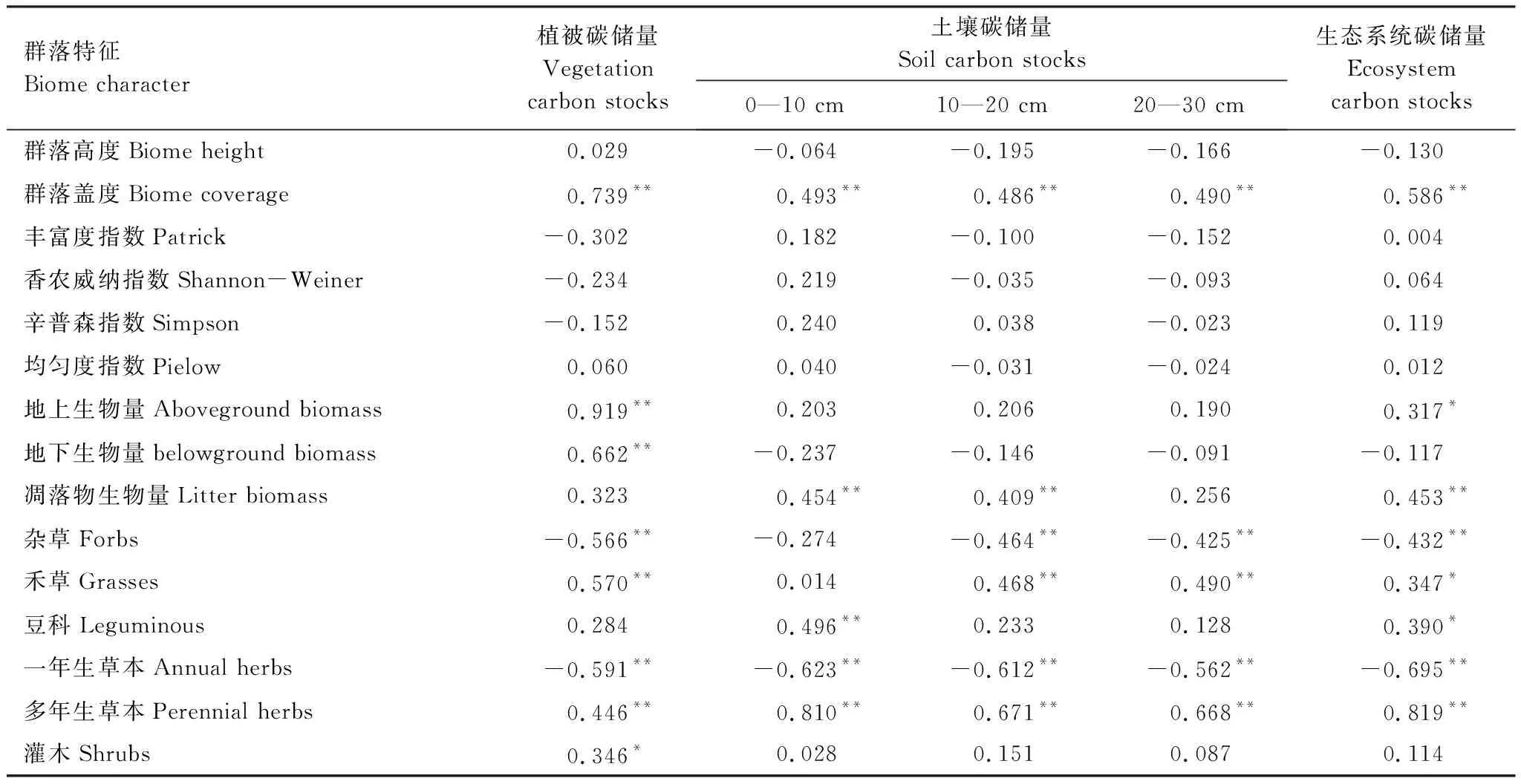
表4 植物群落结构组成和多样性与生态系统碳储量之间的相关关系Table 4 The relationships of plant community characteristics, diversity with ecosystem carbon stocks
2.6 植物和土壤碳储量与群落因子的关系
植被恢复后,草地植被碳储量的主要受地上生物量、地下生物量、凋落物、以及杂草与灌木重要值和辛普森指数的影响,土壤碳储量的主要受多年生植物、禾草、杂草的重要值和地下生物量的影响,而生态系统碳储量的主要受多年生植物、杂草与禾草的重要值、地下生物量和凋落物生物量的影响(表5)。
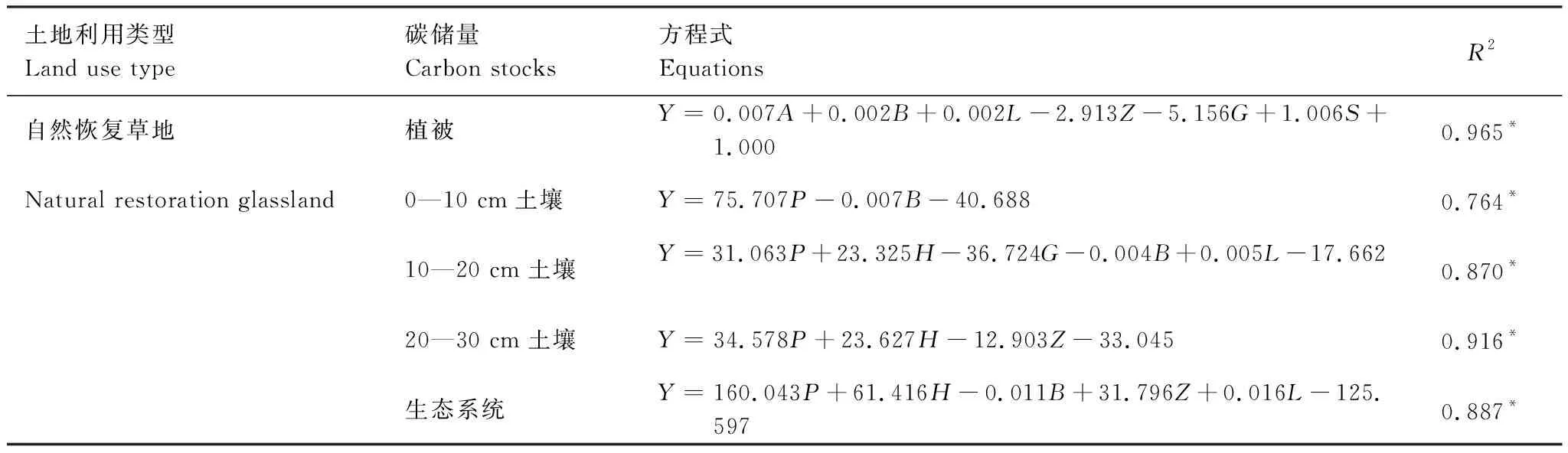
表5 植物和土壤碳储量与植物多样性的多元线性回归分析Table 5 Multi-linear regression analysis of plant and soil carbon stocks and plant diversity
3 讨论
3.1 植被恢复对植物多样性的影响
植被恢复是恢复生态系统功能最有效的途径,植被恢复通过增加地表植被,改善土壤和环境因子,使土壤养分增加并减少水分的损失,为植被生长提供了良好的生长条件[6, 20]。本研究发现随着恢复年限的延长,植被盖度和地上生物量呈增加的趋势。因此,随着植被生长越来越旺盛,植被生物量和地表覆盖度不断增加。
长期的植被恢复存在明显的物种演替现象,群落演替是物种适应外界环境变化与其他物种发生竞争后物种更替的必然结果[21]。本研究表明不同恢复年限之间的草地物种组成有显著差异,演替过程为达乌里胡枝子(L.davurica)+赖草(L.secalinus)+茵陈蒿(Artemisiacapillaris)→艾蒿Artemisiaargyi+达乌里胡枝子(L.davurica)+铁杆蒿(A.gmelinii)→白羊草(B.ischaemum)+茭蒿(A.giraldii)+铁杆蒿→长芒草(S.bungeana)+铁杆蒿(表2),这是由各种生态位此消彼涨的结果。可以看出铁杆蒿从无到有,逐渐成为优势种,这表明随着植被的恢复年限的增加,植被群落是在不断变化的。不同的草种对长期植被恢复的响应存在显著差异,这与植物群落自身的特点、恢复时间的长短和环境条件有关。例如,He等[22]认为长期的植被恢复导致地表凋落物增加,从而抑制芽库和根茎的更新,且以根茎型为主的草种受到的影响远大于其他物种。Jing等[7]发现通过长时间的植被恢复,本氏针茅(Stipacapillata)经过生态演替成与当地气候相对稳定的大针茅(Stipagrandis)。很多研究认为植被恢复会显著提高物种多样性[6, 23],但短期的植被恢复对多样性的影响不显著[24]。植被恢复后多样性趋势的变化存在差异,可能是由于立地条件和气候因子不同造成的[25]。本研究的Shannon-Weiner指数、Patrick指数均呈先上升后下降的趋势(表2),这与已有研究结果一致[22, 26]。造成这种原因是,在植被恢复初期,植被对光照和养分资源需求相对较小,各种能在该地生存的植物毫无限制的生长,但在恢复一段时间后,随着植被盖度的增加,一些高大的植物会限制低矮植物的光照资源,使喜光植物消失。除此之外,随着植被数量的增加,土壤有限的养分不足以供给太多的植被生存,此时,不同物种产生种间竞争,优胜劣汰,竞争能力强的植物存活,成为该地区的优势种,而竞争能力弱的植物逐渐消亡,因此生物多样性会在增加到一定程度之后又会下降。
优势种群发展的动态对群落的外貌、结构和演替方向有重要影响。长时间的植被恢复会改变草地群落优势种,并促使群落发生演替。本研究表明,随着恢复年限的延长,禾草逐渐代替杂草类植物占主导优势(图1),井光花[25]研究也表现出类似结果,即禾草类的植株高大,且根系发达,在竞争资源时会占据优势;Liu等[27]的研究也表明,杂草类根系较浅,大致分布在0—30 cm土层内,而禾草的根系却可深至85 cm,这也充分表明禾草的根系相对于杂草在竞争资源时会有更大的优势。豆科植物在第15年后就在不断减少是因为在恢复初期,光照资源很充足,生长的植被也相对较少,充足的养分和光照资源使豆科植物在初期的比例较高。在植被恢复中期,土壤条件的提高使高大且根系发达的植株不断增多,由于豆科植物的低矮,高大的植株会限制其光照,发达的根系在竞争土壤养分时也限制着豆科植物的吸收,这都会抑制豆科植物的生长,使豆科植物在第15年后不断减少[25]。一年生和二年生植物随着恢复年限的增加不断减少,而多年生植物和灌木不断增加 (图1)。一年生和二年生植物竞争力弱,且对环境响应比较敏感,随着植被的恢复,植被的生存条件不断提高,环境也在不断的发生变化,这使得本就脆弱的一年生和二年生植物逐渐被淘汰。多年生植物的根系相对比较发达,其竞争资源的能力强于一年生和二年生植物,足够的生长条件和竞争资源的优势使多年生植物的比例不断增加[25]。灌木也随着恢复年限的延长在不断增加,灌木不仅会限制其他植物对养分和水分的吸收,也会限制低矮植物的光照,这会使竞争力弱且喜光的物种消亡。灌木的增加表明生态环境是在不断提高的,且生态稳定性也在不断提高。
3.2 植被恢复对植物和土壤碳储量的影响。
本研究发现,随着植被恢复,地上生物量、地下生物量和凋落物以及其碳储量总体呈上升的趋势(表3)。植被恢复可以提高土壤有机碳的含量,进而为植被生长提供良好的条件,提高地上生物量[28-30]。植被的增加会减少土壤养分的流失和地表水分的蒸发,同时,地下根系生物量和凋落物的增加也在不断改善土壤环境,并在土壤微生物的作用下,凋落物分解增加了土壤的有机碳含量。土壤养分不断增加与植被生长越来越旺盛最终形成植被-土壤相互促进的良性循环系统[31]。这种良性循环使得原本贫瘠的土壤逐渐肥沃,且使生态环境逐渐稳定。随着植被恢复,肥沃的土壤使多年生草本与灌木不断增加,多年生草本与灌木拥有高大的植株和发达的根系,这会导致生物量快速增加,进而导致植被碳储量不断增加。
土壤碳储量随着植被恢复也呈先减少后增加的趋势(图3)。在恢复初期,植被覆盖度较低,低的植被覆盖度会导致严重的土壤侵蚀,土壤有机碳随降雨淋滤或迁移到其它地区,使植被恢复前期的SOC损失[32]。随着植被恢复的时间增加,由于凋落物和根系分泌物输入的增加,土壤碳储量也在缓缓增加[33]。恢复第15年 0—10 cm的土壤碳含量显著高于第8、25年,可能是因为在第15年豆科植物较多(图1),第8、25年的豆科植物较少引起的。豆科植物大都低矮,且根系较浅,通过固氮作用增加土壤中的N含量,低的C/N有利于微生物生长,从而加快凋落物的分解速率,大量的根系输入以及低的C/N促进了表层土壤碳储量的增加[34]。在第8年后,由于植被的恢复作用,第15、25、35年 10—20和20—30 cm土层的碳储量呈缓慢增加的趋势,并在第35年超过农田水平(图3)。Deng等[13]研究表明黄土丘陵区植被恢复后土壤碳库净累积需要超过30 a的时间,而Potter等[35]发现农田转化为草地后,要使土壤碳储量达到农田土壤碳储量的水平大约需要100 a。本研究进一步证实了在黄土高原丘陵区短时间植被恢复的土壤固碳效应并不明显,土壤碳储量的恢复是一个长期过程[13],在自然恢复后约35 a才达到碳汇的能力。
土壤的碳储量由碳输入量和分解量共同决定[36],本研究发现,弃耕地恢复过程中0—10 cm土壤碳储量明显高于10—20和20—30 cm土壤碳储量,即碳储量会随着土层深度的增加逐渐降低,这与Bai等[37]研究一致。0—10 cm土壤碳储量约占0—30 cm碳储量的38.9%—50.3%,呈现出表聚现象[17,32]。这是由于草本植物的根系大部分在表层土壤,表层土壤中更高的细根周转率导致了土壤有机碳的持续累积。根系较浅的植物往往寿命较短,会不断长出新的根系。因此,表土层中,植被演替通过高的细根周转率导致有机质输入持续增加,增加了有机碳。然而,在底土层中,根系的输入较少,且更新速度很慢,这导致底土层有机碳增加速度低于表土层。除此之外,土壤底层的大团聚体容纳有机碳的空间相对于表层土壤更小,因此表层土壤的碳储量高于底土层[38]。
3.3 植被恢复对生态系统碳储量的影响
生态系统碳储量是由植被碳储量和土壤碳储量组成,而土壤碳储量是生态系统碳储量主要部分。本研究中土壤碳储量约占生态系统碳储量的93.3%—99.6%,钟等[39]认为在草地生态系统中,有机碳主要分布在土壤中,约占生态系统中有机碳总量的90%,是草地生态系统中最重要的碳库,因此生态系统碳储量与土壤碳储量一样,呈现出先下降后上升的趋势(图4)。恢复初期由于地表裸露,大量有机碳被带走却无新的有机碳输入自然导致该地区碳储量的减少[40]。随着植被恢复,植被盖度上升,不仅减少了地表裸露面积,也减少了径流对地表的冲刷,与此同时,植物向土壤中输送的根系和凋落物在不断增加,通过微生物分解增加了土壤的碳储量[13]。本研究发现第15年生态系统碳储量基本接近农田碳储量,主要由于第15年有较多固氮植物使得0—10 cm土壤碳储量较高,进而提高了该阶段的生态系统碳储量(图1)。土壤环境的改善促使植被生长更加旺盛,如此一来植被碳储量和土壤碳储量的不断增加导致了生态系统碳储量的增加,并在长期恢复后超过农田的水平。
群落盖度、地上生物量、凋落物生物量、禾草、豆科以及多年生植物与生态系统碳储量呈显著正相关(P<0.05)(表4)。群落盖度增加意味着地表的植物增多与裸露面积减少,根系的缠绕会对土壤进行固持使其更加稳定,茎叶和凋落物会减少雨水对地表的侵蚀,这会使该地区由于土壤侵蚀带走的有机碳大大减少,进而保存了大量土壤有机碳。随着植被恢复年限的增加,地上生物量大幅度增加,大量的地上生物量一方面会降低雨滴对表层土壤的溅蚀,另一方面会显著增加植被碳储量,除此之外,在植被衰落时会向土壤输入大量的凋落物,这不仅会抑制地表径流的形成,还会有效的保存土壤中的水分改善植物生存条件,进一步提高植物的生物量[41]。凋落物是土壤有机碳的主要来源,凋落物由易分解的糖类、淀粉、脂肪等和难分解的木质素、多酚等组成,凋落物的分解不仅可以提高土壤的碳含量,改善土壤的理化性质,也会增加土壤微生物的数量,改变土壤微生物群落特征,大量凋落物的输入会改变土壤有机碳的含量[42]。禾草、多年生植物拥有发达的根系和更多的生物量,不仅在生长季提供大量的生物量并减少表层土壤有机碳的流失,在衰亡期也会向土壤中输入大量的根系与凋落物,这都会造成植被恢复区土壤碳积累[25, 41]。杂草和一年生植物与生态系统碳储量呈显著负相关(P<0.05)(表4),相对于禾草与多年生植物,杂草和一年生植物的根系较浅且植株较低矮,因而对生态系统根系和凋落物的输入远低于禾草和多年生植物,在有限的资源与空间中,禾草与多年生植物会贡献更多的有机碳[27]。因此,禾草和多年生植物与生态系统碳储量呈正相关,而杂草和一年生植物与其呈负相关。总而言之,植被恢复是通过促进植物生长,改变下垫面性质进而减少土壤有机碳流失,增加植被碳储量和土壤碳储量来提高生态系统碳储量。
4 结论
退耕还草后,群落盖度随着植被恢复不断增加,优势种从达乌里胡枝子、赖草、茵陈蒿、演变为长芒草、铁杆蒿,禾草类、多年生草本和灌木代替杂草和一年生植物,逐渐占主导优势。生态系统碳储量在植被恢复初期下降,然后恢复35 a后超过农田碳储量水平。禾草类、多年生植物和灌木发达的根系与高大的植株不仅增加了生态系统碳的输入,而且减少了土壤碳损失。植被恢复15 a后,由于豆科类植物对0—10 cm土壤碳储量产生较大的影响造成生态系统碳储量也在第15年发生较大的变化。因此,由于长期的植被恢复,群落组成的变化通过增加植被碳储量与土壤碳储量进而提高了生态系统碳储量,而影响生态系统碳储量变化的主要植被因子是多年生植物、杂草与禾草的重要值和地下生物量与凋落物生物量。
