Genistein通过上调Cyclin D1和CDK4的表达促进卵巢癌OVCAR-5细胞的增殖
2021-01-14王中卫任洪涛杨鹏涛潘淑沛王亚利
李 雯,李 毅,王中卫,任洪涛,张 杨,杨鹏涛,潘淑沛,王亚利
(西安交通大学第二附属医院肿瘤放疗科,陕西西安 710004)
卵巢癌是妇科常见的恶性肿瘤之一,其死亡率居妇科恶性肿瘤之首。由于卵巢癌发病隐匿且缺乏有效筛查手段,70%的患者就诊时已处于晚期。即使行肿瘤细胞减灭术和化疗,70%的患者仍会复发。并且每次治疗后,大部分患者的复发周期会逐步缩短并产生耐药性。
早期研究认为持续排卵后伤口愈合引起的细胞增殖过快和促性腺激素刺激可能是卵巢癌的发病机制[1-3]。之后的研究表明卵巢癌的病因要复杂得多。雌激素受体激活,活性氧(ROS)水平升高和NF-κB介导的炎症可能都是卵巢癌发病机制之一[4-6]。植物雌激素不仅有弱的雌激素活性,而且有清除自由基、抗炎等作用,这些机制可能有助于其影响癌症的进展。摄入含有植物雌激素的食物可以降低卵巢癌的发病率[7]。Genistein是广泛存在于食物和中草药特别是大豆类食物中植物雌激素的一种主要类型,对β雌激素受体有高度亲和力,可以通过多重机制发挥抗癌作用[8]。研究发现,Genistein可以诱导有抗炎作用的谷胱甘肽过氧化物酶的表达,以及抑制前列腺癌细胞株LINCaP和PC-3的增殖[9]。
植物雌激素和卵巢癌流行病学相关性研究尚存争议[10-13]。BANDERA等[14]通过一项病例对照研究分析食物或补品中植物雌激素的摄入和卵巢癌罹患风险的关系,尚未发现两者之间存在相关性。然而,QU等[15]纳入10个观察性研究的Meta分析结果发现,植物雌激素的高摄入和卵巢癌罹患风险的降低是有关的;亚群分析表明异黄烷酮、大豆食品及亚洲饮食方式能够降低卵巢癌的发病率。因此,卵巢癌细胞中植物雌激素的生物活性值得进一步的研究。
本研究分析了Genistein对卵巢癌细胞株OVCAR-5细胞增殖的影响,并明确了细胞生长、活性和关键细胞周期调节因子的表达。研究结果可为深入分析Genistein在卵巢癌细胞中的作用和机制提供基础信息。
1 材料与方法
1.1 细胞培养卵巢癌细胞株OVCAR-5细胞培养于RPMI-1640培养基,含100 mL/L胎牛血清和1%青霉素/链霉素,在37 ℃的50 mL/L CO2环境下培养。
1.2 材料Genistein购自德国Merck KGaA公司。抗体的稀释倍数、目录号和来源分别是:①抗增殖细胞核抗原小鼠抗体1∶1 000 Cat. No. SC-56, Santa Cruz Biotechnology, Inc. Dallas, Texas, USA。②抗CDK4兔子多克隆抗体,1∶1 000 Cat. No. ab108357, Abcam Cambridge, MA, USA。③抗Cyclin D1多克隆抗体,1∶1 000 Cat. No. ab40754, Abcam Cambridge, MA, USA。④抗蛋白p21小鼠单克隆抗体,1∶1 000 Cat. No.SC-397, Santa Cruz Biotechnology, Inc. Dallas, Texas, USA。⑤抗蛋白p27兔子多克隆抗体,1∶1 000 Cat. No.3686S, Cell Signaling, Danvers, MA, USA。⑥抗β肌动蛋白小鼠单克隆抗体,1∶1 000,Cat. No.EG-262, 1∶1 000;Excellgen, Rockville, MD, USA。⑦二抗,抗兔子IgG-HRP Cat. No.SC-2301, Santa Cruz Biotechnology, Inc. Dallas, Texas, USA。⑧二抗,山羊抗小鼠IgG-HRP Cat. No.G21040, Thermo Scientific, Waltham, MA, USA。
1.3 方法
1.3.1细胞计数和MTS检测 将OVCAR-5细胞接种在96孔培养板,用1 μmol/L的Genistein处理后,每隔24 h记1次细胞数。在每个时间点,通过胰蛋白酶-乙二胺四乙酸的消化作用收集细胞。用4 g/L的台盼蓝(锥虫蓝)溶液混合悬浮的细胞,并用血细胞仪进行细胞计数。对于MTS法细胞活性实验,用1 μmol/L的Genistein处理,在每个时间点,把20 μL含有MTS[3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲酯基)-2-(4-磺苯基)-2H-四唑]细胞滴度为96的水溶液(Cat.No.G5430, Promega, Madison, WI, USA)加入培养基中。1 h后,将100 μL的培养基从培养板中移开,并用96孔读板仪(Modulus Microplate Multimode Reader, Turner BioSystems, USA)测量490 nm处的吸光度。
1.3.2BrdU联合检测免疫组化实验 用1 μmol/L Genistein(终浓度)处理OVCAR-5细胞48 h。将5-溴-2′-脱氧尿苷(BrdU) (Cat. No.000103; Invitrogen, Rockville, MD, USA)加入细胞培养基中,用2 h和基因组DNA整合。用冰冷PBS洗涤后,用700 mL/L的乙醇在4 ℃下固定细胞3 h,并用2 mL/L的Triton X-100渗透30 min。按制造商的指示使用BrdU试剂盒(Cat. No.933943; Invitrogen)进行BrdU抗体结合和显色。对BrdU阳性的细胞和所有细胞进行计数,计算出BrdU的阳性率。
1.3.3RNA提取和实时PCR 用1 μmol/L Genistein对OVCAR-5细胞处理48 h后,经冰冷PBS洗涤,再用RNeasy超迷你试剂盒(Cat.No.74136,QIAGEN, Valencia, CA, USA)提取出全部RNA。用1 000的分光光度计(Thermo Scientific, Waltham, MA, USA)测量RNA浓度。在高容量RNA-to-cDNA试剂盒(Cat. No.4387406, Applied Biosystems, Foster, CA, USA)中,用1 μg RNA合成cDNA。用Primer3程序(http://bioinfo.ut.ee/primer3-0.4.0/primer3/)设计实时PCR引物(表1)。用ABI 7900HT快速实时PCR仪(Applied Biosystems, Dublin, Ireland)做定量实时PCR。每个实时PCR反应体系:6 μL实时PCR反应混合物(Cat. No.75600, VeriQuest SYBR-Green master mix, Affymetrix, Cleveland, OH, USA),2 μL 1∶100稀释的cDNA,1 μL正向、反向引物(10 μm)以及2 μL ddH2O。95 ℃变性10 min;40个循环扩增:95 ℃变性15 s;60 ℃退火30 s;72 ℃扩增1 min。GAPDH作为内参基因,以使结果标准化。解链曲线分析证实了目标cDNA的特异性扩增。用GAPDH水平使目标RNA相关RNA的表达水平标准化。
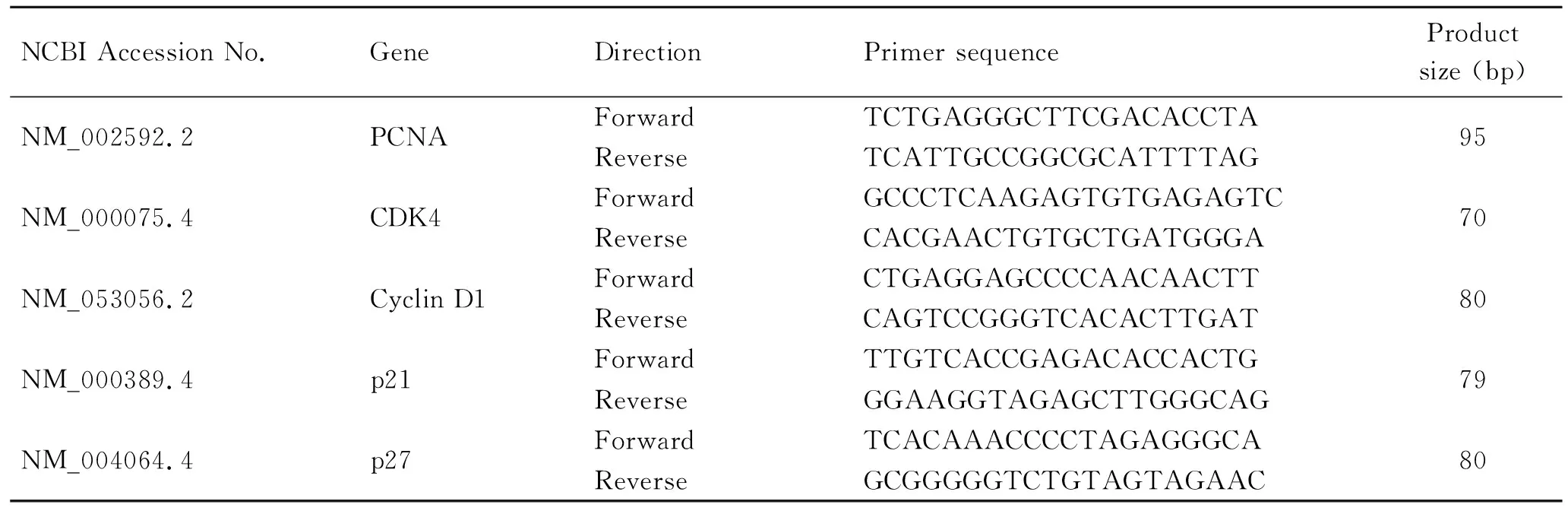
表1 实时PCR引物Tab.1 The Real-time PCR primers
1.3.4Western blotting检测 用1 μmol/L Genistein处理OVCAR-5细胞48 h。经冰冷PBS(pH 7.4)洗涤2次,用冰冷裂解缓冲液[150 mmol/L NaCl,50 mmol/L Tris-盐酸(pH 7.4),0.1% SDS,0.5%脱氧胆酸钠,1%诺乃清洁剂P-40]在冰上裂解,并用1% Halt蛋白酶抑制剂混合物(100×; Thermo Scientific, Rockford, IL, USA)、1 mmol/L苯甲基磺酰氟(PMSF)、5 mmol/L氟化钠(NaF)及1 mmol/L钒酸钠(Na3VO4)补充。收集细胞裂解物,并在4 ℃离心30 min(1 400 r/min)。将35 mg蛋白和SDS上样缓冲液混合,煮沸5 min,根据目标蛋白相对分子量于8%~12% SDS-聚丙烯酰胺凝胶中溶解分离。将蛋白转移到PVDF膜上,含有50 g/L脱脂牛奶和0.1% Tween-20的TBS用于阻止非特异性结合。在主要抗体结合、广泛洗涤和第二抗体结合后,用ECL系统(Cat. No.32106, Thermo Scientific, Rockford, IL, USA)进行显色。剥离膜和检测肌动蛋白以提供蛋白负荷控制。
2 结 果
2.1 Genistein促进了OVCAR-5细胞的增殖与活性为了检测染料木黄酮对细胞生长的影响,用1 μmol/L Genistein处理OVCAR-5细胞,每日细胞计数(图1)。与对照组相比,Genistein处理细胞3 d后,细胞数量显著增多。MTS法实验结果与之一致,经处理4 d后,各时间点的细胞活性显著增加(图2)。这表明Genistein能够促进OVCAR-5细胞的增殖和活性。
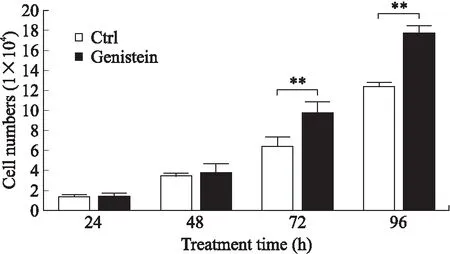
图1 细胞增殖实验结果
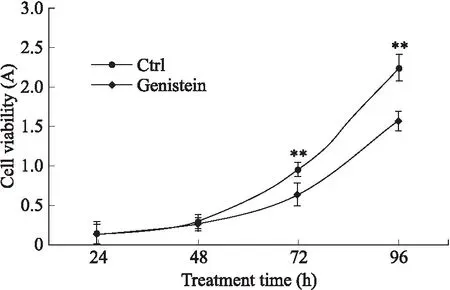
图2 测量细胞活性的MTS实验结果
2.2 Genistein促进细胞DNA合成用BrdU免疫组化实验检测Genistein对DNA合成的影响。在处理3d后对阳性细胞和所有细胞计数,得到阳性率(图3),和对照组相比,实验组的BrdU免疫组化染色增加,表明DNA合成上调。该结果与之前实验中Genistein促进细胞增殖与活性的结果一致。
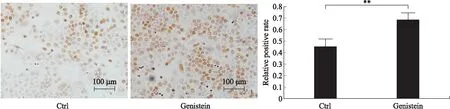
图3 BrdU免疫组化染色分析实验结果
2.3 Genistein引起细胞周期调节因子mRNA水平变化基于上述Genistein对细胞作用的实验结果,实时PCR测定PCNA、Cyclin D1、CDK4、p21及p27的mRNA表达(图4)。PCNA是DNA合成所需要的,经常被用作细胞周期进展的标记。Cyclin D1和CDK4是G1-S期转变所需的细胞周期调节因子。P21和p27是细胞周期进程的负调控因子。Genistein处理2 d后的结果表明PCNA、Cyclin D1和CDK4的mRNA水平明显上调,p21和p27的mRNA水平显著下降。表明Genistein对OVCAR-5细胞G1-S期的转变有强正性作用。
2.4 Genistein引起细胞周期调节因子蛋白水平变化为了明确上述细胞周期调节因子蛋白水平上的变化,对Genistein未处理和处理48 h的细胞中分离出的总蛋白进行蛋白印迹分析(图5)。用来自相应LCs的值进行密度分析和使结果标准化。结果显示PCNA、Cyclin D1和CDK4的蛋白水平显著增高,p21和p27蛋白表达下降。表明Genistein对OVCAR-5细胞的作用之一是促进细胞周期进程。
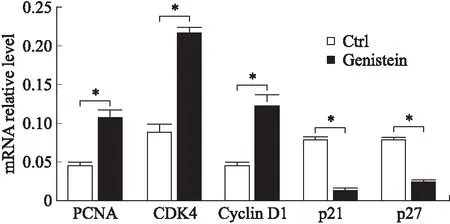
图4 细胞周期调节因子mRNA水平变化
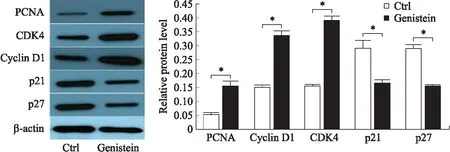
图5 细胞周期调节因子的蛋白表达变化
3 讨 论
为了评估Genistein对卵巢癌细胞增殖的影响,本研究在用Genistein处理OVCAR-5细胞后行细胞计数和MTS检测,结果均表现为Genistein促进细胞增殖和DNA合成。为了证实Genistein对细胞周期进程的作用,检测了多个细胞周期活化因子和抑制因子mRNA水平和蛋白表达水平的变化。CDK4(细胞周期蛋白依赖性激酶4)是一种丝氨酸/苏氨酸激酶,使视网膜细胞瘤(RB)基因产物和Smad3的磷酸化,促进G1-S期转变[16]。Cyclin D1是细胞周期蛋白家族中的一员,可以与几个CDKs组成复合体,使重要的细胞周期调节因子磷酸化。PCNA在DNA双链周围起支架作用,在DNA复制过程中促进DNA聚合酶及其他因子的募集。PCNA的水平反映细胞周期的正性进程[17]。p21是强效的CDKI(细胞周期蛋白依赖性激酶抑制因子),通过结合细胞周期蛋白如CDK1和CDK2下调G1-S期的转变。相似地,p27阻止CDK2和CDK4的活化以减缓细胞周期进程[16,18]。本研究发现这些细胞因子mRNA和蛋白表达变化趋势一致。CDK4、Cyclin D1和PCNA等活化因子的水平增加,p21和p27等抑制因子的水平降低,表明Genistein促进细胞增殖很可能是通过促进G1-S期转变所实现的。
文献检索发现大量关于植物雌激素对癌细胞作用的研究,但观察结果存在争议。大多数使用来自乳腺、大肠和前列腺等恶性肿瘤细胞株的研究表明Genistein能够抑制癌细胞的增殖[11-12]。与之相反的是CHEN等[19]观察到在宽范围浓度(0.001~1 μmol/L)内的Genistein以剂量依赖的方式刺激Hela细胞的增殖。用Genistein处理Hela细胞组织引起细胞的S期增加、G1期减少,表明Genistein可能促进G1-S期转变。而且,Genistein处理后细胞凋亡减少、Αkt和ΝF-κB活化。因此推断Genistein可能通过雌激素受体介导的PPI3K/Akt/ΝF-κB通路促进Hela细胞增殖[19]。LUCKI等[20]得到了相似结果,他们发现Genistein通过诱导酸性神经酰胺酶的表达刺激MCF-7乳腺癌细胞生长。Genistein对癌细胞作用的差异可能是由不同的细胞因子引起的。首先,ERα或者ERβ的活化可引起不同的细胞应答,ERα活化有刺激作用,ERβ活化有抑制作用。因此最终的细胞应答取决于两种ER在不同细胞或组织中的比例。第二,低浓度Genistein与ERβ结合,高浓度Genistein与ERα、ERβ均结合,细胞效应将相应变化为抑制或刺激[21]。第三,当培养基没有雌二醇或其他更强的雌激素化合物时,Genistein弱的雌激素效应将表现出来。但是当实验体系包含相当高水平的雌二醇或者其他强的雌激素化合物时,Genistein将和这些强雌激素化合物竞争并表现为抑制作用。虽然一些研究强调要清除培养基和血清中预先存在的雌激素,但是其他研究只用了含有酚红的培养基和含有雌激素的血清,这可能会对最终观察到的结果产生影响。第四,通过雌激素受体或其他通路介导的表观遗传机制,可能有助于Genistein作用产生[22]。RIETJENS等[23]提出一个二次元模式,可以解释关于异黄酮对细胞增殖看似矛盾的作用。除了ER介导的反应外,异黄酮可能也通过一些尚未解释清楚的机制影响DNA甲基化、组蛋白修饰和miRNA的表达模式。
本研究用无酚红培养基和无雌激素培养基进行细胞培养,这可能部分解释了Genistein在无雌激素环境下的雌激素效应。重要的是,上述结论可能也适用于活体环境,并可能释了为什么会从年龄、绝经状态或BMI(已知影响内源性雌激素水平的因素)等不同人群的流行病学研究中获得不一致的结果。在活体内Genistein对癌症发展的影响可能会受到其他因素如肿瘤免疫、微环境及细胞间相互作用等的影响。即使Genistein的摄入对卵巢癌的发生有预防作用,也不一定是由其直接抑制细胞增殖引起的。从这个角度看,需要在雌激素化合物的背景水平下进行更全面的研究,以确定Genistein对癌细胞的确切作用。
综上所述,本研究评价了广泛存在于食物和中草药中植物雌激素的主要类型——Genistein在无雌激素环境中对卵巢癌OVCAR-5细胞的细胞增殖作用。结果表明Genistein能明显促进卵巢癌细胞增殖。此外,Genistein作用细胞可引起多个细胞周期调节因子和标志物表达的改变。这些发现丰富了目前对植物雌激素生物活性的认识,并将促进今后对其潜在分子机制的研究。
