脂多糖结合蛋白在口腔鳞状细胞癌中的表达及其临床意义
2021-01-13黄俊文乔洁梅子陈茁李杨乔彬
黄俊文 乔洁 梅子 陈茁 李杨 乔彬
1.郑州大学第一附属医院口腔颌面外科 郑州450052;2.湖北大学生命科学学院 省部共建生物催化与酶工程国家重点实验室 武汉430062
口腔鳞状细胞癌(oral squamous cell carcino‑ma,OSCC)为常见肿瘤之一,其中每年新发病例约35.5 万例,死亡病例约17.7 万例[1]。近年来,有关OSCC 的诊治取得很大进展。尽管如此,国外流行病学调查发现,2019 年OSCC 的发病率和死亡率依旧达到3.71%和2.41%[2]。究其原因,除了有限的治疗手段等因素外,肿瘤微环境与癌症细胞间的相互作用在OSCC 的发生发展以及不良预后中扮演着重要角色。炎症是肿瘤微环境的重要组成部分,与人类20%的肿瘤有关[3],被认为是恶性肿瘤八大特征之一[4]。
脂多糖结合蛋白(lipopolysaccharide binding protein,LBP)是1 种主要由肝细胞合成的相对分子质量为6×104的Ⅰ型急性期反应糖蛋白[5]。LBP在调节感染或炎症疾病引起的全身炎症反应中起到重要作用[6],其对宿主免疫调节的作用主要是通过脂多糖(lipopolysaccharide,LPS)介导的信号通路实现的。即LBP 参与LPS 向分化抗原簇14(cluster of differentiation 14,CD14)的转移,然后 通 过Toll 样 受 体4 (Toll‑like receptor,TLR4)信号途径激活巨噬细胞,从而引发先天性免疫反应[7‑8]。另有研究报道,LBP 在人外周血单核细胞上表达,并且还可以不依赖LPS 诱导途径直接与人巨噬细胞和单核细胞相互作用[9]。此外,Boylan等[10]通过iTRAQ®定量蛋白质组分析技术发现,人卵巢癌中LBP 蛋白表达量是正常人LBP 蛋白表达量的2 倍左右。随后发现LBP 在多种癌组织中过表达,并且与癌症的发展息息相关[11‑13]。然而,LBP在OSCC中的作用却鲜有研究。
CD204 亦称巨噬细胞清道夫受体A(macroph‑age scavenger receptor A,MSR‑A),是巨噬细胞表达的主要受体之一[14],主要调控巨噬细胞替代性活化。并且大量研究表明,CD204 与包括OSCC在内的多种癌症关系密切[15‑18]。鉴于此,将LBP与CD204 进行免疫组织化学双染实验,可以初步探索LBP 与巨噬细胞的基本关系并为以后研究LBP与OSCC的作用机制奠定基础。
本研究中,笔者通过对LBP、CD204 蛋白进行免疫组织化学双染实验以及酶联免疫吸附试验以检测LBP 在OSCC 患者癌组织和血清中的表达情况。同时,本研究也对LBP 与OSCC 的临床病理特征作了相关性分析,以探究LBP 在OSCC 中的表达及其潜在的意义。
1 材料和方法
1.1 研究对象
本研究选择2018 年1 月—2020 年4 月在郑州大学第一附属医院诊治的178名成年OSCC患者和90 名正常人。OSCC 患者纳入标准为临床病理诊断为原发性OSCC,并且术前未行放疗和化疗。其中选取48 名OSCC 患者,于手术过程中采集癌组织及相对应癌旁组织(距离癌组织>3 cm)标本,立即行4%多聚甲醛固定;选取130 名OSCC患者和90 名正常人分别于术前空腹及空腹状态下抽取3 mL 外周静脉血,注入促凝管中静置1 h 后,4 ℃离心10 min(3 000 r·min‑1),吸取血清并分装置于‑80 ℃中保存。收集患者的临床病理资料主要包括肿瘤分期、淋巴结转移、临床分期和病理分级等。所有标本的收集及使用均经受试者同意并签署知情同意书,本实验已经郑州大学第一附属医院伦理委员会批准同意。
1.2 实验材料
DS‑0001 免疫组织化学试剂盒(北京中杉金桥公司),DY870‑05 试剂盒(R&D Systems 中国公司)。兔抗人LBP 抗体(HPA001508,中国Sigma‑Aldrich公司),工作质量分数为1∶100;鼠抗人CD204 抗体(Clone No. SRA‑E5,Transgenic公司,美国),工作质量分数为1∶200。
1.3 免疫组织化学实验
免疫组织化学实验的主要步骤如下:厚度为3 μm 的组织切片分别经二甲苯和梯度酒精脱蜡和水化,高温高压下柠檬酸钠缓冲液抗原修复后进行内源性酶阻断剂和山羊血清封闭,LBP 和CD204 混合一抗4 ℃孵育过夜,复温后行混合二抗孵育,DAB 和GBI 显色,Mayer’s 苏木素复染,封片等。未添加一抗组设为阴性对照组。每次实验至少重复3次。所有切片均经400倍放大观察并选取10个具有代表性的视野进行拍片,由3名病理医生结合巨噬细胞阳性染色的强度和所占百分比进行评分。巨噬细胞阳性染色强度记分的标准如下。0:无染色;1:轻度染色;2:中度染色;3:重度染色。阳性细胞所占百分比记分的标准如下。0:阴性;1:1%~25%阳性细胞;2:25%~50%阳性细胞;3:50%~75%阳性细胞;4:75%~100%阳性细胞。最后计算两种记分的乘积求得平均值[19]。此平均值>0者为阳性,反之为阴性。
1.4 酶联免疫吸附试验
血清样本稀释度为1∶100,实验步骤严格按照DY870‑05 试剂盒说明书进行,其主要步骤如下。首先将捕获抗体包被在酶标板上,室温孵育过夜,次日封闭液封闭1 h,随后依次加入标准品或血清样本及检测抗体各室温孵育2 h,接着先后加入辣根过氧化物标记酶和底物溶液显色,各室温避光孵育15 min,最后加入终止溶液终止显色,用酶标仪分别在450 nm 和540 nm(校正波长)下测定光密度值(optical density,OD),进而绘制标准曲线计算样本的LBP 血清质量浓度。每次实验至少重复3次。
1.5 统计学分析
采用SPSS 21 进行数据分析,若数据符合正态分布者用χˉ±SD 表示,选择独立样本t检验或单因素ANOVA 分析比较LBP 或CD204 表达水平与不同分组之间的关系,反之用M(Q1‑Q3)表示,选择Mann‑Whitney或Kruskal‑Wallis非参数检验进行比较。采用Medcalc 绘制ROC 曲线分析LBP 血清浓度在OSCC 诊断的应用价值,利用You‑den 指数确定LBP 血清质量浓度最佳临界值并计算相应的特异性和灵敏度。ROC 曲线下面积(area under curve,AUC)采用Z检验。P<0.05为差异具有统计学意义。
2 结果
2.1 LBP在OSCC组织中过表达
免疫组织化学实验的标本信息见表1。LBP主要表达在OSCC 中的间质细胞胞浆内或胞膜上,呈红色染色;CD204 主要表达在OSCC 中的巨噬细胞胞浆内或胞膜上,呈黄褐色染色。CD204 和LBP 共表达在巨噬细胞中则呈现暗红色染色,说明LBP 表达在巨噬细胞中。双染结果发现,和癌旁组织相比,OSCC 组织中的LBP 表现出更强的染色强度和更广的染色范围。本实验对双染结果进行半定量分析,发现癌组织中的免疫组织化学评分明显比癌旁组织的高(P<0.001),提示LBP可能是OSCC 的检测标志物。同时CD204 在OSCC 组织中过表达(图1)。另外,本实验还发现,LBP 主要表达在巨噬细胞中,这提示LBP 可能通过与巨噬细胞相互作用从而对OSCC 产生影响。
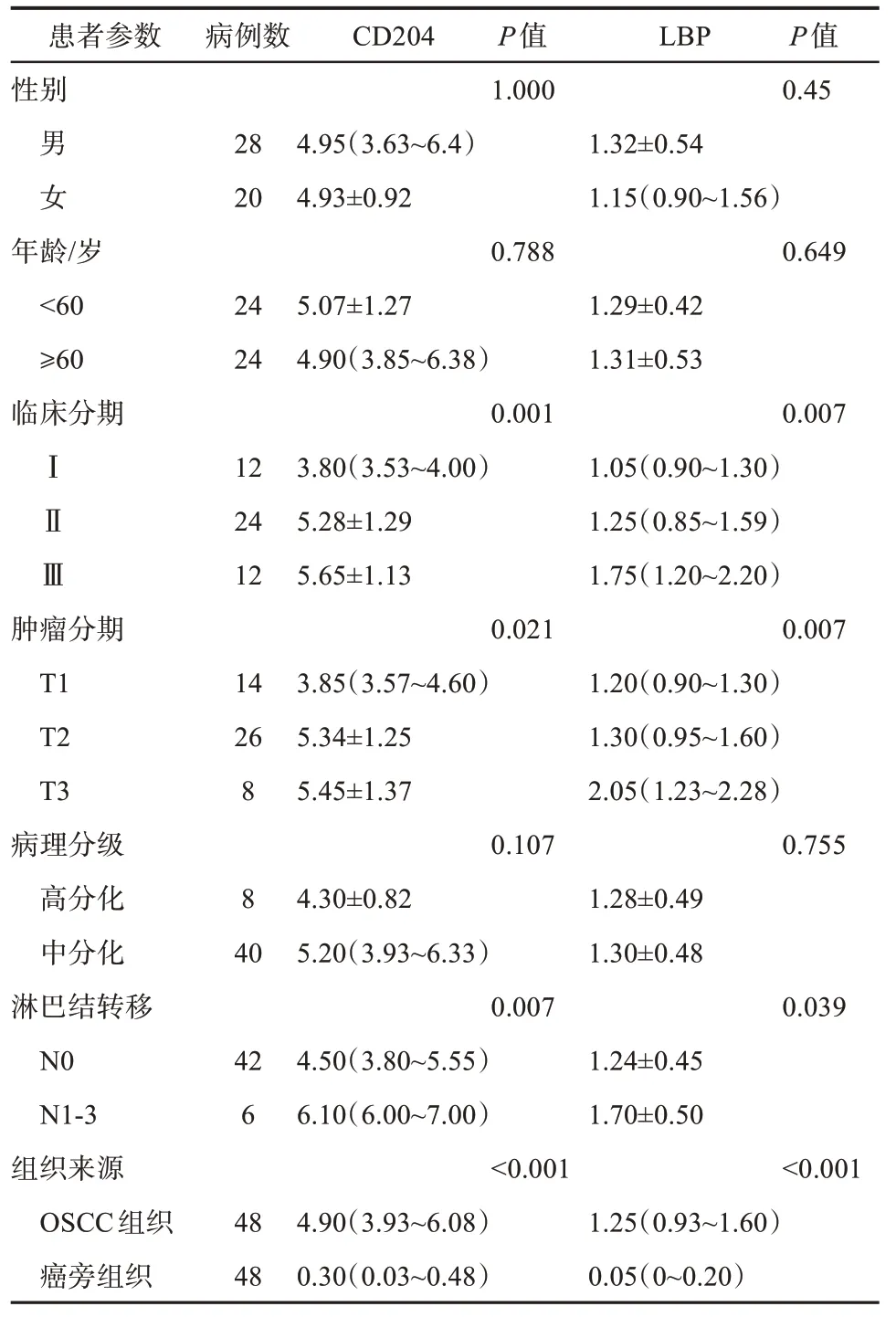
表1 LBP的表达与OSCC患者临床病理特点的关系Tab 1 Association between the patient’s clinicopathological characteristics and LBP expression in OSCC patients
2.2 LBP 与OSCC 患者的肿瘤分期、淋巴结转移以及临床分期相关
本实验对OSCC 的肿瘤分期、淋巴结转移、病理分期和临床分期进行统计分析,发现在不同肿瘤分期的癌组织中,LBP 表达水平有明显差异(P=0.007)。同时,临床分期越高,LBP 表达量也越大(P=0.007)(图2)。
与淋巴结未转移患者的LBP 表达水平相比,淋巴结已转移患者的LBP 表达水平显著升高(P=0.039)(图3)。
此外,本实验也发现CD204 与OSCC 患者的肿瘤分期、淋巴结转移及临床分期明显关联(P<0.05)。然而,本实验并未发现LBP 或CD204 与OSCC 的病理分级有关(P>0.05),其与患者的年龄、性别亦不相关(图3)。
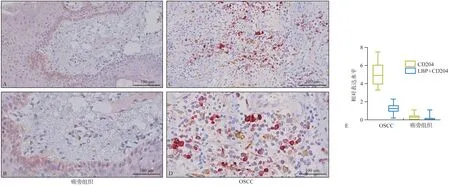
图1 LBP和CD204在OSCC组织中过表达Fig 1 The overregulated expression of the LBP and CD204 protein in the OSCC tissues
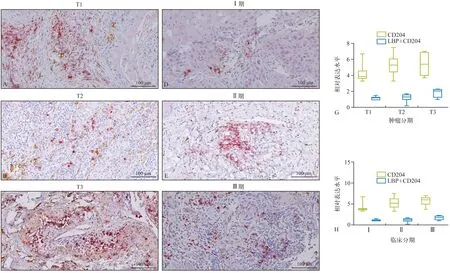
图2 LBP和CD204在不同的肿瘤分期以及临床分期OSCC中的表达Fig 2 The LBP and CD204 protein expression in different T‑classification and clinical stage of OSCC
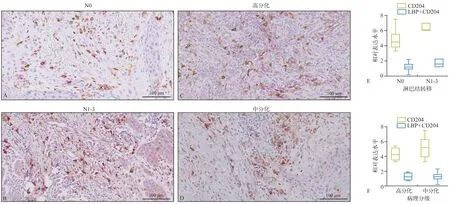
图3 LBP和CD204在不同的病理分级以及淋巴结转移OSCC中的表达Fig 3 The LBP and CD204 protein expression in different histological grade and node lymph metastasis of OSCC
从这些结果可以预测,LBP 与OSCC 的发生发展以及淋巴结转移有关。
2.3 LBP在OSCC患者血清中的表达
由于前期研究发现,LBP 与OSCC 有相关性,本研究则进一步检测了LBP 在OSCC 患者血清中的表达情况。
酶联免疫吸附试验的标本信息见表2。实验结果表明,正常人LBP 血清质量浓度为1.02 μg·mL‑1(0.81~1.10 μg·mL‑1),OSCC 患者的LBP 血清质量浓度为1.59 μg·mL‑1(1.31~2.03 μg·mL‑1)。与正常人比较,OSCC患者的LBP血清质量浓度明显升高(P<0.001)。并且本实验对OSCC 患者的临床病理特点进行统计学分析,发现LBP 血清质量浓度与其临床分期(P<0.001)和肿瘤分期(P<0.001)相关。然而,OSCC患者的年龄、性别、病理分级以及淋巴结转移与LBP 血清质量浓度之间未出现相关性(图4)。此结果与免疫组织化学实验结果基本保持一致。
2.4 LBP血清质量浓度在OSCC诊断中的价值
本实验通过绘制ROC 曲线分析血清中LBP 质量浓度在OSCC诊断中的价值。其中AUC为0.876(95%CI,0.825~0.917;Z=15.614;P<0.001),LBP血清质量浓度的最佳截断值为0.733 μg·mL‑1,此时的特异性为93.3%,敏感性为80.0%(图5)。这提示,LBP 血清质量浓度可以作为有效的OSCC诊断辅助指标之一。

表2 LBP血清浓度与OSCC患者临床病理特点的关系Tab 2 Association between the patient’s clinicopathological characteristics and LBP serum level in OSCC patients
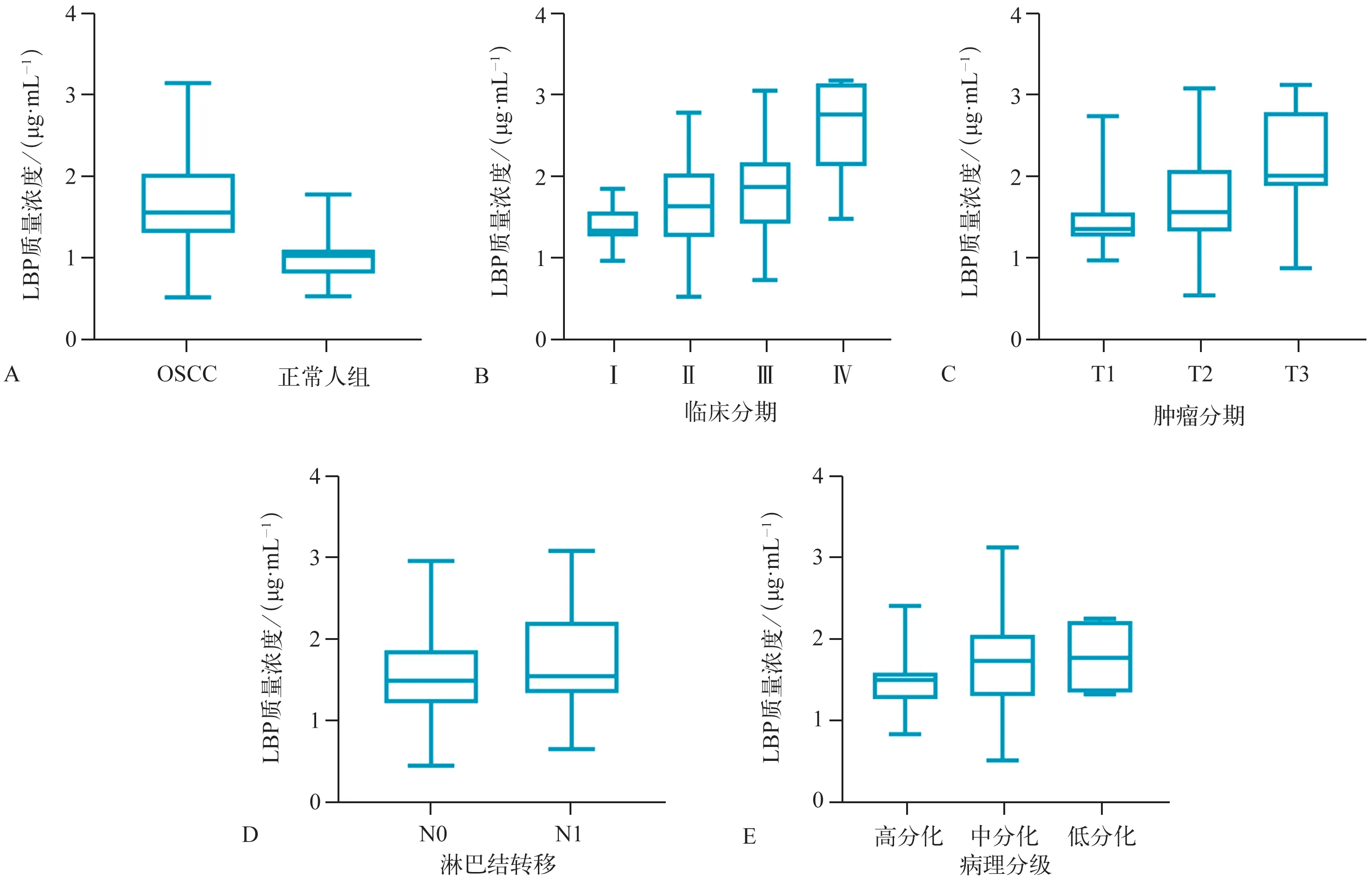
图4 LBP在OSCC患者以及正常人组的血清质量浓度Fig 4 The increased serum level of LBP in OSCC patients
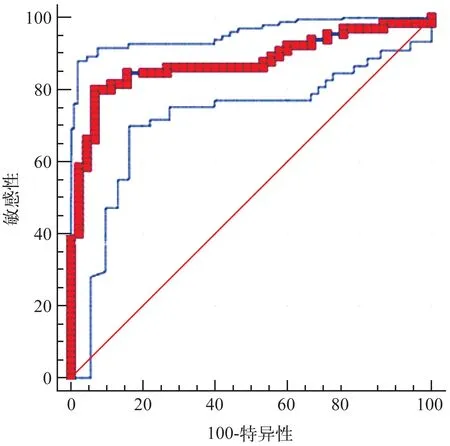
图5 OSCC组与正常人组ROC曲线Fig 5 ROC curve for OSCC patients vs.normal group
3 讨论
本研究首次提出LBP 在人OSCC 中高表达,并且发现LBP 与OSCC 的肿瘤分期、淋巴结转移以及临床分期有关,但未发现其与OSCC 患者的性别、年龄以及病理分级相关。并且通过ROC 曲线分析发现LBP 血清质量浓度在OSCC 诊断中具有重要价值。
大量研究表明,LBP 在促进癌症发展方面可能发挥重要作用。例如,Boylan等[10]发现人卵巢癌LBP 蛋白表达量明显比正常人高。在人结肠癌中也检测到LBP 基因异常表达[20‑21]。而且,LBP 也被报道有助于癌症的发生、转移和不良预后。Kovacs等[11]发现无论是基因水平还是蛋白水平,LBP 在传统性肾细胞癌中都显著高表达,并且随着临床分期和病理分级的增加而增高,这对于传统性肾细胞癌的发生和不良预后作用突出。在肝细胞癌中也能观察到类似现象,而且与LBP 低表达组相比,LBP 高表达组的平均总生存期相对减少17 个月,平均复发时间相对提前13.1 个月[22]。同时,人血清中LBP 的质量浓度与非小细胞肺癌呈正相关,转移性非小细胞肺癌患者血清中LBP表达水平也远高于非转移性非小细胞肺癌患者[13]。
CD204 主要在肿瘤相关巨噬细胞中表达,在多种癌症中有广泛研究,被认为是肿瘤相关巨噬细胞的分子标志物。本实验中表达CD204 的巨噬细胞呈现黄褐色染色,在不同的肿瘤分期、淋巴结转移以及临床分期OSCC 中,CD204 表达存在明显差异,表明CD204 与OSCC 的发生发展有关,这与以往的报道相一致[23]。
已有研究报道,LBP 在巨噬细胞上有表达[9],本研究通过免疫组织化学双染实验发现共表达在同一细胞的LBP 和CD204 两者染色相互叠加显现新的染色,并且此种细胞主要浸润在肿瘤组织间质中,从而证实了LBP 表达在OSCC 的肿瘤相关巨噬细胞上。体外实验表明,LPS 刺激与单核细胞共培养的头颈部鳞状细胞癌细胞,可以增强巨噬细胞分泌肿瘤促进因子包括CD14、白细胞介素‑6 和一氧化氮等,这个过程可以增强头颈部鳞状细胞癌细胞系的生长和侵袭[24‑25]。进而推测,LBP可能参与肿瘤相关巨噬细胞与肿瘤细胞的相互作用,促进肿瘤相关巨噬细胞分泌细胞因子,引起肿瘤的发生发展。有研究报道,正常人血清中LBP 质量浓度保持在0.5 μg·mL‑1以下[5]。本实验中OSCC 患者的LBP 血清质量浓度明显高于正常人血清中LBP 质量浓度,并且血清中LBP 质量浓度的最佳临界值为0.733 μg·mL‑1,可以作为有效的OSCC辅助性诊断指标之一。笔者初步发现,LBP在OSCC 中异常表达,并与肿瘤的临床分期等有关,对肿瘤的发生发展可能起到正向作用。未来有必要深入研究LBP 在调控OSCC 的发生发展过程中潜在的分子机制。
总之,无论是在OSCC 癌组织或者血清中,LBP 表达水平明显上调,与肿瘤的发生发展有关,提示LBP在OSCC的诊断中具有潜在的临床价值。
利益冲突声明:作者声明本文无利益冲突。
