失笑散降低氧糖剥夺再灌注BV2细胞损伤及NLRP3的表达
2021-01-13王蕾李鹏飞李帆张春兵
王蕾 李鹏飞 李帆 张春兵
摘要 目的:研究失笑散对BV2细胞氧糖剥夺再灌注(OGD/R)模型的保护作用及潜在机制。方法:将BV2细胞分为对照组,模型(OGD/R)组及失笑散组。失笑散组用不同浓度(1、10、20、50、100 μg/mL)预处理BV2细胞2 h。对照组正常培养,不给药,不进行糖氧剥夺(OGD);模型组不给药,与失笑散组同时进行OGD,缺氧结束后再灌注24 h,收集细胞及其上清液。CCK-8法检测BV2细胞的活力;流式细胞术检测BV2细胞的凋亡;实时定量PCR和ELISA分别检测BV2细胞TNF-α、IL-6和NLRP3及相关蛋白Caspase-1、IL-1β、IL-18的mRNA和蛋白表达。结果:不同浓度失笑散并不影响BV2细胞活力。与对照组比较,模型组BV2細胞凋亡显著增多(P<0.01),而高浓度失笑散明显减少BV2细胞凋亡(P<0.05)。实时定量PCR和ELISA结果表明,与模型组比较,失笑散观察组BV2细胞TNF-α、IL-6和NLRP3炎性小体及相关蛋白Caspase-1、IL-1β、IL-18的mRNA和蛋白表达量明显减少(P<0.05)。结论:失笑散减轻OGD/R对BV2细胞的损伤及降低炎症介质的表达,机制可能与调控NLRP3炎性小体介导的炎症信号通路有关。
关键词 失笑散;NLRP3炎性小体;氧糖剥夺再灌注模型;脑缺血再灌注损伤;小胶质细胞;脑卒中;炎症
Abstract Objective:To study the protective effects of Shixiao Powder on hypoxia glucose deprivation reperfusion(OGD/R) of BV2 cells model and explore the potential mechanism.Methods:BV2 cells were divided into a control group,a model group and a Shixiao Powder group.In Shixiao Powder group,BV2 cells were pretreated with different concentrations(1,10,20,50,100 μg/mL) for 2 h.BV2 cells in the control group were cultured normally without drug administration and OGD; BV2 cells in the model group were not treated with OGD at the same time as Shixiao Powder group.After hypoxia,reperfusion 24 h after hypoxia,and the cells and their supernatant were collected.The BV2 cell viability were examined by CCK-8; the apoptosis BV2 cells were observed by flow cytometry; the mRNA and protein expression of TNF-α,IL-6,NLRP3 inflammasome and related proteins(Caspase-1,IL-1β,IL-18) in BV2 cells were detected by real-time quantitative PCR and ELISA.Results:CCK-8 assay showed that there were no significant changes in BV2 cell viability with different concentrations of Shixiao Powder.Compared with the model group,the apoptosis ratio of BV2 cells increased significantly(P<0.01),while high concentration Shixiao Powder markedly reduced the apoptosis of BV2 cells(P<0.05).The results of qPCR and ELISA demonstrated that the mRNA and protein expression of TNF-α,IL-6,NLRP3 inflammasome and related proteins in BV2 cells evidently decreased in Shixiao Powder treatment group(P<0.05).Conclusion:Shixiao Powder can alleviate the damage of BV2 cells induced by hypoxia glucose deprivation reperfusion and the expression of NLRP3.The underlying mechanism may be related to the regulation of inflammatory signal pathway mediated by NLRP3 inflammasome.
Keywords Shixiao Powder; NLRP3 inflammasome; Oxygen glucose deprivation reperfusion model; Cerebral ischemia reperfusion injury; Microglia cells; Stroke; Inflammation
中图分类号:R255.2;R289.4;R742文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.24.006
全世界每年有1 500万人发生脑卒中,严重影响了人类健康[1]。近年来脑卒中成为我国的主要死因,约占全世界脑卒中死亡总人数的1/3[2]。脑卒中根据其潜在的病理学可分为缺血性脑卒中或出血性脑卒中,其中缺血性脑卒中(Ischemic Stroke,IS)占所有脑卒中患者的85%[3]。免疫反应诱导的缺血后炎症是脑缺血再灌注损伤(Cerebral Ischemia Reperfusion Injury,CIRI)的重要过程,小胶质细胞被认为是中枢神经系统的巨噬细胞,在缺血后被激活产生炎症介质[4]。NOD样受体蛋白3(Nucleotide Binding Domain(NOD)-like Receptor Protein 3,NLRP3)炎性小体是重要的先天免疫模式识别受体,参与缺血后炎症反應[5]。近些年来的研究表明中医药通过抗氧化、抗炎和抗缺血再灌注损伤等机制治疗脑卒中[6]。
失笑散由蒲黄、五灵脂组成,来源于《和剂局方》,其有活血通痹、散结止痛的作用[7]。现代药理学研究发现失笑散具有抗血小板、改善内皮功能和降低炎症介质水平功效[8]。本研究拟通过构建体外氧糖剥夺再灌注(Oxygen-glucose Deprivation and Reperfusion,OGD/R)模型,探讨失笑散能否减轻CIRI及其潜在机制。
1 材料与方法
1.1 材料
1.1.1 细胞 选用小鼠小胶质细胞BV2细胞(美国,ATCC细胞库),BV2细胞用含10% FBS、90%高糖DMEM的完全培养基培养,放置37 ℃、5% CO2培养箱中,24 h换液1次,48 h传代1次,密切观察细胞生长状态。
1.1.2 药物 蒲黄、五灵脂各30 g,将其放入电砂锅内,加入600 mL的纯净水,没过药材浸泡30 min。将电砂锅加热,煎煮1 h,用纱布过滤药液至干净容器。将药渣放入电砂锅中再次加入600 mL纯净水,煎煮1 h,过滤药液。2次药液合并混匀,静置到室温。药液分装至离心管中,12 000×g离心10 min。收集离心管里的上层药液至旋蒸器,70 ℃旋蒸至药液蒸发完毕。60 ℃将药液减压浓缩至60 mL,加入320 mL 95%乙醇,使药液含醇量为80%,静置过夜取上清液。60 ℃下将上清液减压浓缩、干燥,得到失笑散干浸膏,用纯水溶解、定容为30 mL,13 000×g离心5 min,取上清液,用0.22 μm微孔滤膜过滤、除菌,得到失笑散提取液,浓度为2 g/mL。所得药液保存在4 ℃环境中,其后可调整所需药液浓度。
1.1.3 试剂与仪器 蒲黄、五灵脂(江苏省中医院中药房);DMEM(高糖和无糖)培养基、胎牛血清、Trizol、0.25%胰蛋白酶(Thermo Fisher Scientific公司,美国,货号分别为:11965092、11966025、12483020、15596026、25200056);DMSO(Sigma-Aldrich公司,德国,货号:D2650);DEPC(北京索莱宝生物科技有限公司,货号:R1600);异丙醇、三氯甲烷、无水乙醇(上海国药集团化学试剂有限公司,货号分别为:40064360、10006818、10009218);CCK-8检测试剂盒(同仁化学研究所,日本,货号:CK04);凋亡检测试剂盒(Biouniquer公司,美国,货号:BU-AP0101);RNA逆转录试剂盒、定量PCR检测试剂盒(TaKaRa公司,日本,货号:2641A、RR037A);小鼠TNF-α、IL-6、IL-1β和IL18 ELISA检测试剂盒(上海酶联生物科技有限公司,货号分别为:ml002095、ml002293、ml001814和ml002294)。CO2培养箱(Thermo Scientific公司,美国,型号:311);缺氧小室(Billups-Rothenberg公司,美国,型号:MIC-101);核酸蛋白浓度检测仪(Eppendorf公司,德国,型号:BioSpectrometer);热循环仪(Applied Biosystems公司,美国,型号:96 well Thermal Cycler);PCR扩增仪(Applied Biosystems公司,美国,型号:7500);酶标仪(Bio-Rad公司,美国,型号:3350);流式细胞仪(BD公司,美国,型号:FACS Canto Ⅱ)。
1.2 方法
1.2.1 分组与OGD/R模型的制备 将细胞分为对照组、模型组和失笑散组。取对数生长期的BV2细胞,弃去培养基,用1 mL高糖DMEM冲洗2次,加入胰酶消化细胞,在镜下确认细胞已被消化,再加入3 mL DMEM多次吹打,收取细胞悬液。离心后,用1 mL胎牛血清(FBS)重悬沉淀细胞。将细胞接种于培养板中,加入无糖DMEM(96孔板每孔100 μL,12孔板每孔1 mL)。将细胞培养板和氧浓度检测仪同时放入缺氧小室中,连接缺氧装置与备用气瓶,用含95% N2和5% CO2的混合气体通气,流量为20 L/min,氧浓度监测仪显示缺氧小室内氧浓度≤0.2%时,快速关紧进、出气阀,将缺氧装置放入CO2培养箱中继续培养4 h。除去培养板中培养液,以高糖DMEM冲洗2次,再加入完全培养基,37 ℃ 5% CO2培养箱中培养24 h,模拟再灌注损伤。
1.2.2 给药方法 失笑散组采用失笑散不同浓度(1、10、20、50、100 μg/mL)预处理BV2细胞2 h。
1.2.3 检测指标与方法 1)CCK-8法检测BV2细胞活力:收集对数期细胞,按密度5×103/孔接种于96孔板中,用完全培养基在37 ℃温箱培养至细胞密度达到80%时,将不同浓度的失笑散(1、5、10、20、50、200、500、1 000、2 000 μg/mL)加入各孔,37 ℃继续培养2 h后,每孔加入10 μL CCK-8试剂。培养板放入培养箱继续培养4 h后,使用酶标仪检测OD值(450 nm)。2)流式细胞仪检测BV2细胞凋亡:BV2细胞按1×105/孔密度接种在12孔板内,失笑散组细胞分别用不同浓度的失笑散预处理2 h。模型组和失笑散组进行OGD/R处理,操作同1.2.1。用无EDTA胰酶收集细胞到流式管中,流式管中加入500 μL的Annexin V Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC和5 μL Propidium Iodide,混匀,室温避光静置15 min等待染色,上机检测细胞凋亡。3)实时定量PCR法检测BV2细胞NLRP3、Caspase-1、IL-1β、IL-6、IL-18、TNF-α的表达BV2细胞按1×105/孔的密度接种于12孔板中,失笑散组细胞分别用不同浓度失笑散预处理2 h。模型组和失笑散组进行OGD/R操作,同1.2.1;OGD/R结束后,吸去各孔培养液,每1 mL Trizol消化两孔,收集至1.5 mL无酶EP管中。使用Trizol法提取细胞RNA,用核酸蛋白检测仪测定RNA值并逆转录为cDNA,进行PCR检测。PCR引物信息见表1。以GAPDH作为内参,目的基因的相对表达量按2-△△Ct的公式计算得到。4)ELISA法检测BV2细胞炎症介质的表达:将细胞以1×104/孔的密度接种于96孔板,失笑散组细胞分别用不同浓度的失笑散预处理2 h,模型组和失笑散组进行OGD/R处理,方法同1.2.1;细胞复氧结束后,收集各组细胞上清液待测。按照ELISA试剂盒说明检测细胞上清中IL-1β、IL-18、IL-6、TNF-α的表达。
1.3 统计学方法 采用SPSS 20.00统计软件进行实验数据统计分析,GraphPad Prism 8软件进行图表绘制。计量资料以均数±标准差(±s)表示,采用单因素方差分析进行统计比较,然后采用One-way Analysis of variance法进行组间比较。以P<0.05为差异有统计学意义。
2 结果
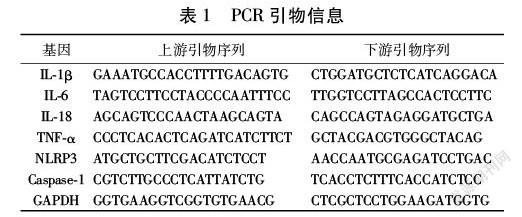
2.1 失笑散对BV2细胞活力的作用 不同浓度失笑散对BV2细胞的活力无显著影响(均P>0.05)。见图1。
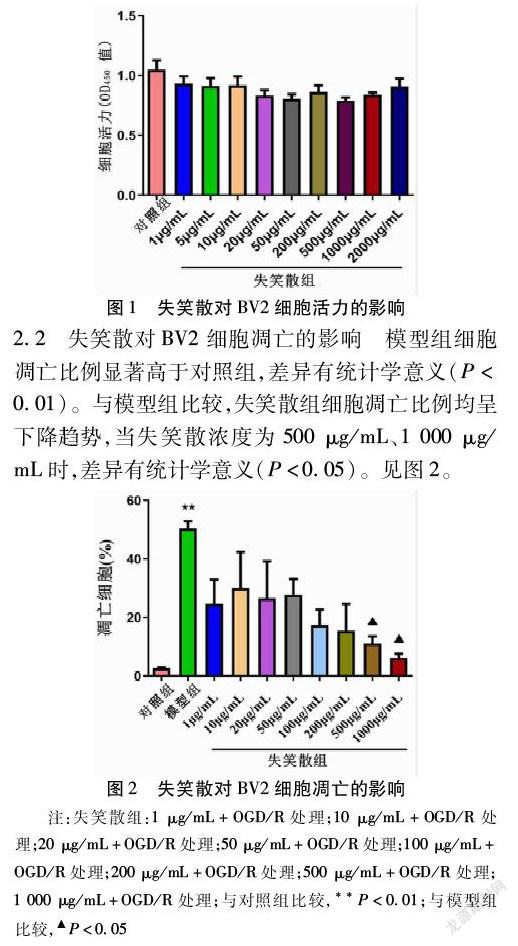
2.2 失笑散对BV2细胞凋亡的影响 模型组细胞凋亡比例显著高于对照组,差异有统计学意义(P<0.01)。与模型组比较,失笑散组细胞凋亡比例均呈下降趋势,当失笑散浓度为500 μg/mL、1 000 μg/mL时,差异有统计学意义(P<0.05)。见图2。
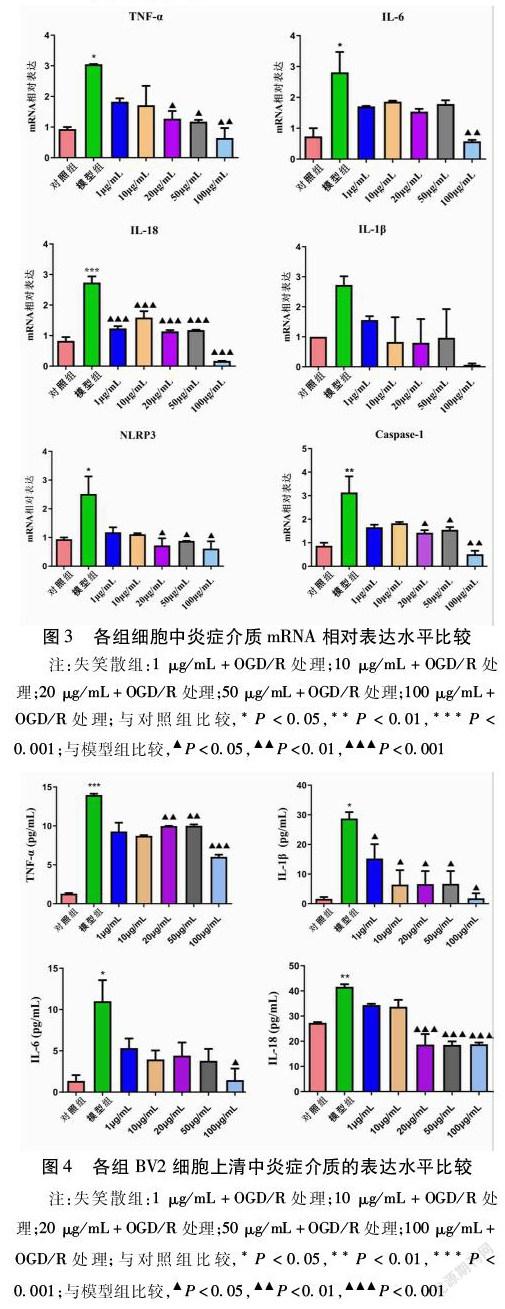
2.3 各组BV2细胞NLRP3、Caspase-1、IL-1β、IL-6、IL-18、TNF-α的mRNA相对表达水平比较 模型组细胞炎症介质的表达水平比对照组高,其中除IL-1β外,其余指标差异均有统计学意义(均P<0.05),尤以IL-18和Caspase-1升高最明显。与模型组比较,失笑散组的炎症介质表达水平降低,各指标下降程度不同。失笑散组各浓度比较,组间差异均无统计学意义(均P>0.05)。见图3。
2.4 各组细胞炎症介质的表达水平比较 与对照组比较,模型组炎症介质明显升高,差异有统计学意义(P<0.05、P<0.05、P<0.001、P<0.001)。与模型组比较,失笑散组炎症介质水平下降,但其中IL-1β、IL-18下降幅度较小(P<0.05、P<0.001),而IL-6、TNF-α明显减少(P<0.05、P<0.001),但失笑散组各浓度降低炎症介质的差异无统计学意义(均P>0.05)。见图4。
3 讨论
目前,脑卒中是全世界死亡和长期残疾的主要原因。脑缺血组织再灌注时氧气的重新注入将会触发氧化应激,引发灌注损伤级联反应,最终导致细胞和组织的损伤和死亡[9]。CIRI诱导脑组织炎症显著增加[10]。尽管其中的机制尚不明确,但是脑缺血能够打破促炎和抗炎应答的平衡。脑卒中临床前研究表明,抑制炎症反应可以减少脑损伤,改善神经功能。
小胶质细胞是中枢神经系统的主要免疫巨噬样细胞。脑缺血后,小胶质细胞被激活产生炎症介质导致细胞破坏和死亡[11]。脑卒中发作时(<24 h)TNF-α和IL-6升高,血清中IL-6的水平与脑卒中的严重程度及不良反应正相关[12]。本研究发现,与对照组比较,模型组中的IL-6和TNF-α均升高。OGD/R处理后,BV2细胞IL-6和TNF-α升高,与本研究结果一致。研究进一步发现化浊解毒活血通络方降低CIRI模型IL-6和TNF-α的表达水平,从而降低脑缺血再灌注损伤的程度[13]。血栓通能够显著抑制OGD/R BV2细胞TNF-α、IL-1β和IL-6的分泌[14]。有研究发现,OGD/R可以显著减少BV2细胞的活力和释放IL-1β、IL-6和TNF-α等炎症介质,使脑组织受到损害,而中药单体银杏内酯可以增加OGD/R BV2细胞的活力,银杏内酯和白果内酯可以减少OGD/R BV2细胞IL-6和TNF-α等炎症介质的水平[15]。我们前期研究发现,川芎嗪(Tetramethylpyrazine)能显著降低脑缺血再灌注损伤TNF-α、IL-1β和IL-6 mRNA的表达水平,减轻炎症反应[16]。前期的研究基础,给我们提供了中医药通过抗炎治疗CIRI的思路。本研究通过OGD/R模型诱导BV2细胞产生炎症介质,用失笑散进行干预,观察其保护作用及抗炎机制。
NLRP3炎性小体调节脑卒中发展过程的炎症应答,炎症水平的调节在脑卒中的防治中可能起着至关重要的作用[17]。NLRP3炎性小体是目前最具特征的炎症体,由NLRP3、凋亡相关斑点样蛋白(Apoptosis-associated Speck-like Protein Containing a CARD,ASC)和Caspase-1前体(procaspase-1)组成,NLRP3炎性小体可以激活procaspase-1裂解成p20和p10亚基,形成活性Caspase-1,进而导致IL-1β和IL-18的成熟和分泌[18]。有研究发现,NLRP3炎性小体通过自分泌/旁分泌模式参与神经血管损伤,降低NLRP3炎性小体表达可改善小鼠CIRI损伤[19]。本研究发现模型组中的NLRP3表达水平高于对照组,约为对照组的2.5倍。由此可见,NLRP3炎性小体与CIRI的病理过程关系密切,抑制或者减少NLRP3炎性小体的激活有望成为治疗CIRI的新方法。有研究发现脑心通抑制NLRP3炎性小體的激活,降低Caspase-1的活化体的产生,减少炎症介质的表达,减轻脑卒中后炎症的损伤[20]。有研究报道中药单体汉防己甲素保护BV2细胞在OGD/R处理后造成的损伤,下调NLRP3、IL-1β和IL-18的水平[21]。本研究失笑散是通过调控NLRP3炎性小体减轻OGD/R BV2细胞炎症介质表达。
失笑散为中医经典名方,具有活血祛瘀、散结止痛的作用,临床常用于治疗瘀血停滞证。祝光礼等[22]发现失笑散可以降低血清及细胞上清液中肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白Ⅰ水平,表明其有良好的抗心肌缺血作用。有研究报道失笑散治疗反流性食管炎能够改善食管黏膜炎症[23]。以上研究证实失笑散具有抗心肌缺血、抗炎止痛等功效。目前,尚未见失笑散治疗脑卒中的研究报道。本研究使用失笑散预处理BV2细胞2 h,发现其能减少OGD/R BV2细胞的凋亡,说明失笑散能保护OGD/R造成的BV2细胞损伤。本研究发现,失笑散降低OGD/R BV2细胞模型中TNF-α、IL-6炎症介质的mRNA及蛋白的表达。同时发现,经过失笑散处理过后BV2细胞中NLRP3、Caspase-1及其介导的炎症介质IL-1β、IL-18 mRNA及蛋白的表达也下降。这些体外实验结果提示失笑散可降低脑缺血再灌注引起的小胶质细胞的损伤及炎症介质的表达。未来将构建大鼠脑缺血再灌注损伤模型,从体内实验进一步证实失笑散的保护作用。
综上所述,本研究结果提示失笑散降低OGD/R BV2细胞的损伤,其机制可能与调控NLRP3炎性小体及其介导的炎症介质IL-1β、IL-18的表达有关。本研究为失笑散的临床应用和CIRI机制进一步提供了理论依据。
参考文献
[1]Toman NG,Grande AW,Low WC.Neural Repair in Stroke[J].Cell Transplant,2019,28(9-10):1123-1126.
[2]Wang W,Jiang B,Sun H,et al.Prevalence,Incidence,and Mortality of Stroke in China:Results from a Nationwide Population-Based Survey of 480 687 Adults[J].Circulation,2017,135(8):759-771.
[3]Khoshnam SE,Winlow W,Farzaneh M,et al.Pathogenic mechanisms following ischemic stroke[J].Neurol Sci,2017,38(7):1167-1186.
[4]Wu R,Li X,Xu P,et al.TREM2 protects against cerebral ischemia/reperfusion injury[J].Mol Brain,2017,10(1):20.
[5]Bu J,Shi S,Wang HQ,et al.Acacetin protects against cerebral ischemia-reperfusion injury via the NLRP3 signaling pathway[J].Neural Regen Res,2019,14(4):605-612.
[6]李薇,朱晓晨,朱贺,等.灯盏生脉胶囊用于缺血性脑卒中二级预防的成本效用分析[J].中国新药杂志,2021,30(5):474-480.
[7]曹志然,王蓓,申文增,等.加味失笑散对家兔心肌缺血再灌注损伤保护作用机制的研究[J].时珍国医国药,2009,20(12):3084-3085.
[8]魏丽萍,方晓江,刘昭,等.黄芪失笑散对介入术后ACS患者血管内皮功能及炎症因子的影响研究[J].浙江中医药大学学报,2019,43(3):245-248.
[9]Ryou MG,Mallet RT.An In Vitro Oxygen-Glucose Deprivation Model for Studying Ischemia-Reperfusion Injury of Neuronal Cells[J].Methods Mol Biol,2018,1717:229-235.
[10]Zuo G,Zhang D,Mu R,et al.Resolvin D2 protects against cerebral ischemia/reperfusion injury in rats[J].Mol Brain,2018,11(1):9.
[11]Jin R,Liu L,Zhang S,et al.Role of inflammation and its mediators in acute ischemic stroke[J].J Cardiovasc Transl Res,2013,6(5):834-851.
[12]Anrather J,Iadecola C.Inflammation and Stroke:An Overview[J].Neurotherapeutics,2016,13(4):661-670.
[13]刘磊,张静文,张新玥.牡荆苷调控Nrf2/ARE通路减轻急性脑缺血再灌注大鼠氧化应激反应研究[J].中草药,2020,51(5):1287-1293.
[14]洪倩,王实,陈昌秀,等.血塞通注射液对体外OGD/R损伤的BV2细胞炎症反应的影响[J].中国中药杂志,2017,42(1):140-145.
[15]Zhou JM,Gu SS,Mei WH,et al.Ginkgolides and bilobalide protect BV2 microglia cells against OGD/reoxygenation injury by inhibiting TLR2/4 signaling pathways[J].Cell Stress Chaperones,2016,21(6):1037-1053.
[16]李鹏飞,沈梅红,吴锦萍,等.川芎嗪抑制大鼠脑缺血再灌注损伤的机制[J].中国老年学杂志,2017,37(7):1561-1565.
[17]Tong Y,Ding ZH,Zhan FX,et al.The NLRP3 inflammasome and stroke[J].Int J Clin Exp Med,2015,8(4):4787-4794.
[18]Qiu Z,Lei S,Zhao B,et al.NLRP3 Inflammasome Activation-Mediated Pyroptosis Aggravates Myocardial Ischemia/Reperfusion Injury in Diabetic Rats[J].Oxid Med Cell Longev,2017,2017:9743280.
[19]Yang F,Wang Z,Wei X,et al.NLRP3 deficiency ameliorates neurovascular damage in experimental ischemic stroke[J].J Cereb Blood Flow Metab,2014,34(4):660-667.
[20]王棟,苏晓慧,戚明珠,等.脑心通调控NLRP3/Caspase-1通路抑制脂多糖诱导的BV2细胞焦亡[J].中国实验方剂学杂志,2020,26(10):29-34.
[21]吴飞飞,郭明.汉防己甲素对缺氧缺糖损伤BV2细胞炎症反应的影响[J].中国临床药理学杂志,2020,36(10):1350-1352.
[22]祝光礼,周凡,陈铁龙.黄芪失笑散抗心肌缺血的实验研究[J].中华中医药学刊,2007,25(11):2232-2234.
[23]张彦,靳锦,张林.失笑散加味治疗反流性食管炎67例[J].中国实验方剂学杂志,2013,19(16):328-330.
(2020-12-22收稿 责任编辑:杨觉雄)
