植物光合碳在不同器官-土壤系统的动态分布特征13C示踪
2021-01-12徐永艳
孟 猛, 徐永艳
(西南林业大学, 昆明 650224)
土壤有机碳是陆地生态系统最大的碳库,微小的波动就能影响着全球碳平衡与循环,进而影响整个生态系统的可持续发展[1-4]。对于陆地及大气碳循环而言,光合作用起着关键的驱动效应,光合效应产生的碳能够被输送至植被多个部位,并通过根系传输至地下植株部分,进而通过根系分泌物传输至土壤,而在微生物分解等作用下,碳素能够通过二氧化碳等形式再次进入大气,或者被固定在土壤之中[5]。基于研究分析技术的限制,对于农作物碳平衡方面的研究主要侧重于土壤呼吸的制约因素方面,但在园林植被研究方面较为缺乏。
从碳同位素的角度来讲,对于13C而言,其不仅不需要安全防护,且具有较强的稳定性,常作为示踪物加以运用[6-7]。对于稳定碳同位素分析技术,已经在很多领域得以广泛应用,常用的标记法有连续及脉冲标记两种,后者操作相对便捷,能够在较低的成本下开展碳分配信息追踪,虽然对于一次脉冲标记而言,其无法充分体现植被生长期的多个阶段碳素信息,但是通过一系列标记能够充分测算碳分配[8-9]。为了探究光合作用下碳的固定及转移,常常借助于稳定同位素示踪技术加以研究,这种方法不仅安全稳定,还操作便捷,在实践研究中得以广泛运用[10-13]。国内用13C脉冲法研究植物光合碳的分配主要集中在玉米、水稻和小麦等作物,但关于园林植物光合碳的分配鲜有研究[10-13]。园林植物是城市的净化器,对土壤有机碳的输入和输出、碳循环产生影响。研究园林植物光合碳的分配问题对城市碳平衡具有重要意义。本研究利用13C脉冲标记法示踪园林植物光合碳在不透园林植物—土壤系统中的分配和去向,为科学评价园林植物草光合碳的分配提供参考,为研究园林植物对城市碳源与汇的影响提供依据。
1 材料与方法
1.1 试验设计
选取昆明市樟树、夹竹桃、广玉兰、女贞作为研究对象,借助于盆栽试验加以探究,要求种植盆直径及高度均为20 cm,并分别将5 kg风干土进行过筛处理,要求达到10 mm,同时将基肥混入其中,主要是尿素及氯化钾。各研究对象分别取幼苗10株,借助于脉冲标记法进行定期观测。
1.2 脉冲标记
为了降低试验误差,针对各研究植被3个有标记的支柱分别进行重复试验,同时为了尽可能地避免污染,试验过程中通过间隔行的设置加以避免。标记之前分别设置了柱状的标室,在内壁上涂雾化剂,要求其内高、内径分别达到0.4,1 m,并将其置于五cm深的土壤,为避免根系进入,在其周边借助于尼龙网眼孔覆盖,这能够保障植被和外界正常的水分及养分交换。标记时间开始于2015年8月1日,从上午11:00开始,首先在高压瓶中置入高纯度13C的CO2,并将之与标计室通过管子连接,然后置入10 L13CO2,这样标记室气体量上升至3.18%,在顶膜密封后标记,40 min后停止,之后进行长达五小时的密封。得益于内置风扇,其中的气体流通并不受阻,待其中的二氧化碳含量很低的情况下,可以移走标计室。连续4 a重复试验。
1.3 样品采集与制备
在进行标记的第一天,通过随机取样的方式挖出含有根系的植株各15株,然后进行编号,并置于实验室,待其清洗干净后进行长达四十八小时的烘干处理,要求温度达到70℃,称重后进行生物量测量。接下来进行粉碎处理,并对其δ13C和C加以测量。过2 mm筛后再次进行测定,为了降低试验误差,进行连续三次试验重复。而为了测定地下生物量,本研究借助于土钻取样。
1.4 样品测定与分析方法
为了对样品进行分析,取20 g土壤,并将之置于白色平板,首先将其中的杂质进行清理,接下来将其置于去离子水容器中,要求容量达到100 ml,然后进行长达30 min的振荡处理,这样能够促进有机碳的溶解。其次,取出清液后置于烧杯,这样能够保存可溶性有机碳,避免在进行HCl冲洗过程中发生水溶性有机碳流失;然后在其中加入HCl溶液,要求其pH低于3,这样能够有效地将可溶性碳酸盐予以去除;接下来置入50 ml HCl溶液,从而清除碳酸盐,并进行长达两天的处理,然后将不含碳酸盐的土壤进行冲洗,待其达到中性状态时停止处理,接下来需要将烧杯中的清液置于其中,并进行烘干处理,要求温度达到六十度,进行研磨后进行过筛处理,以便于后续开展指标测定。
为了开展相应的指标测定,本研究借助于元素分析仪,同时利用同位素比率质谱分析仪,这种EA-IRMS设备具有较稳定的测量效果,且便于操作。对于收集到的样品,借助于元素分析仪首先进行高温燃烧处理,这样能够产生一定量的二氧化碳,然后借助于质谱仪开展其中的13C与12C比率监测,并将之与标准物PDB开展相应的比较分析,进而计算初相应的δ13C比率值;要求测定精度在0.1‰。在不考虑呼吸损失的情况下,通过光合作用进行碳固定后,一定量的13C不仅进入根、茎叶,同时还会不断转移至土壤,对于不同组分的固定13C量计算如下:
13Ci=(F1-F2)/100
13Ci分配比例=13Ci/13C×100
式中:标记组及非标记组的13C丰度分别用F1,F2表示,而Ci代表的是碳含量。
采用Excel 2013和SPSS 21.00进行数据统计和分析。
2 结果与分析
2.1 叶13C丰度
由图1可知,广玉兰、女贞、樟树、夹竹桃叶片碳含量有明显的差异,其中叶片碳含量具体表现为樟树>夹竹桃>广玉兰>女贞,其中樟树显著高于其他植物(p<0.05),广玉兰和夹竹桃差异不显著(p>0.05),女贞最低(p<0.05)。不同园林植物叶片13C含量有明显的差异,其中叶片13C含量具体表现为女贞>广玉兰>夹竹桃>樟树,其中女贞显著高于其他植物(p<0.05),广玉兰和夹竹桃差异不显著(p>0.05),樟树最低(p<0.05)。

图1 叶13C丰度
2.2 茎13C丰度
由图2可知,广玉兰、女贞、樟树、夹竹桃茎碳含量有明显的差异,其中茎碳含量具体表现为樟树>夹竹桃>广玉兰>女贞,其中不同园林植物茎碳含量差异均显著(p<0.05)。不同园林植物茎13C含量有明显的差异,其中茎13C含量具体表现为女贞>广玉兰>夹竹桃>樟树,其中女贞和广玉兰显著高于其他植物(p<0.05),樟树和夹竹桃差异不显著(p>0.05)。

图2 茎13C丰度
2.3 根13C丰度
由图3可知,广玉兰、女贞、樟树、夹竹桃根碳含量有明显的差异,其中根碳含量具体表现为樟树>夹竹桃>广玉兰>女贞,其中樟树显著高于其他植物(p<0.05),广玉兰和夹竹桃差异不显著(p>0.05),女贞最低(p<0.05)。不同园林植物根13C含量有明显的差异,其中根13C含量具体表现为女贞>广玉兰>樟树>夹竹桃,其中女贞和广玉兰显著高于其他植物(p<0.05),女贞和广玉兰差异不显著(p>0.05)。
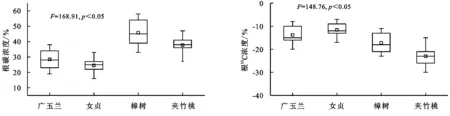
图3 根13C丰度
2.4 土壤有机碳含量和δ13C丰度
由图4可知,广玉兰、女贞、樟树、夹竹桃土壤有机碳含量有明显的差异,其中土壤有机碳含量具体表现为樟树>夹竹桃>广玉兰>女贞,其中樟树和夹竹桃显著高于其他植物(p<0.05),广玉兰和女贞差异不显著(p>0.05)。不同园林植物土壤13C含量有明显的差异,其中土壤13C含量具体表现为女贞>广玉兰>樟树>夹竹桃,其中不同园林植物差异均不显著(p>0.05)。

图4 土壤有机碳含量和δ13C丰度
2.5 输入到地下各组分的碳量
为进一步分析草地—土壤系统中新固定的13C动态变化及分配情况(表1,2),本研究以单位面积计算不同园林植物—土壤系统各组分固定13C数量(13C mg/m2)及其分配比例。标记当天,广玉兰和女贞叶片固定13C数量最高(85.56,83.32 mg/m2),夹竹桃最低(62.01 mg/m2);不同园林植物茎固定13C数量变化范围在32.78~48.21 mg/m2,广玉兰和女贞最高;不同园林植物根固定13C数量变化范围在13.02~28.15 mg/m2,广玉兰和女贞最高;不同园林植物土壤固定13C数量变化范围在5.32~12.45 mg/m2,广玉兰和女贞最高;标记21 d以后,不同园林植物茎、叶、根和土壤固定13C数量与初始值呈一致的变化规律。
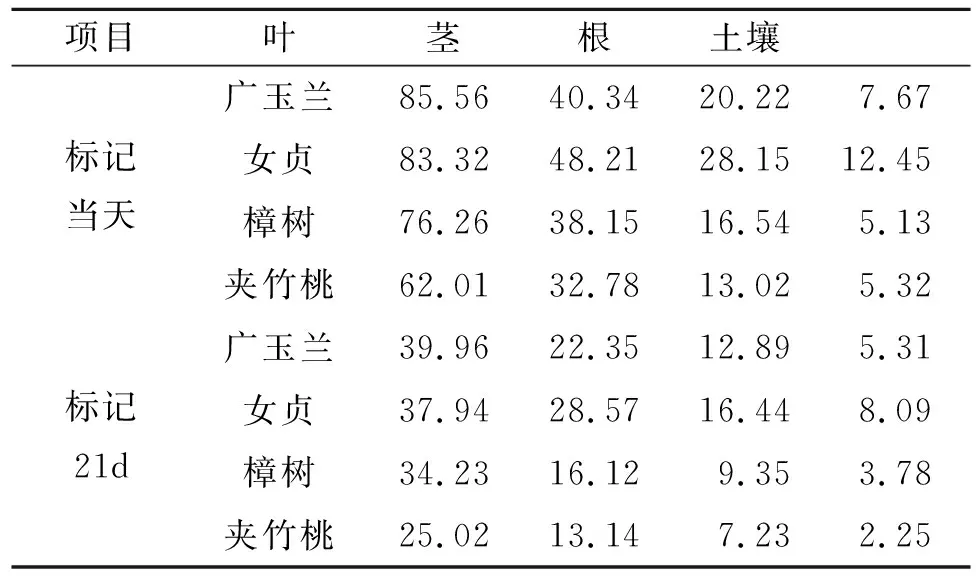
表1 不同退化阶段草地—土壤系统各组分13C含量动态变化 mg/m2
由表2可知,标记当天,不同园林植物—土壤系统光合同化13C主要集中分配在茎叶中,其次是根中、土中;标记21 d,不同园林植物—土壤系统光合同化13C主要集中分配在根中,其次为茎叶和土中,其次是根和土壤中。
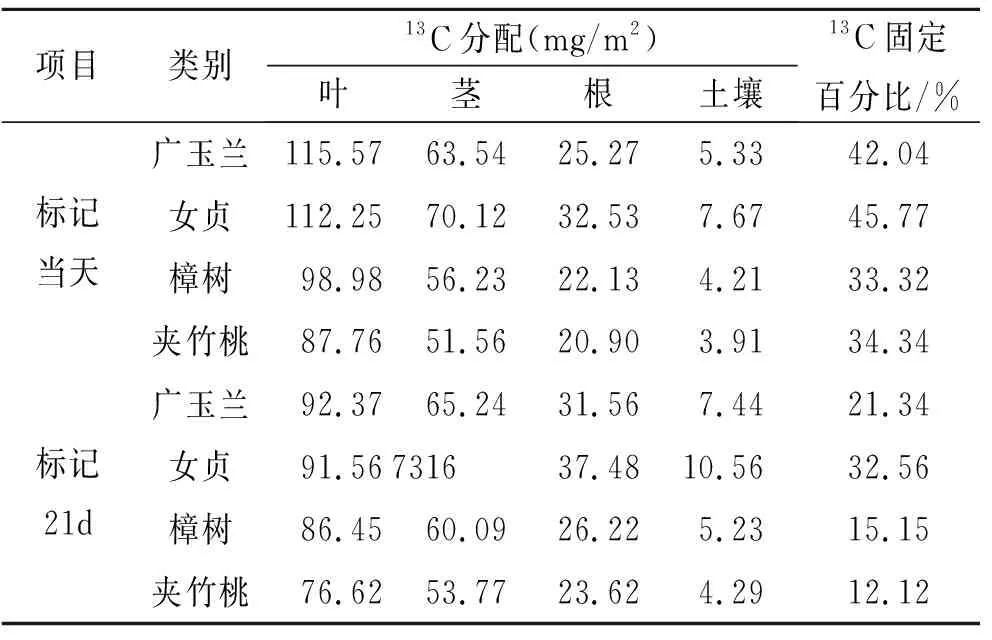
表2 标记后不同退化阶段草地—土壤系统各组分13C的分配
2.6 不同植物光合碳对土壤有机碳的贡献
标记结束后,不同园林植物对土壤有机碳的贡献量和累积量见图5。樟树对土壤有机碳的贡献量最大,对土壤有机碳的贡献量依次表现为樟树>女贞>夹竹桃>广玉兰;净固定碳的累积输入量由整个时期的贡献量的累加得到,由图5可知,有机碳的累积量呈相反的变化趋势。

图5 不同植物光合碳对土壤有机碳的贡献
2.7 13C-SOC的影响因素
相关性分析表明(表3),土壤养分显著影响了光合同化碳在地上部和土壤中的分布,其中,茎叶13C含量与有机碳、全氮、碱解氮和速效磷含量呈显著的正相关(p<0.05);根13C含量与有机碳、全氮、碱解氮和速效磷含量呈显著的正相关(p<0.05);土壤13C含量与有机碳、全氮呈极显著的正相关(p<0.01),与碱解氮和速效磷含量呈显著的正相关(p<0.05)。

表3 13C-SOC的影响因素
3 讨 论
通过本研究分析得知,植株地上部分能够有效保留通过光合固定的大部分13C,主要原因在于对于植被根系而言,其具有较强的碳库活力,对于碳素的转运更为频繁,能够有效地向叶片输送碳素。对于不同的植被而言,其地下部对于合碳的分配具有较大差异,对于农作物来讲,随着不断的生长发育,碳素逐渐向地上部进行转移分配,不仅玉米如此,大麦及水稻亦是如此;对于牧草而言,则并没有体现这样的碳素转移规律[14-15],主要原因在于经过长期进化选择,农作物具有更高的地上收获指数,使得碳素更多地向植株地上部分转移,地下部呈现更低比例的光合碳。对于园林植被来讲,其具有明显的营养生长期长的特点,即使是在收获以后,其地下根系的生长发育依然不受阻,而对于农作物来说刚好相反,其收获后地下根系逐渐死亡,从而导致作物地下部光合碳含量明显较低[16]。对于根系生长发育而言,其需要必要的养分及水分来维持,这就形成了一个能量消耗的作用机理,就地下光合碳投入而言,园林植被明显较低。对于樟树和夹竹桃来讲,其具有较大的叶面积指数,能够产生较高的光合有效辐射,受此影响,植被的光合碳固定能力得以明显提升,从而形成了植被较低水平的自养呼吸水平,对于植被碳积累起着积极作用[17-18]。整体来讲,对于樟树和夹竹桃而言,不仅其叶片氮浓度呈现较低水平,其光合作用效果依然较低,为了促进其碳平衡,需要进行长时间的光合作用。
对于稳定碳同位素分析技术,已经在很多领域得以广泛应用,与14C标记法相比而言,13C标记法不仅无放射性,呈现较高的安全性,同时能够进行均匀标记,具有更多的有点[19]。在稳定碳同位素测定技术不断提升的情况下,借助于该研究分析技术能够有效地对植被不同生长期的光合作用产物加以分析,尤其是其去向问题,无论是植被秸秆及残茬,还是根系的动态分解,以及有机碳的分配状况,都能够加以有效分析[20-21]。借助于该标记法,不仅能够进行连续标记,同时能够进行脉冲标记,本研究采取后者标记法加以研究,从而对于植被的不同生长期器官加以标记,对不同植被加以标记。通过连续四次的标记,虽然园林植被不同,但是其叶、茎、根及土壤的13C呈现出较高水平,这说明借助于该研究方法能够获取较为充足的13C材料。通过对比分析得知,不同植被具有不同含量的13C丰度,但是其不同器官的13C丰度变化规律基本一致,其茎体现出最高水平,其次是叶,而土壤中含量最低,这与以往学者的研究基本一致[22],这也说明光合碳能够快速高效地在土壤及植被之间进行有效转移分配。
借助于脉冲标记,植被通过光合作用获得并储存13C,之后再进行地上及地下部分的转移分配,通过研究得知,经过长达21 d的标记之后,地下部的13C含量占比最低达到了11.6%,而最高达到了51.3%。有学者通过该标记方法探究了牧草的碳分配状况,其30%~50%的同化碳素被转移地下部分[23];也有学者研究得知,进行连续27 d的标记之后,光合碳的转移比例区间为20%~40%;根系的生长也离不开必要的碳素,光合碳的转移主要为满足根系生长所需,这种对13C的消耗更多的以根际沉积物的形式进行,此外,无论是植被根系呼吸,还是植被静夜呼吸,都会释放一定量的13C;随着植被的不断生长,生物量呈现不断上升态势,随着13C的同化出现,草地通过光合效应固定的13C被逐渐分解[22]。无论是植被的不同以及管理方式的差异,还是物候期、示踪期长短,都能够对13C施加着不同程度的制约,本研究在长达二十一天的标记处理之后进行再次采样,通过分析得知,对于土壤及植被根、茎叶而言,其碳含量水平呈现较大的差异,且占比较高,主要原因在于在根际分泌物作用下,根际沉积物现象较为突出,从而影响了土壤的理化特点,加速了土壤有机质转化,导致不同程度的碳含量[23-24]。
对于标记当天而言,土壤中光合碳的含量相对较高,这说明土壤对于碳的固定效率较高,且含量较高,经过长达二十一天的标记之后,对于13C固定能力最强的时候是MD,主要原因在于对于樟树及夹竹桃而言,其正处于根深叶茂的长势旺盛期,能够产生更强的光合效应,从而形成更高含量的光合碳,并经过茎叶逐渐向根系传输,根系以分泌物的形式传输至土壤,从而形成了植被与土壤之间的碳转移分配[25]。通过分析得知,5%~27%的碳被转移至土壤之中,从而使得土壤碳含量得以提升,这与地下生物量息息相关,同时受制于地下碳传输水平。在根系作用下,通过光合作用固定的13C经过根系沉积物的形式传输至土壤,在微生物分解利用下,形成了一定的固定及分配,这也是下一步细化研究的重点研究方向之一。
