19882016年洞庭湖大型底栖动物群落变化及驱动因素分析*
2021-01-12王丑明黄代中高吉权刘云志陶世新孟星亮
王丑明,张 屹,田 琪,黄代中,高吉权,刘云志,龚 正,陶世新,孟星亮
(1:湖南省洞庭湖生态环境监测中心,岳阳 414000) (2:中国科学院水生生物研究所,武汉 430072)
洞庭湖是我国第二大淡水湖泊,也是仅有的两个大型通江湖泊之一,是长江中下游重要的调洪蓄水湖泊和水源地之一,也是近千万湖区人民赖以生存发展的重要基础. 洞庭湖不仅在维护长江中下游防洪和供水安全方面具有重要意义,而且在维系湿地水生态系统健康,保护湿地水生生物多样性等方面发挥着举足轻重的作用[1]. 同时,洞庭湖在长江经济带建设、促进区域经济健康发展等方面占有十分重要的地位[2]. 近半个世纪以来受气候变化、江湖关系变化(如三峡大坝蓄水)、环境污染和商业采砂等因素的影响,洞庭湖水体萎缩和生态功能退化等生态环境问题突显,严重制约了湖区经济和社会的长期可持续发展和生态文明建设[3-5].
大型底栖动物在水生态系统中发挥着重要作用,它们通过“生物扰动”改善底流区物化环境,促进湖泊生态系统的物质循环和能量流动[6]. 此外,底栖动物具备移动能力弱、生命周期长等特点,使得其成为评估水生态系统健康的重要指示生物[6]. 近年来,许多生态学者利用底栖动物阶段性地评价了湖区水生态健康状况[7-10],为洞庭湖生态环境治理和监测做出了积极的贡献. 然而,已有研究大多关注底栖动物物种群落的多寡和自然结构的变动对湖区水生态环境恶化的响应,缺乏对底栖动物群落功能层面的研究. 此外,这些研究所选用的物种多样性参数(如Shannon和Simpson)难以全面反映人类干扰活动对底栖动物群落功能多样性的影响[11]. 由于洞庭湖的江湖连通性(如快速的水体交换和复杂的水文变动),致使生态学者和环境管理者难以在较短的时间和空间范围上侦测到群落功能的变动[12]. 因而,片断化的历史研究,如主要集中在个别年份和某一湖区开展生态学及分类学的相关研究[5,7-10],影响了对洞庭湖水生态系健康的科学评估和调控方案的制定.
鉴于此,本研究汇总了湖南省洞庭湖生态环境监测中心所调查的1988-2016年近30 a来的底栖动物群落及水质状况历史数据,以期在较长时间及较大空间尺度上评估水环境恶化对底栖动物功能多样性及群落功能的影响. 本研究的目的有:1)分析近30 a来洞庭湖整体水环境的变动状况;2)探寻水体环境变动对底栖动物功能多样性和群落功能结构的影响;3)探寻影响底栖动物功能多样性及功能群落结构变化的关键环境因子,以期为未来洞庭湖水生态健康调控和监测方案的制定提供科学支撑.
1 材料与方法
1.1 研究区域
洞庭湖(28°30′~30°23′N,111°14′~113°10′E)位于长江中游荆江南岸,湖南省北部,湖体呈近似“J”字形 (图1). 洞庭湖主要由东洞庭湖、南洞庭湖和西洞庭湖构成,天然湖泊面积2691 km2(城陵矶水位33.5 m),蓄水量167亿m3. 洞庭湖与长江连通,是长江最大的过水性调蓄湖泊. 湖区径流主要由三口、四水及区间径流组成,集水面积25.7×104km2,补给系数105.7. 其西北有长江三口(松滋、太平、藕池)分泄长江枝城至城陵矶江段的水量,东南、西南有四水(湘、资、沅、澧) 及汨罗江等小支流注入,最后由东北城陵矶一口注入长江[1]. 洞庭湖区隶属于中亚热带过渡性季风温湿气候,年均气温16.6~17.0℃. 洞庭湖每年有两个汛期,水位于4月份开始上涨,7-8月最高,11月至次年3月进入枯水期,多年最大城陵矶水位变幅达18.77 m[4]. 洞庭湖区独特的地理位置和气候特征,孕育了多样化的生境和生物多样性. 据相关文献调查,该湖区历史曾记录鸟类16目41科158种、鱼类12目23科114种、浮游植物7门50属82种及浮游动物6属115种[13]. 该湖区丰富的生物多样性和复杂的生境条件,造就了我国最大的淡水湖泊湿地生态系统[13].
然而,从1980s起对洞庭湖湖区资源的过渡开发与利用,致使该湖区水生态健康状况日益恶化. 鉴于此,洞庭湖生态环境监测中心于1988-2016年对洞庭湖区开展了近30 a的野外跟踪调查[4]. 依据洞庭湖水系特征、各个湖区面积大小、水文动态以及地理位置等特征,本研究共布设8个调查位点,包括南嘴、坡头、目平湖、万子湖、横龄湖、虞公庙、鹿角镇和东洞庭湖(图1). 从1988年秋至2016年冬(历史原因2002年未调查),分季度对所设样点的水质和生物样本进行了相关调查.
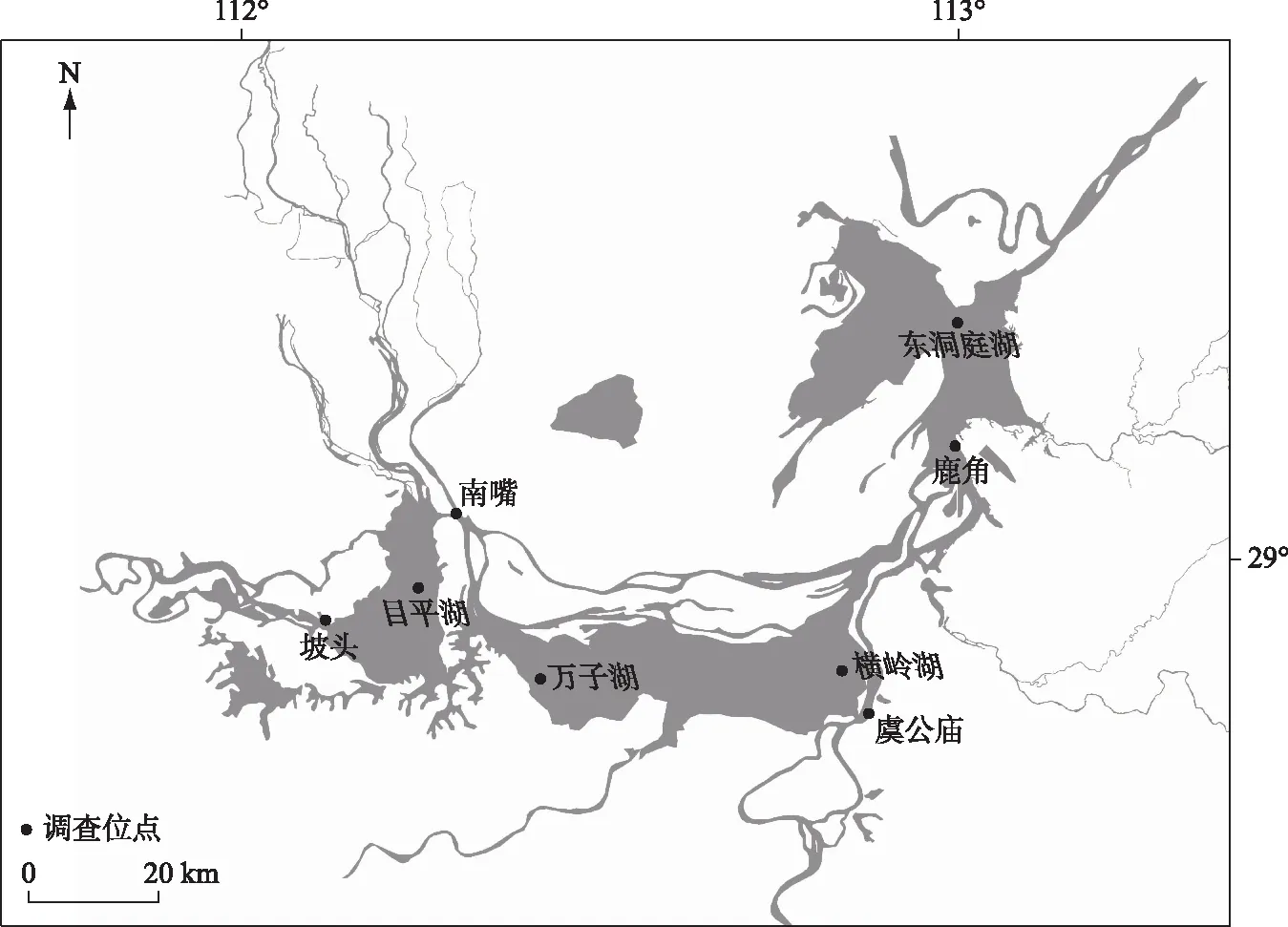
图1 洞庭湖样点空间布局Fig.1 Spatial location of sampling sites in Lake Dongting
1.2 采样方法
底栖动物样本主要采用1/16 m2的改良彼得森(Peterson)采泥器完成. 每个样点采集2个重复样品,带有动物标本的泥样经40目铜筛筛洗后,置入封口袋内保存. 当天带入室内,将筛洗后的泥样放入白瓷解剖盘中在冷光灯下分拣. 随后,将挑出的动物样品放入50 mL样品瓶,并使用10%的福尔马林溶液固定保存. 之后,在室验室内对固定动物样品进行种类鉴定和计数. 标本鉴定主要参考相关文献,鉴定至属级分类单元[14-18].
使用手持型GPS确定每个位点的经纬度坐标,在采集动物标本的同时,使用温度计和塞氏盘(Secchi disk)分别对水温和透明度进行测量. 此外,使用采水器采集表层水样(0.5 m),置入500 mL塑料样品瓶,当天带回附近实验室内,依据国家《地表水环境质量标准》(GB 3838-2002)对水体的总氮(TN)、总磷(TP)、氨氮(NH3-N)、叶绿素a(Chl.a)、pH、溶解氧(DO)、重铬酸钾指数(CODCr)、五日生化需氧量(BOD5)、铜(Cu)、锌(Zn)、硒(Se)、砷(As)、汞(Hg)、镉(Cd)、六价铬 (Cr6+)、铅(Pb)、氟化物、氰化物、硫化物、挥发酚、表面活性剂和石油类等参数进行测定[18].
1.3 功能性状和功能多样性
本研究共选取29个性状类别,分属6组功能性状(表 1). 这些性状不仅与底栖动物群落的恢复力和抵抗力紧密关联,而且代表了底栖动物的生物学和生态学特征,并在内陆水体功能多样性研究中普遍使用[19-20]. 所选取的6组功能多样性信息主要来源于已发表的书籍和文章等资料,如寡毛类和蛭类分别参考文献[21-22];软体动物主要参考文献[16,23-25];水生昆虫主要参考文献[26-28];甲壳类主要参考文献[29-31]. 此外,若上述资料中未包含所研究物种,则依据物种的分类学特征和实际测量情况确定物种的相关性状.

表1 洞庭湖大型底栖动物功能性状划分
采用模糊编码,依据每个属级分类单元的生物学和生态学信息,将每组功能性状划分为不同的等级(得分),得分从1~5分别代表该性状的强弱(或长短)[32]. 功能性状值通过计算平均每个位点与性状类别有关联的所有物种完成. 随后,采用每个物种的相对丰度对前者所获得的功能性状类别的平均值进行加权,进而获得每个性状类别的群落特征加权平均值:
(1)
式中,Pi为每个位点群落中第i个物种的相对丰度,traiti为第i个物种的功能性状值,n为总物种数[33-34].
使用物种丰富度(TRic)、Shannon多样性指数和Simpson多样性性指数表征底栖动物的物种群落多样性,以功能丰富度(FRic)和劳氏二次熵 Rao’s Q 指数表征其群落功能多样性[35-36]. 其中,物种丰富度为每年每个位点的物种数. Shannon和Simpson多样性指数不仅可以指示群落物种的丰富度,也可以指示物种分布的均匀性[11]. 功能多样性是生物多样性的重要组成部分,通常指特定群落或生态系统中物种功能特征 (性状) 的数值和范围,也叫功能特征多样性. 功能多样性也指群落中物种功能的变化,物种功能是物种为完成自身生命历程所表现出来的功能特征,这些功能特征的类型、变化幅度、稳定性等差异反映了群落的物种功能多样性大小,即他们对群落或生态系统的功能所起的一定作用[35-37]. FRic指数指物种功能性状在群落中所占据的功能空间的大小,某群落的功能丰富度既取决于功能特征值的范围,也取决于物种所占据的功能生态位;Rao’s Q 指数类似于物种多样性的Shannon和Simpson多样性指数,然而其结合了群落物种的密度、性状和群落的相似性 (或相异性) 等信息,有效地反映了群落功能特征的丰富程度和分布的均匀程度[35-37]. 由于这些指数的普适性和易用性,使得其在物种和功能多样性实践中得以很好地应用. TRic、Shannon和Simpson指数计算使用PERMANOVA+ for PRIMER 6.0完成[38]. FRic和Rao’s Q 指数使用FD包在R语言3.3.1版本中完成[39].
1.4 统计分析
根据文献报道的水质污染变动状况以及重大人类活动出现情况(如工业污染、三峡大坝蓄水及商业采砂活动等),将生物和环境数据划分为3个时期1988-1993年、1994-2005年和2006-2016年[1,3,7, 13]. 虽然1988-1993年这一时期仅有5 a的数据,但是相比其他两个时期这一时期水质状况相对较好[1].
由于底栖动物季节间分布的不均衡性,本研究依据年份将每个样点4个季度的物种数据进行平均处理,以便于功能多样性和功能群落结构的构建. 在统计分析之前,对非正态的环境因子(除pH和DO之外)、TRic、Shannon、FRic、Rao’s Q指数和功能群落结构(CWM性状结构)分别进行了开平方根转化,对物种群落(密度数据)进行了lg(x+1)转化. 采用单因素方差分析(one-way ANOVA)检验水质环境参数、TRic、Shannon、Simpson、FRic、Rao’s Q指数及每个功能性状值在3个时间段变动的显著状况. 使用主坐标典范排序分析 (canonical analysis of principal coordinates,CAP) 研究整体水质环境、物种和功能群落时间上的差异. CAP是一种将主成分PCO轴进行典范排序的分析方法. CAP分析的目的是寻找典范排序空间上最佳的PCO 典范轴区分预设分组,或者寻找PCO典范轴与其他类别变量最强典范对应关系的排序方法. CAP不仅可以分析任意两组相似性矩阵之间的典范对应关系,而且可以基于置换方差分析(permutational analysis of variance, PERMANOVA)检验不同相似或相异矩阵之间(n> 2)的显著状况. 在CAP分析之前,先将开平方根转化后的环境数据进行正态化,再分别基于Euclidian、Bray-Curtis和Gower 相似性距离,分别生成环境参数、物种和功能群落的相似性矩阵. 最后,采用CAP分析分别生成对应整体水环境、物种和功能群落的CAP图,并基于999次置换方差分析(999 permutation)检验3个时间段整体水环境、物种和功能群落变动的显著性. 在CAP分析结果中, tr (Q_m′HQ_m, trace statistic) 统计数值tr (Q_m′HQ_m) 和P值类似于方差分析中的F值和P值,tr (Q_m′HQ_m)值越大,P值越小,表明3个时间段整体环境、物种和功能群落结构的变异性越大(越显著). 此外,delta_1^2 (first squared canonical correlation)数值越大,P值同样越小,表明CAP1和CAP2轴分割空间云分布图上样点的效果越清晰(或越显著). 为了探寻物种和功能群落优势种的变动状况,采用相对丰度≥5%确定物种群落的优势种[5]. 为了探寻驱动底栖动物物种和功能群落结构变动的关键环境因子,采用基于距离的冗余模型(distance-based redundancy analysis, dbRDA)模拟了物种和功能群落结构与环境因子之间的关系. 在dbRDA分析之前,环境因子经过Pearson相关分析筛选并剔除相关性系数r> 0.75的因子,避免相关因子的共线性影响dbRDA模型的适合度[38]. 单因素方差分析、CAP和dbRDA检验主要在SPSS13.0、PERMANOVA+ for PRIMER 6.0软件中完成.
2 结果
2.1 理化因子
单因素方差分析表明,3个时期大部分水体环境因子存在显著差异(P<0.05, 表2). 其中,pH、Chl.a、CODCr、BOD5、TN、TP、NH3-N、Cu、Zn、As、Cd、Cr6+、氟化物、氰化物、硫化物、挥发酚和表面活性剂的浓度在时间尺度上呈现明显上升的趋势,而DO、Hg和石油类浓度呈现明显下降的趋势(P<0.05, 表2). 然而,水温、透明度、TP和Pb在时间上差异不显著(P> 0.05, 表2). CAP分析同样显示整体水环境在3个时期存在明显差异(tr (Q_m′HQ_m)=1.637,P=0.001,图2). 上述结果表明,洞庭湖水质呈现日益恶化的状况,主要表现在氮营养盐类、重金属盐类和有机及无机污染物的浓度随年限增长显著富集.
2.2 物种群落结构
本研究共采集底栖动物102个属级分类单元,隶属于6纲16目43科. 其中,水生昆虫占物种数的52%,腹足类占17%,寡毛类占13%,双壳类占12%,蛭类占4%,甲壳占3%. CAP分析结果显示,底栖动物物种群落结构在3个时期存在明显的差异(tr (Q_m′HQ_m)=0.957,P=0.001,图2). 物种群落结构的变化主要表现在敏感水生昆虫(如低头石蚕属1种)和小型甲壳类(如钩虾属1种)的比例日益下降,而寡毛类(如水丝蚓属1种和尾鳃蚓属1种)、小型螺类(环棱螺属1种)和双壳类(蚬属1种)的比例逐渐上升(表3).

表2 洞庭湖3个时期水环境因子的变动*
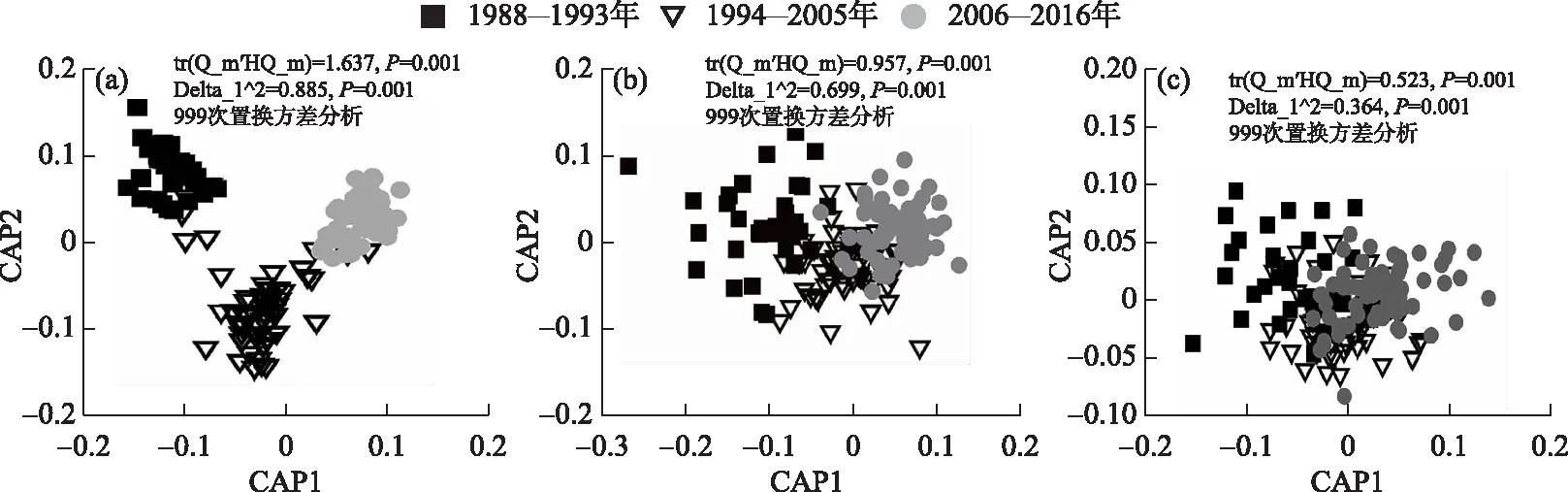
图2 1988-2016年洞庭湖整体环境(a)底栖动物的物种(b)和功能群落结构(c)CAP图Fig.2 The CAP plots of total water environment (a), taxonomic (b) and functional community structure (c) of macrozoobenthos during 1988-2016 in Lake Dongting
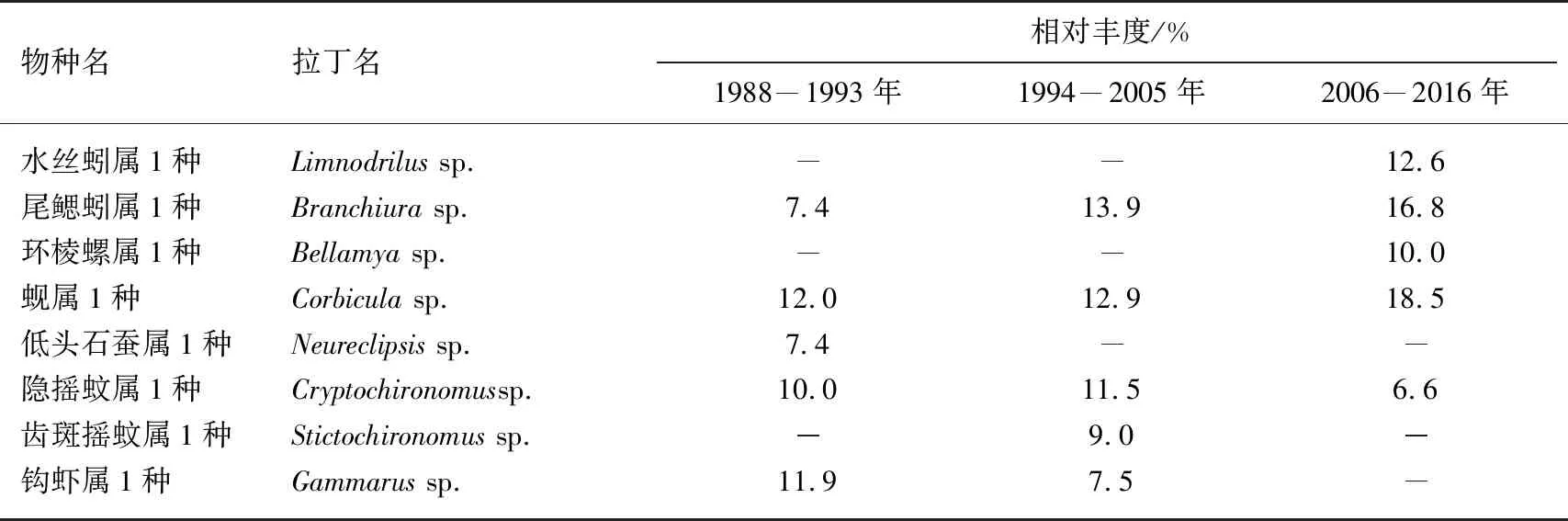
表3 洞庭湖底栖动物优势种的变化
2.3 功能群落结构
CAP分析结果显示,随着时间的增加底栖动物的功能群落结构发生了显著变化(tr (Q_m′HQ_m)=0.523,P=0.001,图2). 单因素方差分析显示,25个性状类别中有14个性状类别值在3个时期之间存在显著差异(P<0.05,表4). 在14个时间上显著差异的性状类别中,体长为1.00~1.99 cm、背扁型、侧扁型、不移动、强移动能力、粘附者、游泳者和杂食者的性状值呈现明显下降的趋势,而体长为3.00~5.99 cm、体长 >6.00 cm、圆锥型、弱移动能力、攀爬者和刮食者的性状值呈现明显上升的趋势(P<0.05,表4). 此外,超过一半的功能性状类别对水质环境变化的响应不敏感(P>0.05,表4).
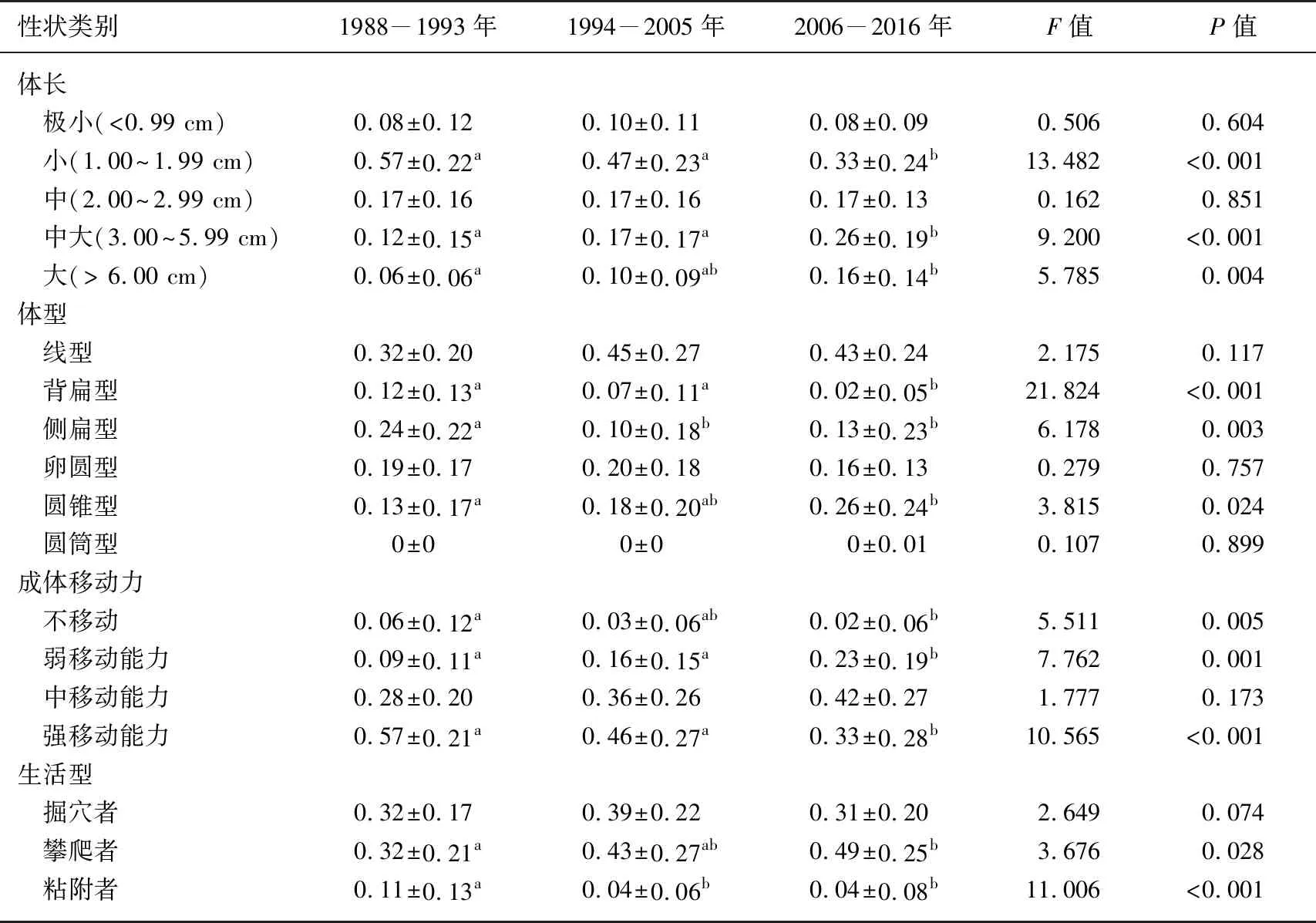
表4 洞庭湖底栖动物群落功能性状加权平均值的时间动态
2.4 物种和功能多样性
洞庭湖底栖动物的密度、物种丰富度、功能丰富度以及Rao’s Q指数在3个时期之间存在显著差异(P<0.05, 图3),而Shannon和Simpson指数3个时期差异不显著(P> 0.05, 图3). 上述结果表明,近30 a来底栖动物的物种和功能多样性呈现明显下降的趋势.

图3 洞庭湖3个时期底栖动物物种和功能多样性的变化Fig.3 Dynamics of taxonomic and functional diversity in the macrozoobenthic community during the past three decades in Lake Dongting
2.5 物种和功能群落与环境因子的关系
dbRDA结果显示,dbRDA1和dbRDA2轴共解释了15.0%的物种群落结构变异和15.7%的功能群落结构变异(图4,表5). 其中,11个关键环境因子共解释了20%(Adj.R2=0.20)的物种群落结构变异,6个关键环境因子共解释了13.0%(Adj.R2=0.13)的功能群落结构变异(表4). 其中,TN、Chl.a、透明度、水温、石油类和硫化物共同驱动着底栖动物物种和功能群落结构变异,解释率(Adj.R2)介于1%~6%之间(表5). 此外,在这些关键环境因子中,TN是影响底栖动物物种和功能群落结构的首要因子,其他关键环境因子虽然也是驱动物种和功能群落的重要因子,但是其重要性在两者之间存在差异(表5).

图4 洞庭湖3个时期物种和功能群落结构的dbRDA分析结果:(a)物种群落结构;(b)功能群落结构Fig.4 Plots of dbRDA:(a) taxonomic structure; (b) functional structure during three periods in Lake Dongting
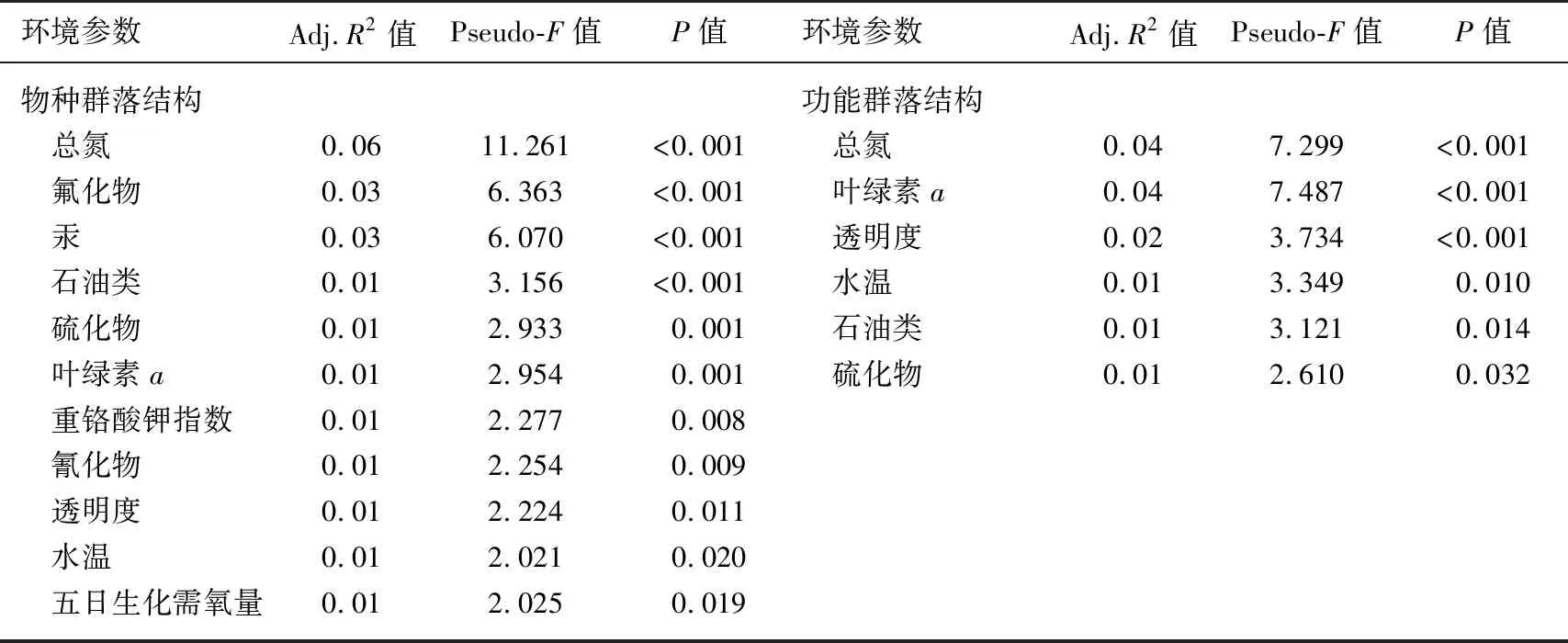
表5 物种和功能群落结构与环境因子的dbRDA分析结果
3 讨论
3.1 洞庭湖底栖动物物种和功能群落变动因素解析
本研究结果显示,近30 a来洞庭湖水质呈现日趋恶化的过程. 湖区内水体污染、三峡大坝修建与商业采砂活动等重大人类活动深刻影响着湖区内水质健康状况[7,40-45]. 大量报道表明,从1990s开始,洞庭湖水体呈现富营养化加剧、重金属盐类和无/有机污染富集的问题[40-45]. 一方面,“四水”和长江三口污染物和氮磷营养物的输入致使洞庭湖表层水污染物浓度的上升[41];另一方面,湖区周边城镇污水、工矿企业废水直接入湖,导致水体污染状况加剧[42]. 三峡大坝修建改变了洞庭湖与长江的江湖关系,影响了2006-2016年水质健康状况. 2003年三峡大坝蓄水改变了洞庭湖水动力与水文循环,引起枯水季水位下泄提前和水域面积缩小,进而引起东洞庭湖区枯水期TN和TP浓度的上升[43]. 万咸涛等研究也发现,三峡大坝截留后黄柏河呈现污染加剧的状况,如TN、TP和有机污染物浓度上升[44]. 从2006年起东洞庭湖区兴起的商业采砂活动同样引起该湖区整体水环境的改变. 采砂活动通过一系列过程(如洗沙、分沙和沙石泄露)降低采砂区的水体透明度,增加采砂区的水深及其周边区域的氮、磷营养盐浓度[46]. 然而,始于1990s的水质环境改变并非单一人类活动所导致,而是多种人类活动相互叠加综合作用的结果. 因而,这些人类活动直接或间接引起的水质环境改变,进一步影响着洞庭湖底栖动物物种和功能群落结构的变动.
对比1988-1993年数据,1994-2016年洞庭湖底栖动物群落呈单一化的趋势. 本研究结果与很多水污染的相关研究相似[4-9],表现在敏感水生昆虫种群的丧失及衰退,以及中度和高度耐污种种群的繁盛. 水体中的污染物通过降低底流区DO浓度(如氮、磷富集引起水华暴发)和化学毒性(如Hg和As)等环境过滤作用[47],引起敏感种(如低头石蛾(Neureclipsissp.)、蜉蝣(Ephemerasp.)和大蜻(Anotogastersp.))的丧失及种群的衰退,进而简化底栖动物的物种群落结构[5,40]. 此外,虽然本研究缺乏三峡大坝蓄水前后的水文动态数据,但已有相关研究表明,由于秋季三峡大坝蓄水造成枯水季洞庭湖水域面积缩小,形成大量裸露滩涂(尤其东洞庭湖区),引起迁移能力弱的底栖动物大量死亡[43]. 此外,采砂活动增加湖床水深,降低水体透明度,改变湖床底质结构及营养状况,进而威胁底栖动物的生存[46]. 水体透明度的降低抑制生产者的光合作用能力,间接影响底栖动物的呼吸和摄食作用效率[7]. 此外,采砂引起的水深和底质结构变化,改变了湖泊沿岸带的物化环境,造成敏感水生昆虫栖息地的丧失,进而引起敏感水生昆虫种群的消亡或缩小[46]. 底栖动物物种群落中这些带有特殊功能性状物种的丧失,进一步体现在底栖动物功能群落结构的改变.
本研究发现3个时期洞庭湖底栖动物功能群落结构呈现明显差异. 功能群落结构的改变主要体现在体长为1.00~1.99 cm、背扁型、侧扁型、不移动、强移动能力、粘附者、游泳者和杂食者功能性状值的下降,以及体长为3.00~5.99 cm、体长> 6.00 cm、圆锥型、弱移动能力、攀爬者和刮食者功能性状值的上升. 本研究结果有别于一些基于空间比较的相关研究[19-20,48-51],这些研究发现底栖动物群落中小个体、强移动能力和短寿命等功能性状数值随着干扰强度逐渐增加. 首先,在本研究中具有这些性状特征的物种主要是低头石蛾、蜉蝣、大蜻和钩虾等敏感物种,它们相较于耐污染的环棱螺和尾鳃蚓等物种的体长(最大体长)偏小,生命周期偏短[21,23,25,31],导致这一结果与先前研究存在差异. 其次,洞庭湖江湖连通的水文特征有别于非通江湖泊(如太湖和滇池),快速的水体交换可以稀释水体中氮、磷和某些有毒污染物(如As和Cr6+),使洞庭湖整体水质保持在中-富营养状态或中度污染状态[3-5]. 这也导致1994-2005年和2006-2016年两个时间段水质的变化并未威胁到中、高耐污优势物种(如河蚬和环棱螺等)的生存,引起这两个阶段底栖动物优势种类不同于高度污染的非通江湖泊(如寡毛类为绝对优势类群)[50],甚至南洞庭湖仍然现存大量的丽蚌(Lamprotulasp.)、蛏蚌(Solenaiasp.)、楔蚌(Cuneopsissp.)等大型软体动物[52]. 此外,在两个时期中度污染的水体中,大个体、长寿命的软体动物和寡毛类相较小个体、短寿命的敏感水生昆虫和小型甲壳类可能具有较强的种间竞争能力,这也造成了本研究与先前研究结果的不同. 本研究还显示,许多功能性状类别对水质变动响应不敏感(如生命周期). 首先,基于功能冗余学说,同一功能类别中丧失物种的功能可以被剩余物种所取代,引起这些性状类别对水质变化不敏感[53]. 其次,具有这些功能性状的广布耐污种类本身就适应中度污染的水体,甚至从敏感种类比例降低中获利[5, 10].
水污染降低底栖动物的物种丰富度、功能丰富度和Rao’s Q 多样性指数. 大量研究表明,水污染是引起内陆水体底栖动物物种和功能多样性丧失的重要原因之一[4,48-49,54]. 本研究与上述研究结果相似,1994-2005年和2006-2016年两个阶段底栖动物的物种丰富度、功能丰富度和Rao’s Q指数呈现显著下降的趋势. 然而,Shannon和Simpson指数对湖区营养物和污染物的响应不敏感. 这是因为:首先,得益于洞庭湖的江湖连通性,较短的水体滞留时间可以缓解水质恶化状况[3]. 其次,连通水体生态系统中物种群落及多样性的维持主要取决于斑块效应(mass effect)[50]. 因为快速的水流可以将周边区域底栖动物的成体或稚体转运至湖区内部,进而迅速弥补由水质恶化所引起的空缺生态位. 最后,湖泊底栖动物物种群落结构有别于其他淡水系统,如寡毛类、摇蚊类和软体动物通常是湖泊生态系统中的优势类群[5,9],而毛翅目、蜉蝣目和襀翅目的水生昆虫通常在溪流生态系统中占据优势[48,54]. 这表明湖泊生态系统中敏感种的比例要远低于耐污种的比例,甚至敏感种的丧失往往被耐污优势种物种数和密度的上升所掩盖. 这也就引起常规物种多样性指数较难监测到污染物的长期累积效应. 相反,基于底栖动物多种功能性状(生物学和生态学)的功能多样性指数对水污染的长期累积效应呈现较强的敏感性.
本研究dbRDA模型所筛选的关键环境因子对底栖动物物种和功能群落结构变异的解释率偏低,仍然有80%~87%的因素并未探明. 首先,除水污染、商业采砂和江湖关系改变影响因素之外,湖区内电力捕鱼和拖螺蚌船只捕捞也是影响底栖动物物种和功能群落变动的主要因素[52]. 其次,随机作用过程和种间相互作用通常在江湖连通水体中对物种和功能群落构建及多样性维持起着非常重要的作用[50]. 虽然,这些关键作用对底栖动物物种和功能群落的构建起着十分重要的作用,但是在野外调查实验中很难量化这些关键作用的影响. 同时由于历史原因,本研究点位较少,代表性不足,因此在未来的监测中适当增加样点数,从而更好地代表洞庭湖底栖动物的状况.
3.2 洞庭湖水质监测评估建议
洞庭湖水生态状况近30 a正经历着不断退化的过程,这一过程不仅受全球气候变暖自然因素的影响,而且受多种人类活动干扰的影响[1]. 因而,建立有效的生物评价方法对科学评估洞庭湖水生态健康状况具有十分重要的意义. 本研究结果显示,洞庭湖整体水质环境在30 a间经历着从1988-1993年的轻度污染向1994-2016年的中度-重度污染转变的过程. 虽然该湖泊的江湖连通性可以在一定程度上减缓水质恶化的进程,但若不采取有效的措施,部分湖区缓水区域(如东洞庭湖)将面临暴发蓝藻水华的风险[4-5,8]. 因而本研究建议:1)洞庭湖周边相关部门严格筛查湖区周边重大排污口,严格管控周边工矿企业、城镇废水的排放;2)取缔湖区内的非法采砂,科学划定采砂区,并且严格禁止在湖区内洗砂与分砂以及采砂船只和运砂船只废水在湖区内直接排放;3)在枯水季调控三峡大坝蓄水,维持洞庭湖自然的水文节律. 此外,研究还表明底栖动物物种和功能群落结构的变动可以很好地指示湖区内水质变动状况. 因而,作者建议在未来洞庭湖湖区水生态健康监测中,将底栖动物物种和功能群落结构同时纳入生物评价体系中. 最后,本研究还显示TRic、FRic及Rao’s Q指数对水质变化最为敏感. 因而,建议在未来评估换水周期较短的大型浅水湖泊水质变化对底栖动物物种和功能多样性的影响时优先选用这3个指数.
