YAP蛋白在肿瘤治疗耐药中作用研究进展
2021-01-11李莹胡琳斐陈晓宇张晟房煊史振东张瑾
李莹 胡琳斐 陈晓宇 张晟 房煊 史振东 张瑾
1天津医科大学肿瘤医院乳腺三科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室300060;2天津医科大学肿瘤医院甲状腺颈部肿瘤科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心300060
0 引 言
靶向和免疫疗法显著提高了晚期或转移性癌症患者的生存率。然而,原发性和获得性耐药限制了大多数抗癌治疗的效果。在上述耐药过程中,常伴随有基因表达谱的改变,在这种情况下,表征分子生物标志物可为耐药的早期识别提供有用的工具。研究结果表明,Yes 相关蛋白(Yes-associated protein,YAP)在人体多种肿瘤中异常表达且与肿瘤的发生、发展、治疗和预后相关,YAP 表达的失调是机体对肿瘤治疗产生抗性的重要机制。因此,深入了解YAP 驱动癌症转化、转移和治疗抗性的机制可提供新的治疗靶点。(图1)
1 YAP 的结构
1988年,Moye-Rowley 等克隆了酵母的 AP-1 基因(yAP1),后来证实,此基因与哺乳动物的YAP 基因同源[1]。人YAP 基因位于染色体11q22.1 区,DNA全长127 896 bp,具有11 个转录本,编码约504 个氨基酸残基的蛋白[2-3]。YAP 蛋白最初被鉴定为与Yes 原癌基因产物的SH3 结构域结合的蛋白质,其属于Src 蛋白酪氨酸激酶家族。YAP 蛋白的相对分子质量为 65 ku,具有两种亚型(YAP1、YAP2),由TID 结构域(转录激活因子结合结构域)、WW 结构域(Tryptophan-Tryptophan 结构域)、TAD 结构域(转录激活结构域)构成,部分异构体含有SH3-BM(SH3结合结构域)和亮氨酸锌指结构。YAP1 含有1 个WW 结构域,YAP2 含有 2 个 WW 结构域,可与连续富含脯氨酸的基序(PPXY)相互作用,介导蛋白质复合物的形成。TID 结构域主要用于募集转录激活因子,TAD 结构域类似于单纯疱疹病毒I 型激活域的病毒粒子蛋白16(VP16),是一种表征良好的转录共激活因子,可与各种转录因子相互作用并调节其转录活性。
2 YAP 蛋白功能及调控
YAP 是Hippo 信号通路中的关键下游调控靶标,既可充当转录共激活因子,也可充当共抑制因子,通过调控细胞增殖和凋亡,在器官大小控制和肿瘤进展中起关键作用。Hippo 信号通路的名称来源于果蝇中发现的一组基因,在人类基因中,Hippo途径的核心激酶反应链主要包括激酶MST1/2、LATS1/2 及接头蛋白SAV 和MOB,调控转录共激活因子YAP 和Tafazzin 蛋白(TAZ)的磷酸化水平及核质定位。Hippo 信号转导通路控制动物器官发育、生长和再生,其失调经常参与肿瘤发生[4-6]。当Hippo 途径开启时,YAP 和TAZ 被LATS1/2 磷酸化,促进其细胞质隔离和蛋白酶体介导的降解。当Hippo 途径关闭时,YAP 和TAZ 被去磷酸化并转移到细胞核,从而能激活不同转录因子相关的靶基因,最终调节细胞生长、代谢、增殖、迁移、侵袭或死亡[7-8]。除经典Hippo 通路外,YAP 还受机械应力、氧化应激压力、蛋白间相互作用等调控[9]。
3 YAP1 参与肿瘤耐药
3.1 经典的Hippo 通路介导的治疗抵抗
YAP/TAZ 作为Hippo 途径的效应分子,常常被当作一种蛋白质,参与多种抗肿瘤治疗的耐药模式[10-14],包括细胞毒性化疗药物治疗、分子靶向治疗、放疗及肿瘤细胞固有耐药等方面。
3.1.1 YAP1/TAZ 介导化疗抵抗
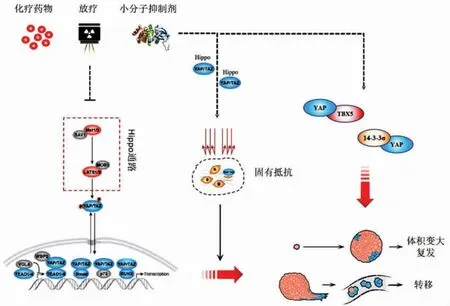
图1 YAP 通过Hippo 经典通路/Hippo 经典通路外介导肿瘤治疗抵抗及转移复发
细胞毒性化疗药物通过干扰必要的细胞过程,如有丝分裂纺锤体的形成、DNA 复制和DNA 完整性,干扰细胞分裂和生存。YAP/TAZ 的上调可抵抗多种细胞毒性药物,如抗小管蛋白、抗代谢物和DNA 损伤药物。在乳腺癌细胞中,TAZ 的过表达已被证明可诱导对紫杉醇和阿霉素的耐药性,YAP/TAZ 靶基因CYR61 和CTGF 的上调似乎有助于耐药性的形成[15-16]。此外,在对5-氟尿嘧啶(5-FU)耐药的癌细胞系中,YAP 的表达和活性增加,且YAP 在耐药结肠癌和食道癌中的表达也上调[17-18]。Li 等[19]的研究结果表明,YAP 诱导性高表达与紫杉醇化学抗性的三阴性乳腺癌(triple-negative breast cancer,TNBC)患者的早期复发密切相关,YAP 的敲低或与抑制剂Verteporfin 的联合使用减少了紫杉醇抗性MDA-MB-231 细胞系的迁移并增强了其凋亡和自噬;因此提出Verteporfin 可作为以紫杉醇为基础治疗药物的TNBC 患者的化学增敏剂。另外,在人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性的乳腺癌患者中,YAP/TAZ高表达与HER2 单克隆抗体、曲妥珠单抗以及化疗联合治疗反应不良有关[20-22]。
3.1.2 YAP1/TAZ 介导放疗抵抗
放射治疗是癌症治疗的另一个重要轴心。电离辐射致癌细胞DNA 双链断裂,诱导细胞周期退出和凋亡。研究结果表明,在多种癌症中,YAP 除了介导化疗耐药性外,还介导放疗耐药性,激活YAP/TAZ 可使癌细胞克服DNA 损伤因子和放疗诱导的DNA 损伤反应[10,23]。髓母细胞瘤中的 YAP 活化,可诱导对辐射的抵抗,而激活YAP 的髓母细胞瘤细胞可绕过DNA 损伤诱导的G1/S 和G2/M 细胞周期检查点,导致DNA 持续断裂和基因组不稳定[24];而尿路上皮细胞癌中,YAP 的下调可增强γ 照射以及其他DNA 损伤药物的损伤反应和细胞凋亡[24]。上述这种检查点旁路,被认为是由于YAP 介导的IGF2-AKT 通路的激活,该通路可失活DNA 损伤反应转导子共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)和细胞周期检测点激酶 2(checkpoint kinase 2,CHK2)。相反,YAP 的抑制会导致顺铂治疗时DNA 损伤反应增加,ATM 活化增加,通过DNA 损伤的积累导致尿路上皮癌细胞凋亡[25]。
3.1.3 YAP/TAZ 介导分子靶向治疗抵抗
激活YAP 和TAZ 可上调生长因子信号转导元件的编码基因,增强分子靶向药物抗肿瘤治疗的耐药。由YAP/TAZ 驱动的耐药性可能涉及表皮生长因子受体(epidermal growth factor receptor,EGFR)信号转导的增强,以及下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 和 PI3K/AKT 信号通路的激活,而EGFR 和胰岛素样生长因子(insulin like growth factor,IGF)信号被证明可增强YAP/TAZ 活性[26-28]。因此,YAP/TAZ 和 EGFR/IGF 通路之间的正反馈回路可能进一步强化耐药性过程。YAP/TAZ 活性可能通过上调抗凋亡基因的表达,来降低细胞对抗癌药物的敏感性。YAP 可结合抗凋亡基因B 细胞淋巴瘤2 样1 基因(B-cell lymphoma 2-like1,BCL2L1)和含杆状病毒 IAP 重复 5(baculoviral IAP repeat-containing 5,BIRC5)的启动子,上调其表达水平。在B-RAF 原癌基因丝氨酸/苏氨酸蛋白激酶(B-Raf proto oncogene serine/threonine protein kinase BRAF)和大鼠肉瘤(rat sarcoma,RAS)基因突变的癌细胞系中,BCL2L1 的抗凋亡亚型BCL-XL 的表达依赖于YAP 的活性,BCL-XL 是YAP 的下游效应物,在对RAF/MEK(Mekinist)抑制剂产生耐药性的过程中发挥作用[29]。因此,YAP/TAZ 活性可能通过上调抗凋亡基因的表达来降低细胞对抗癌药物的凋亡敏感性。在分子靶向治疗中,YAP 活化可拯救KRAS 依赖性结肠癌细胞免受shRNA 介导、KRAS抑制诱导的活力丧失[29],提示YAP/TAZ 激活可能诱导RAS 信号通路特异性靶向抗癌药物的耐药性。Lin 等[30]发现 YAP 可介导对 RAF 和 MEK 抑制剂治疗的耐药性,对YAP 的抑制可显著提高RAF 或MEK 抑制剂的敏感性。
3.1.4 YAP/TAZ 介导肿瘤细胞的固有抵抗
YAP/TAZ 的生物学效应主要来源于其在调控细胞增殖、存活和干细胞的基因转录激活中的作用。然而,哺乳动物细胞中的YAP 和TAZ 除了与基因启动子相互作用外,还与许多转录增强相关结构域(transcriptional enhanced associate domain,TEAD)结合增强子和超增强子相互作用,从而导致一组决定细胞状态的基因具有高水平的转录活性[31]。因此,YAP 和TAZ 可能通过调控一个复杂的增强子和启动子序列来协调耐药基因的转录。YAP 也被证明与致癌的p53 突变体合作,可诱导细胞周期蛋白和周期蛋白依赖性激酶1(cyclin-dependent kinases 1,CDK1)的转录激活,促进细胞周期进展[32]。因此,YAP 的激活可能通过干扰肿瘤抑制因子野生型p53或增强p53 突变体的致癌活性而干扰抗癌治疗。
YAP/TAZ 的激活也会诱导癌细胞的干细胞样特性。而肿瘤干细胞的干性与抗癌治疗的耐药性相关,如药物转运体表达的上调、DNA 修复能力的提高以及更高的抗凋亡潜能[13,33]。分化差的乳腺癌呈现出较高水平的YAP/TAZ 靶基因表达,乳腺癌中的TAZ 活性通过提高干细胞标志物和肿瘤起始潜能,诱导对紫杉醇和多柔比星的抗性[34]。此外,有研究结果表明,蛋白酶激活的受体1(recombinant protease activated receptor 1,PAR1) 信 号 通 路 通 过 Rho GTPase 激活诱导YAP 去磷酸化和核转位,从而促进干细胞样胃癌细胞的多药耐药[35]。这些结果支持了YAP/TAZ 可能通过诱导癌细胞中的干细胞样特性而促进抗癌治疗耐药性的观点。
肿瘤细胞的上皮细胞间充质转变(epithelial to mesenchymal transition,EMT)过程不仅是肿瘤转移增加的基础,而且与肿瘤细胞的EMT 对抗癌治疗的耐药性过程密切相关[36-37]。在乳腺上皮细胞中,YAP/TAZ 激活诱导EMT 表型,如细胞失去接触,纺锤形形态出现,间充质标志物(如纤维连接蛋白、波形蛋白和N-cadherin)上调[15,38]。在KRAS 依赖性结肠癌细胞系和小鼠肺癌模型中,YAP 通过其对EMT 诱导的影响,挽救了KRAS 抑制后肿瘤细胞活力的降低[29]。
3.2 YAP 介导Hippo 通路外的治疗抵抗
YAP 作为转录共激活因子,除与TAZ 的协同促转录作用促进肿瘤耐药外,同时存在其他途径的调控及被调控机制参与治疗抵抗。Koinis 等[39]的研究结果表明,引起前列腺癌MET 抑制Cabozantinib抵抗的分子基础为成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)及 FGF 的过表达。FGFR1 及FGF 依赖于YAP/TBX5 复合物的驱动,而该过程中YAP 的活性调控及核质定位独立于 Hippo 通路之外[39]。在胰腺癌中,14-3-3σ 过表达可促进YAP 表达,磷酸化的YAP 通过与14-3-3 蛋白质结合形成磷酸肽复合物而被隔离在细胞质中,此处YAP 不再具有促进靶基因表达的转录激活作用,二者相互结合、相互依赖,通过增强核糖核苷酸还原酶 M1(ribonucleotide reductase M1, RRM1)和RRM2 的表达,减弱吉西他滨诱导的Caspase-8 激活和凋亡来增强获得性吉西他滨的耐药性[40]。
4 结 语
YAP/TAZ 作为Hippo 信号通路的下游效应因子,可通过激活生长因子信号、抑制凋亡、调节DNA损伤反应、促进细胞周期、诱导干细胞样特性、诱导间充质转化,引起抗肿瘤治疗过程中的耐药作用。此外,YAP 还可通过Hippo 经典通路外的非转录激活作用与多种蛋白相互作用,诱导肿瘤耐药的发生,如图1 所示。YAP 的表达状态可作为一项预测肿瘤放化疗敏感性、判断肿瘤预后的指标,是潜在的药物靶点。利用该靶点,并与放化疗及小分子抑制剂联合应用,有望成为解决肿瘤耐药的新途径。
利益冲突所有作者均声明不存在利益冲突
