胸腺肽治疗特发性肺纤维化患者的疗效观察及机制探索
2021-01-09陈娴秋
胡 洋, 陈娴秋, 翁 东
(同济大学附属上海市肺科医院呼吸与危重症医学科,上海 200433)
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是原因不明并以普通型间质性肺炎为特征性病理改变的一种间质性肺疾病[1],是众多间质性肺疾病中的预后最差、发病率相对较高的一种疾病。占所有间质性肺病的25%以上[2],占特发性间质性肺炎的60%以上。过去的20年,IPF发病率总体呈现明显增长的趋势,确诊后中位生存期仅3~5年,5年生存率30%~50%[3]。临床上缺乏早期诊断手段,一旦发现多为中、晚期。治疗上除了肺移植外,缺乏其他有效治疗手段。IPF病理学表现以慢性进行性肺实质损害和纤维化为主要特征,最终导致肺脏结构和功能的严重破坏。患者死亡多因病情突然恶化所致[4]。
胸腺肽在细胞骨架重排、血管生成、纤维化以及组织损伤修复中起重要作用,这些病理生理过程均存在于肺纤维化中。临床研究发现,胸腺肽对肺组织损伤气道有一定的保护作用[5]。目前胸腺肽已在临床广泛用于慢性乙型肝炎、各种原发性或继发性T淋巴细胞缺陷病,以及某些自身免疫性疾病,临床证明安全有效。本研究拟将胸腺肽首次应用于IPF患者,观察该药对患者的临床疗效,并探讨其中可能的免疫机制,为IPF的治疗寻找切实有效的药物治疗方法。
1 资料与方法
1.1 研究对象
本研究连续性纳入2018年3月—7月于同济大学附属上海市肺科医院呼吸科住院的IPF患者共47例。所有病例符合美国胸科学会、日本呼吸学会、欧洲呼吸学会和拉丁美洲胸科学会共同制定的《特发性肺纤维化诊治循证指南》[3]中有关诊断标准。排除合并严重感染或处于急性加重状态、使用免疫抑制剂、合并恶性肿瘤、严重肝肾功能不全、心功能不全患者。本试验经过同济大学附属上海市肺科医院伦理委员会批准(K14-161),所有受试者均签署知情同意文件。
1.2 治疗方法和观察指标
47例受试者随机分为治疗组及对照组,均在本中心进行IPF的常规基础诊疗。治疗组在常规治疗基础上增加胸腺肽肠溶片(哈高科白天鹅药业集团有限公司)20mg,每日3次口服,共治疗1年;对照组仅用基础治疗,无其他免疫调节药物使用。观察治疗前后两组患者肺功能指标的变化,包括用力肺活量(forced vital capacity, FVC)、第1秒用力呼气容积(forced expiratory volume in one second, FEV1)、一氧化氮弥散量(CO diffusion capacity test, DLCO)变化情况,记录1年内急性加重发生次数以及治疗前后6min步行距离。急性加重的定义参考2016年ATS/ERS对AE-IPF的定义: (1) 既往或当前诊断为IPF;(2) 1个月内形成或出现急性呼吸困难恶化;(3) 胸部高分辨率CT表现为在原来网状阴影或蜂窝影UIP表现的背景上出现新的双侧磨玻璃影和/或实变影;(4) 呼吸困难的恶化不能用心力衰竭或液体负荷过多解释[6]。6min 步行距离测定操作严格参照6MWT指南[7]。同时,分别于初诊及随访第12个月时采集受试者外周血清,使用Biorad公司的Bio-Plex ProTMHuman Cytokine 27-plex Assay产品进行27种细胞因子的检测,操作步骤严格按照产品说明手册进行。检测范围包括FGF basic、Eotaxin、G-CSF、GM-CSF、IFN-γ、IL-1β、IL-1ra、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-12 (p70)、IL-13、IL-15、IL-17A、IP-10、MCP-1 (MCAF)、MIP-1α、MIP-1β、PDGF-BB、RANTES、TNF-α、VEGF。
1.3 统计学处理
2 结 果
2.1 一般资料
本研究共纳入47例IPF患者,其中治疗组22例,男性20例,女性2例,年龄50~74岁,平均(61.4±6.8)岁。对照组25例,其中男性22例,女性3例,年龄55~72岁,平均(62.0±5.1)岁;两组在年龄、性别、肺功能基线指标、肺纤维化评分指标上差异无统计学意义(P>0.05),见表1。

表1 受试者一般资料
*对照组患者在随访中死亡1例;a肺纤维化评分采用Helbich等[8]的HRCT评分系统,分别在3个CT层面(主动脉弓,气管分叉,横膈上方1cm处)计算得分,评估指标主要是磨玻璃影(包括实变影)、网状影、蜂窝影;相加后得到总分,肺纤维化评分越高表明肺纤维化更严重
2.2 肺功能变化
两组患者治疗前后的肺功能变化及6min步行距离如表2所示,治疗前后两组在FVC、FEV1及DLCO三个指标的变化差异无统计学意义。治疗组患者肺功能FVC下降值低于照组,但结果差异无统计学意义[(0.22±0.11) Lvs(0.25±0.79) L,t=0.856,P=0.48]。治疗组1年内FVC下降超过10%的人数为8例(36.3%),低于对照组12例(48%),两组间差异无统计学意义(χ2=0.648,P=0.42),见图1。
2.3 急性加重发生人数
随访1年当中,治疗组发生急性加重的例数为3例(13.6%),其中1例发生急性加重2次,2例各发生1次,对照组发生急性加重例数为10例(40.0%),其中2例发生急性加重2次,8例发生1次。治疗组急性加重的人数所占比例明显低于对照组(χ2=4.064,P=0.044),见图2。
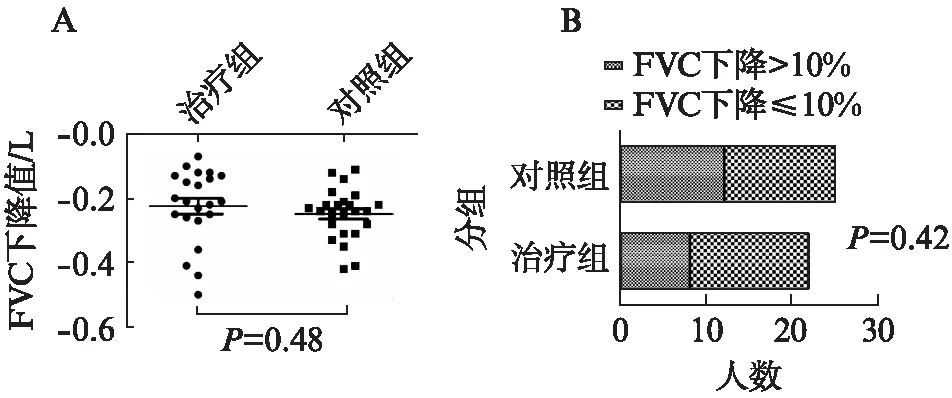
图1 胸腺肽对IPF患者用力肺活量的影响Fig.1 Effect of thymosin on forced vital capacity in IPF patientsA: 胸腺肽治疗前后FVC下降值对比;B: 胸腺肽治疗前后FVC下降>10%和≤10%的人数比例对比

表2 治疗前后肺功能变化
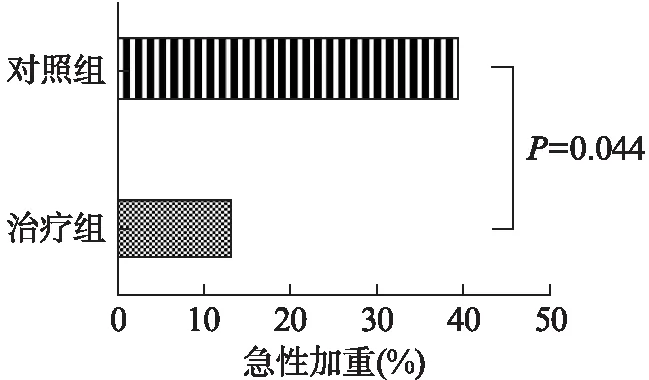
图2 胸腺肽对IPF患者急性加重发生的影响Fig.2 The effect of thymosin on acute exacerbation of IPF
2.4 运动耐量比较
治疗前后两组患者6min步行距离治疗组平均下降(56.64±15.4)m,对照组平均下降(72.54±23.04)m,差异有统计学意义(t=2.736,P=0.009),见图3。
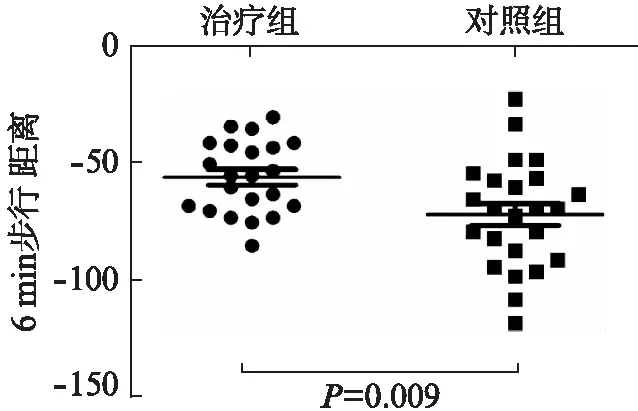
图3 胸腺肽对IPF患者6min步行距离的影响Fig.3 Effect of thymosin on 6-min walking distance of IPF patients
2.5 不良反应监测
随访1年当中,两组患者均无明显不良反应发生。治疗组中无患者死亡,对照组中有1例死亡,差异无统计学意义。
2.6 血清学指标变化
两组患者治疗前后血清中27种细胞因子进行检测,在基线时,治疗组TNF-α和IL-6含量高于对照组(P=0.011,P=0.023),其余细胞因子含量两组间差异无统计学意义。1年后,治疗组IL-1ra和INF-γ含量均显著高于对照组,差异有统计学意义(P=0.001,P<0.001),见表3。
各组治疗前后分别进行统计分析,如图4所示,血清中TNF-α在治疗组用药前后无明显变化,但在对照组中有显著升高(P=0.046);IL-6与TNF-α有相同的趋势,治疗组出现下降(P=0.019),而对照组上升(P=0.016);IL-1ra变化在治疗组中有显著升高(P=0.005),在对照组有显著下降(P=0.037),这样的趋势同样见于INF-γ和IL-7水平。INF-γ在治疗组中升高(P=0.012),对照组中下降(P=0.029);IL-7在治疗组中升高,差异有统计学意义(P=0.046),而对照组差异无统计学意义,见图4。
表3 治疗组与对照组细胞因子含量测定
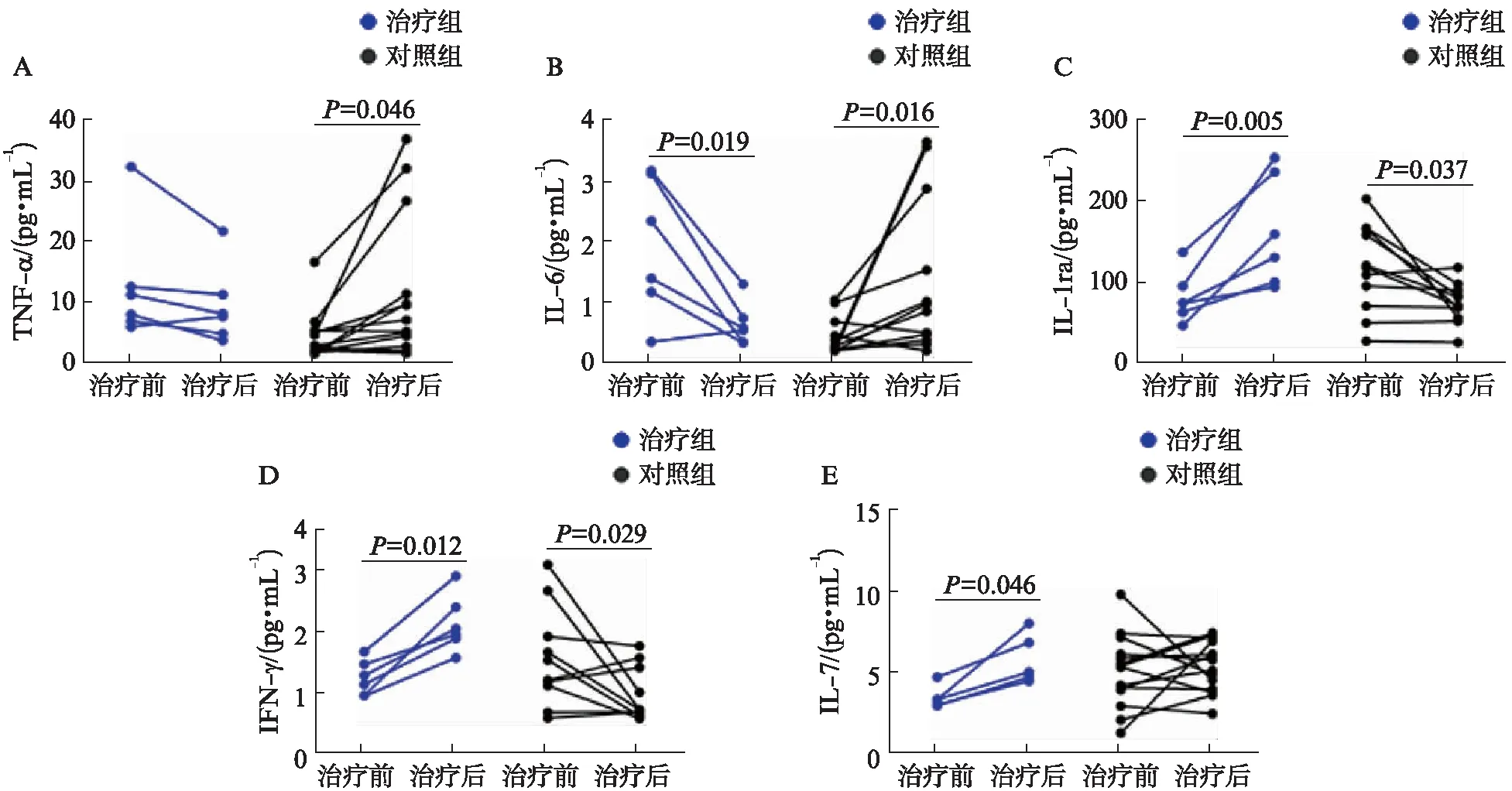
图4 两组治疗前后血清中细胞因子含量变化Fig.4 Changes of cytokine levels before and after treatmentA: TNF-α在治疗前后变化;B: IL-6在治疗前后变化;C: IL-1ra在治疗前后变化;D: INF-γ在治疗前后变化;E: IL-7在治疗前后变化
3 讨 论
本研究观察了胸腺肽治疗前后IPF患者临床指标的变化,提示虽然胸腺肽不能延缓肺功能的下降,但在减少急性加重次数方面具有显著意义。既往研究提示,感染是IPF患者急性加重的重要原因[9],而IPF的急性加重预示了较高的死亡风险,推测胸腺肽可能通过其免疫调节作用来减少感染的发生,从而减少急性加重的风险。此外,胸腺肽对IPF患者6min步行距离的下降有一定的延缓作用,体现了其对IPF患者活动耐量的改善,提示胸腺肽的治疗对IPF患者生活质量的改善具有一定作用。
炎症反应在IPF的发生发展中发挥了核心作用[10],其中TGF-β及TNF-α是关键细胞因子,具有促进成纤维细胞的增殖、细胞外基质沉积、介导肺泡上皮细胞凋亡和坏死,致上皮间质转化(epithelial mesenchymal transition, EMT)等作用。本研究发现,对照组患者在随访过程中血清中TNF-α升高,而经过胸腺肽治疗可以抑制这一趋势。IL-6是一种较为常见的炎性因子,主要由单核细胞、巨噬细胞和成纤维细胞产生,是目前已知的细胞因子家族中的核心成员之一,其生物学效应也非常复杂[11]。既往有研究对大鼠进行肺纤维化造模,研究结果显示,模型组大鼠血清中IL-6水平明显高于正常大鼠,并且IL-6动态表达与肺纤维化大鼠肺泡炎的动态变化趋势相一致[12]。目前多个研究显示,通过降低IL-6水平可以改善IPF患者的临床症状[13]。本研究发现胸腺肽可以显著降低IPF患者血清IL-6水平,可能是其抑制肺纤维化的另一机制。
以往文献报道,IL-1ra可能通过对肺泡巨噬细胞的TNF-α产生及其对成纤维细胞增殖活性的抑制,对博来霉素诱导的肺纤维化小鼠模型的肺纤维化起到抑制作用[14];有研究表明肺纤维化时患者血清IFN-γ显著减少,外源性给予IFN-γ能显著改善肺纤维化程度,逆转已优势化的Th2激活,恢复Th1/Th2的平衡,减缓肺纤维化的发展[15]。本研究发现胸腺肽治疗后IPF患者血清IL-1ra及IFN-γ水平均较治疗前有显著升高,说明胸腺肽可能通过以上途径抑制或延缓肺纤维化的发生。此外,研究人员在巨噬细胞、纤维肉瘤细胞和黑色素瘤细胞发现了IL-7具有下调TGF-β产生的功能。基于TGF-β在肺纤维化发病中的重要作用,IL-7可能通过下调TGF-β的产生而具有抗肺纤维化的潜力[16-17]。本研究发现胸腺肽可以提高治疗组患者血清IL-7水平,提示其可能的治疗作用机制。
综上所述,胸腺肽虽不能延缓IPF患者的肺功能下降,但可以减少急性加重发生率,对于IPF患者的预后具有重要意义。且胸腺肽的治疗可以改善IPF患者的运动耐量,提高生活质量,并可能通过抑制TNF-α、IL-6水平,以及升高IL-1ra、IFN-γ、IL-7的水平来发挥抗纤维化作用。
然而本研究入组病例数相对较少,后期需要进一步增加研究病例数量;需要在前期得出的结论基础上,进行深入的机制研究,以期为IPF患者治疗药物的开发提供新的依据。
