猪链球菌1型临床分离株的鉴定和基因组学分析
2021-01-08刘敬天义何培娟董芳芳陈申申姚火春潘子豪
刘敬天义,何培娟,董芳芳,陈申申,姚火春,潘子豪
(南京农业大学动物医学院/世界动物卫生组织猪链球菌病参考实验室,江苏 南京 210095)
猪链球菌(Streptococcussuis)是一种重要的人畜共患病病原,在世界范围流行,对生猪养殖业和人的健康都带来严重威胁[1]。根据荚膜多糖的抗原成分不同,将猪链球菌分成29个血清型(1~19,21,23~25,27~31和1/2)以及1个Chz型和20个NCL型[2],其中2型和9型在临床分离中较为多见,猪链球菌致病机制和毒力因子的研究多见于2型。细菌感染动物后出现多种临床表现,如败血症、脑膜炎、心内膜炎和关节炎,严重时会导致多器官衰竭造成死亡[3]。2005年四川省暴发猪链球菌并造成215人感染,38人死亡[4]。世界范围内已有4例猪链球菌1型感染人的报道[5],国内出现2例[6-7],应引起足够的重视。由于猪链球菌1型的分离菌株较少,对该血清型的基因组分析数据有限。本研究从发病的仔猪气管中分离出1株链球菌,经分子生物学鉴定为猪链球菌1型,并对其开展致病性试验以及基因组测序分析。
1 材料与方法
1.1 病原菌的分离纯化
病料取自广东省某生猪养殖场暴发肺炎的患病猪,采集濒死断乳仔猪和育成猪的肝脏、肺脏和关节囊液用于病原分离,共45份样品。
1.2 实验动物
AB纯系斑马鱼购自南京夫子庙明海水族馆,5周龄SPF级BALB/c小鼠购自南京青龙山动物繁殖场。动物试验在南京农业大学实验动物中心[许可批号:SYXK(SU)2017—00071]进行。
1.3 主要试剂
THB粉末(Todd—Hewitt broth)购自美国BD公司;无菌绵羊血购自江苏省疾控中心;抗生素购自北京鼎国生物技术有限公司;全基因组DNA提取试剂盒购自Omega公司; 2×RapidTaqMaster Mix购自南京诺唯赞生物科技有限公司。
1.4 方法
1.4.1 细菌的分离与镜检
无菌采集濒死猪的肝脏、肺脏、关节囊液等组织样品,用接种环划线接种于含5%绵羊血的THB平板,倒置在CO2培养箱37 ℃培养24 h后,挑取疑似猪链球菌菌落进行革兰染色镜检。
1.4.2 猪链球菌种属特异性及血清型鉴定
参考实验室先前研究和相关文献[8],选择猪链球菌特异基因recN以及血清型1型特异性片段csp1I进行PCR鉴定,引物由南京金斯瑞生物技术有限公司合成,引物情况详见表1。使用全基因组提取试剂盒提取该分离菌株的基因组,对recN和cps1I基因扩增。PCR程序:96 ℃ 预变性5 min;96 ℃ 变性30 s,55 ℃ 退火 1 min,72 ℃ 延伸30 s,30个循环;72 ℃ 延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测。

表1 扩增基因及引物序列
1.4.3 斑马鱼攻毒
参照文献[9],将该分离菌株培养至对数期(OD600=0.6),离心收集菌体后用PBS重悬,重复3次。设置3个梯度,分别为1×108、 1×107和1×106CFU/mL,各稀释浓度接种12尾斑马鱼,每尾在泄殖腔注射10 μL菌液,用PBS作为阴性对照。持续观察1周,每天观察记录斑马鱼死亡情况,用Reed-Muench公式计算半数致死量(LD50)。
1.4.4 基因组的测序与组装
使用全基因组提取试剂盒提取该分离株的全基因组,所得基因组经琼脂糖凝胶电泳及Qubit定量检测,大小及浓度均合格后送往上海凌恩生物科技有限公司测序。利用高通量测序技术进行基因组测序,使用ABySS和GapCloser完成拼接和gap的填充。
1.4.5 基因组组分的预测
GeneMarkS软件检索编码基因;使用RNAmmer-1.2和tRNAscan-SE 2.0.4软件对基因组中包含的rRNA与tRNA进行预测;使用IslandViewer预测基因岛。毒力基因和耐药基因使用VFDB(Virulence Factors Database)与ARDB(Anti-biology Resistance Database)数据库对比匹配和注释;基因毒力岛登录IslanderPath-DIOMB(www.pathogenomics.sfu.ca/islandviewer/resources.php)基于不同GI岛预测方法对测序菌株的GI岛序列预测,并以圈图的形式表现其在基因组上分布情况。
1.4.6 比较基因组分析
比较基因组的分析主要包括:核心与特异基因、基因组同源性和基因家族系统发育树等。使用 Mauve 软件对样本基因组和参考基因组进行基因组比对,采用 PhyML的方法,利用 MUSCLE构建系统发育树。参考菌株见表2。

表2 主要参考菌株信息及其来源
2 结果
2.1 菌落镜检
在1 000倍光学显微镜下见革兰染色呈蓝紫色的短链状球菌,每链6~12个菌,也有呈双球或单个散在分布(图1);在绵阳血平板上出现α溶血环,菌落呈圆形、灰白色点状、针尖大小,表面光滑,边缘整齐,半透明。
图1 分离菌株镜检(×100)
2.2 血清型鉴定
使用2对引物recN-F、recN-R和cps1I-F、cps1I-R扩增全基因组后得到的产物,分别在336 bp(图2A)和153 bp处出现条带(图2B),鉴定分离菌株为猪链球菌1型,并命名为SS2011GZ。

M. DNA Marker;1. 阴性对照;2. 目的片段图2 recN基因(A)与cps1I基因(B)电泳
2.3 斑马鱼攻毒
斑马鱼在接种SS2011GZ菌株24 h内陆续发生病变,腹部、肛门周围出现充血、水肿。3 d之内,所有接种的斑马鱼全部死亡(图3)。根据Reed-Muench法,计算LD50为4.09×104CFU。
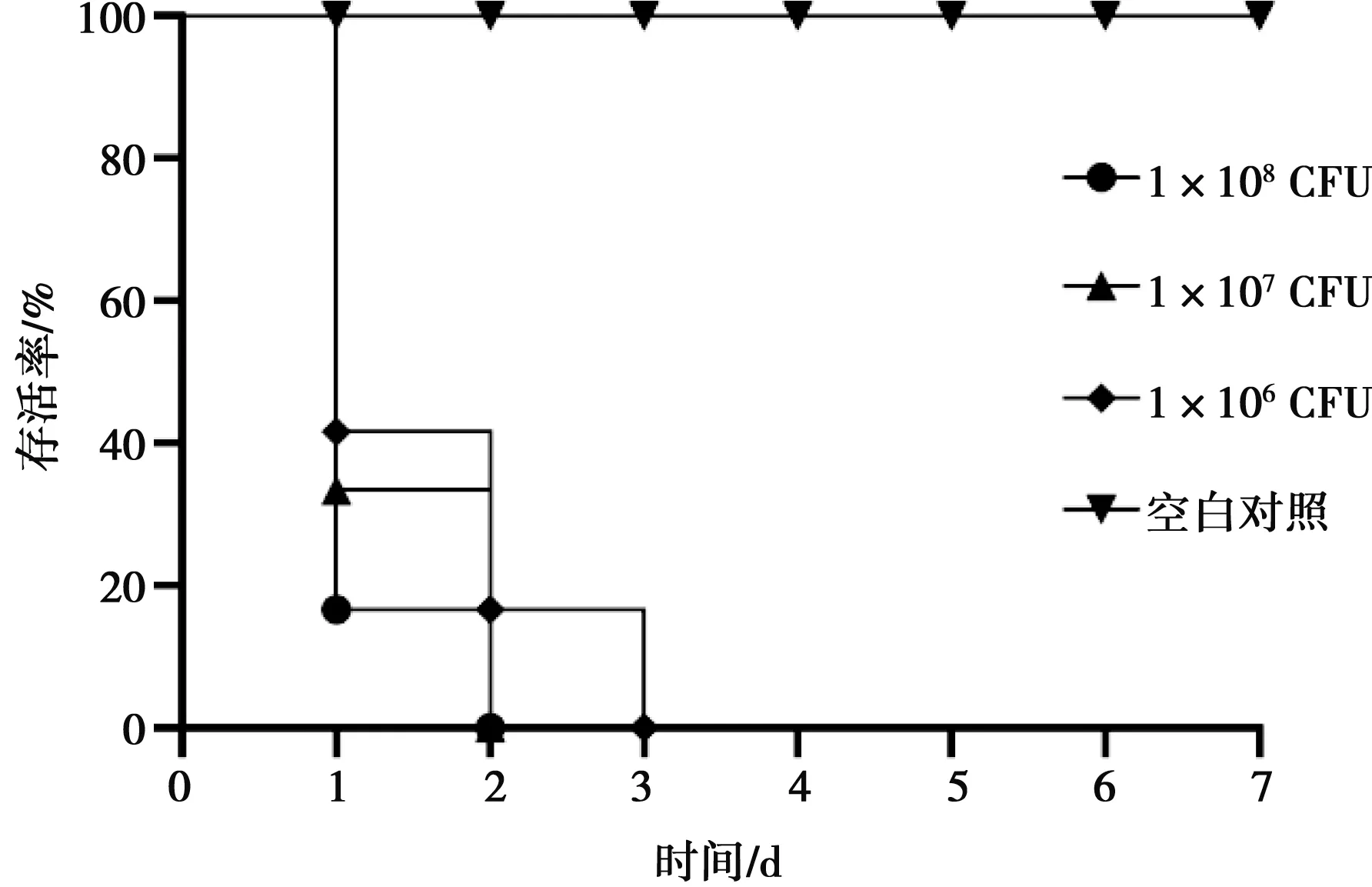
图3 攻毒斑马鱼的存活曲线
2.4 基因组分析
2.4.1 全基因组序列基本信息
经过组装、纠正、成环检验后,得到完整的成环的SS2011GZ基因组,全长2 658 332 bp,GC比占39.74%,含2 692个开放阅读框,编码蛋白占比87.3%,48个tRNA,9个5S rRNA,1个16S rRNA,2个23S rRNA,存在19个基因岛,提示该菌基因的多样性(图4)。
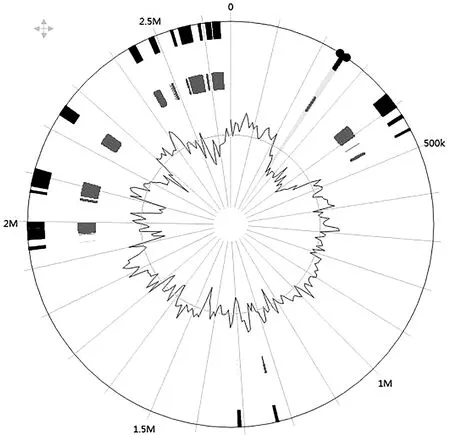
注:Integrated软件(黑色)比较IslandPick(灰色)预测的基因岛共线性分析图4 SS2011GZ的基因岛预测
2.4.2 耐药基因分析
通过基因组测序,共发现24个耐药基因,提示该菌高度耐药。部分耐药基因对多种抗生素都存在抗性,故统计得到各个抗生素耐药基因个数为:四环素类10个,大环内酯类10个,利福霉素11个,头孢菌素类9个,喹诺酮类12个,多肽类14个,氨基糖苷类3个,林可酰胺类3个,硝基咪唑类3个,甲砜霉素类5个,详见表3。
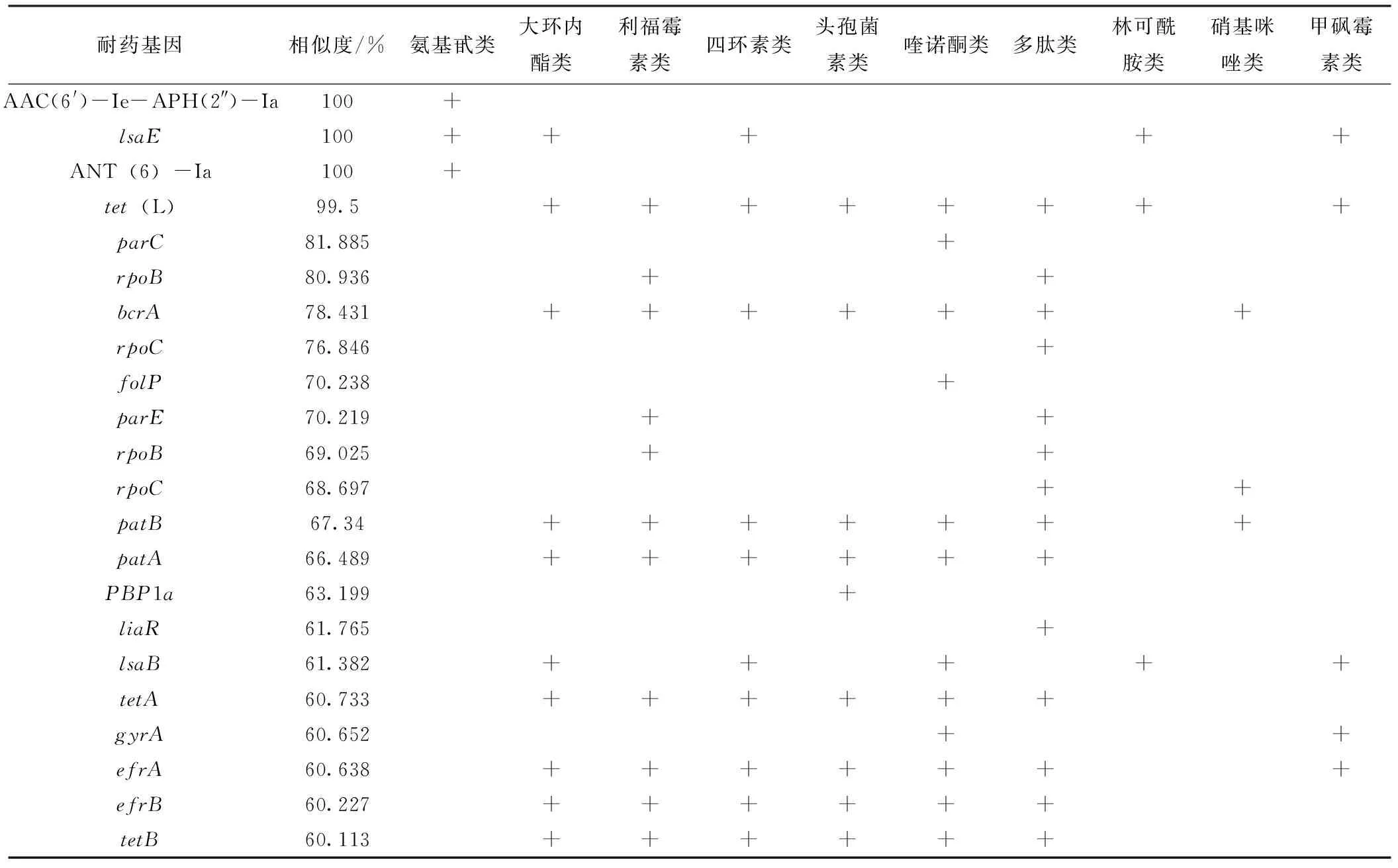
表3 耐药性基因
2.4.3 毒力基因分析
有研究表明,谷氨酸脱氢酶(gdh)、溶菌酶释放蛋白(mrp)、胞外因子(epf)、溶血素(sly)、纤连蛋白结合蛋白(fbps)和表面抗原(sao)为猪链球菌的毒力因子[10]。SS2011GZ属于mrp+gdh+epf+sly+fbps-sao-型。
2.4.4 基因组与核心基因比较分析
利用Mauve软件对SS2011GZ的基因组与ST1、GZ0565、98HAH33、D9进行比较,结果显示SS2011GZ在基因组之间出现大规模的基因重排、倒位、插入、缺失(图5),并且值得注意的是ST1与SS2011GZ同为1型菌,GZ0565发源地为广州与SS2011GZ相同,两菌与SS2011GZ的共线性极差。此外,通过比对该菌与ST1和GZ0565的特殊基因数发现,SS2011GZ有807个独特基因(图6),提示该菌基因的复杂性和时间上呈演化趋势。

注:相同颜色表示相似的基因片段图5 猪链球菌SS2011GZ的共线性分析
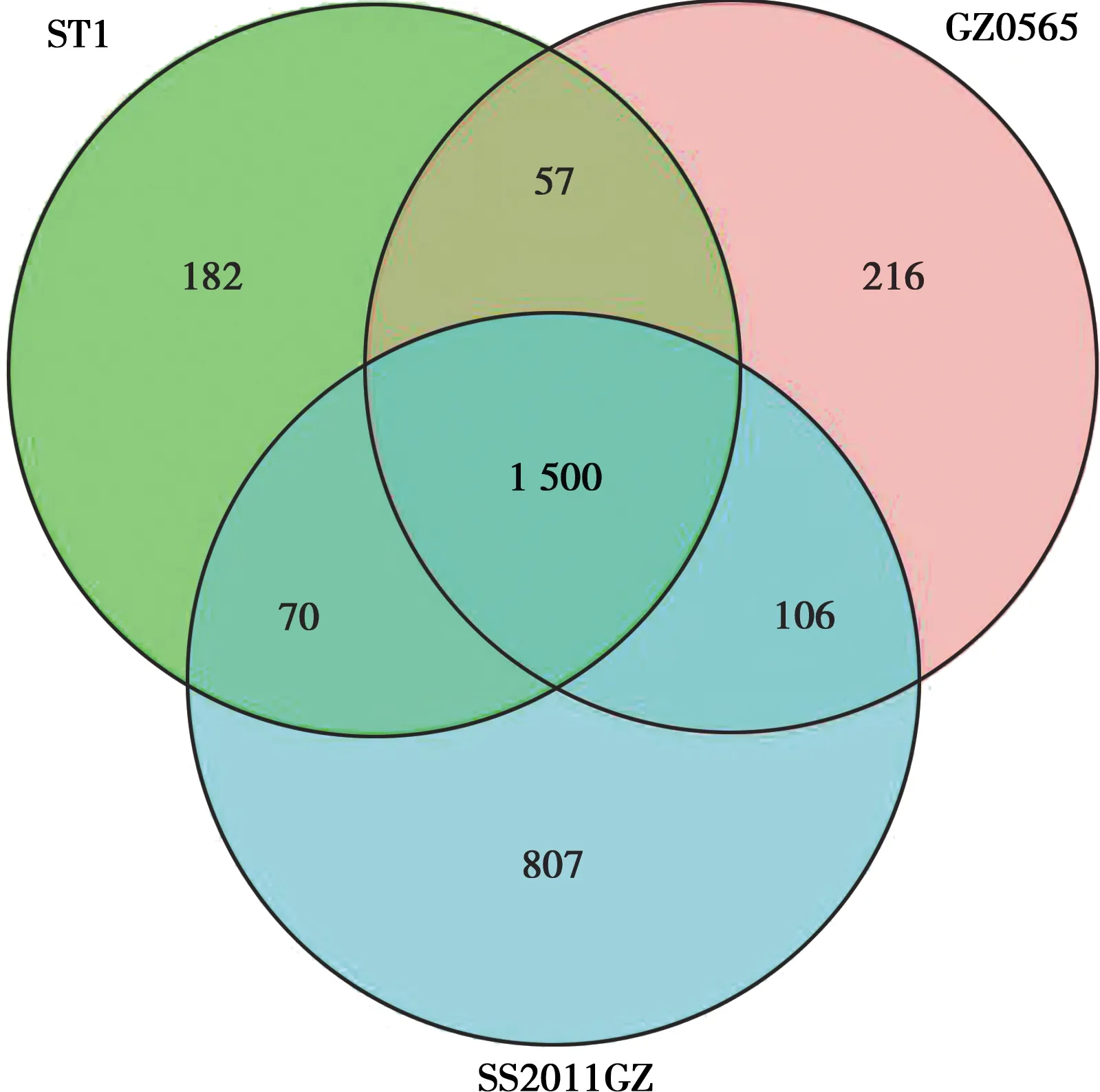
图6 菌株SS2011GZ与ST1和GZ0565的特殊基因比较
2.4.5 SS2011GZ群体进化分析
为方便研究,Tettelin等[11]在2005年曾提出过微生物的泛基因组概念。泛基因组指某一物种所有基因的总和,由核心基因组和非必需基因组组成。其中,核心基因组表示同一物种所有菌株都含有的基因,往往是必不可少的,因此可用于系统发生树的构建。与核心基因组相对的是非必需基因,表示仅在某株菌中或某几株菌中存在。猪链球菌的泛基因组的数量随着基因组的数目增多而不断增大,属于开放型泛基因组(图7A)。而核心基因组随着菌株数量的增多而逐渐减少,在达到17株左右时核心基因组的数量趋于稳定,数量约在1 200至1 300个之间(图7B)。将NCBI上公布序列的20株菌与SS2011GZ基于猪链球菌核心基因制作成系统进化树(图8),进化树结果表明SS2011GZ属于独立分支,提示该菌基因的独特性。
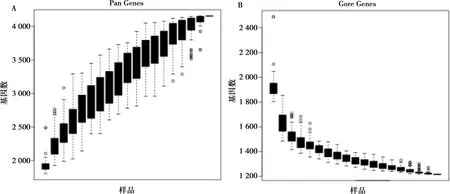
图7 SS2011GZ的核心基因组和泛基因组
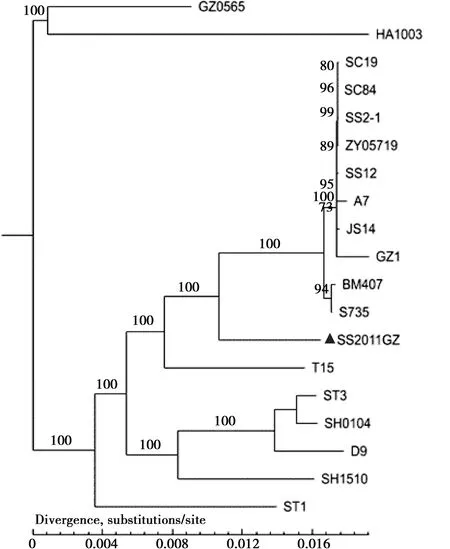
注:▲为本试验分离株图8 基于核心基因构建的系统发育树
3 讨论
猪链球菌病是一种重要的人畜共患病,在猪群中传播较广,尤其在国内养殖场更为普遍,通过食物或是直接接触的方式,该病可由猪直接传播给人,引发严重的公共卫生问题。2015年,广东省猪链球菌阳性率为82.02%,1型菌的检出率只有1.07%[12]。本研究分离并鉴定该菌株为猪链球菌1型强毒株,相关报道较少。
斑马鱼攻毒的试验结果显示该菌的LD50为4.09×104CFU,与濮俊毅等[9]报道的猪链球菌2型强毒株HA9801(1.85×104CFU)和ZY05722(2.98×104CFU)毒力相近。目前虽没有标志的毒力因子来区分猪链球菌毒力的强弱,但国内外公认的主要毒力因子有mrp、epf、sly、gdh、fbps等[13]。SS2011GZ属于mrp+gdh+epf+sly+fbps-sao-型,强毒株05ZYH33和98HAH12属于mrp+gdh+epf+sly+fbps+sao+型[14]。3株菌株都具有毒力因子mrp、gdh和sly,这3个毒力因子往往用作鉴定猪链球菌的毒力[15]。sao是疫苗的靶位点,该菌不具备。fbps参与致病菌黏附宿主细胞的过程[16],敲除后毒力有所下降[17],SS2011GZ虽然没有该基因,但就斑马鱼半数致死量来看,其毒力应引起人们重视。在国内外报道过的猪链球菌1型感染人并造成死亡的案例中,贵州造成死亡的菌株毒力基因型为mrp-epf+sly+[7],值得注意的是SS2011GZ属于mrp+epf+sly+型,结合斑马鱼攻毒试验,证实该菌毒力较强,有感染人的风险。基因差异是毒力差异和耐药差异的根本,通过比较同地区或同血清型菌株基因组之间的差异,可以客观地反映不同菌株的演化方向。Benedict等[18]曾通过比较泛基因组的差异研究微生物的代谢网络和毒力因子,本文通过比较SS2011GZ与该分离地的其他菌株以及相同血清型菌株基因组,发现该菌与同分离地和同血清型的猪链球菌共线性较差,且该菌存在大量特殊基因,系统发生树处于独立分支,证明该菌基因的独特复杂,从侧面反映动物源性致病菌进化的快速和复杂,以及接下来猪链球菌病的防治或将面临新的危机和挑战。
长期、广泛和不恰当地使用兽用抗菌药,导致动物源细菌的耐药问题较为普遍和严重。资料表明,国内外猪链球菌对四环素和大环内酯类抗生素均已高度耐药,分别高达70%与90%[19-21]。本课题组从暴发猪链球菌病的仔猪气管中分离并鉴定猪链球菌SS2011GZ,基因组中发现多个不同类型的抗生素耐药基因,包括四环素类、大环内酯类、氨基糖苷类、林可酰胺类、甲砜霉素类抗生素的耐药基因。我国临床分离的猪链球菌株一般对四环素和红霉素耐药,但多对青霉素类敏感[22]。值得注意的是,头孢噻呋作为猪链球菌病治疗的敏感药物[23],在临床上被广泛运用,而该菌基因组中存在数个头孢菌素的抗性基因,需引起养猪业对于滥用抗生素的反思和重视。
综上,本研究从广东某猪场罹患肺炎仔猪气管中分离到1株猪链球菌1型,命名为SS2011GZ。斑马鱼攻毒试验提示该菌毒力较强,可能与其具备多个毒力因子有关。与当地分离株和同血清型株的共线性分析、进化树分析、核心基因分析揭示,该菌的基因组复杂、独特,这对于猪链球菌病的防控有一定参考意义。
