响应面法优化党参多糖提取工艺及抗氧化活性研究
2021-01-08时菲菲陈毓周晨于生兰
时菲菲,陈毓,周晨,于生兰
(江苏农牧科技职业学院动物药学院,江苏 泰州 225300)
党参(CodonopsispilosulaNannf.)为桔梗科植物,主产于山西、陕西、甘肃等地,以根入药,是我国药食两用传统中药材,可用于脾肺气虚、内热消渴、气短心悸等症[1]。党参的活性成分主要有:多糖、皂苷、生物碱类、甾醇类等[2],其中以多糖含量最高,包括戊糖、己糖及糖醇、糖酸等,党参多糖不仅具有抗氧化和抗衰老作用,经研究还具有调节免疫系统和血液系统的作用[3-5],对党参多糖的研究已成为当今研究热点。常见的多糖提取方法主要有热水浸提法、超声波辅助提取法[6-7]、微波辅助提取法[8-9]、酶辅助提取法[10-11]及亚临界提取法[12]等,以上几种提取方法各有优劣。超声波提取法、微波提取法和亚临界提取法均需要使用特殊的设备且物料受热不均匀,易影响多糖生物活性[13];酶辅助提取法中的酶活性易受提取条件影响,提取工艺条件较复杂[14];热水浸提法具有提取工艺简单、成本低、提取条件易控制、不易破坏多糖结构、无需特殊设备等优点。基于热水浸提法的上述优点,同时由于鲜见响应面法优化热水浸提法提取党参多糖的研究报道,本文利用响应面法中的Box-Benhnken 试验设计对党参多糖热水浸提提取工艺条件进行优化,同时研究其体外抗氧化活性,为党参多糖的有效提取提供理论依据,同时促进党参多糖的开发利用。
1 材料与方法
1.1 党参和主要试剂
党参,购自于甘肃省定西市漳县;1,1-二苯基-2-三硝基苯肼(DPPH),购自美国Sigma公司;铁氰化钾、苯酚、浓硫酸、乙酸钠等均为分析纯,购自国药集团化学试剂有限公司。
1.2 党参多糖含量测定
1.2.1 标准曲线绘制
无水葡萄糖于105 ℃下烘干至恒重,精密称定10 mg于100 mL容量瓶中,蒸馏水溶解并定容,备用。精密量取上述葡萄糖溶液0.4、0.8、1.2、1.6、2.0、2.4 mL于20 mL容量瓶中补充蒸馏水至体积为4.0 mL,各容量瓶中分别加入6%的苯酚溶液2.0 mL,摇匀后加入10.0 mL浓硫酸,摇匀,作为标准曲线系列溶液。同法以蒸馏水代替葡萄糖溶液平行配制1份空白溶液,各溶液于室温下静置25 min。以空白溶液作为对照,标准曲线系列溶液于490 nm波长处测定吸光度。
1.2.2 党参多糖含量测定
精密称定10 mg党参粗多糖样品于100 mL容量瓶中,以蒸馏水溶解并定容。精密量取党参多糖溶液0.1 mL于25 mL的容量瓶中,蒸馏水稀释100倍,加入6%的苯酚溶液2.0 mL,摇匀后加入10.0 mL浓硫酸,摇匀,以空白溶液作为对照,于490 nm波长处测定吸光度,根据下列公式计算党参多糖含量。
式中,W:党参多糖含量;c:葡萄糖质量浓度(μg/mL);n:溶液稀释倍数;f:转化系数0.9;m:党参多糖样品质量(μg)。
1.3 党参多糖提取
干燥的党参根粉碎后蒸馏水浸泡12 h,在适当的提取温度、提取时间、料液比及提取次数条件下进行提取,于3 000 r/min离心10 min收集上清液,冷冻干燥得党参多糖。党参多糖得率=党参多糖质量(g)/党参根粉末质量(g)×100%。
1.4 党参多糖提取条件单因素试验
在提取温度为80 ℃、料液比为30、提取1次的条件下考察不同提取时间(1.5、2.5、3.5、4.5、5.5 h)对党参多糖得率的影响;在提取时间1.5 h、料液比为30、提取1次的条件下考察不同提取温度(60、70、80、90、100 ℃)对党参多糖得率的影响;在提取时间1.5 h、提取温度80 ℃、提取1次的条件下考察不同料液比(10、20、30、40、50 mL/g)对党参多糖得率的影响;在提取时间1.5 h、提取温度为80 ℃、料液比为30 mL/g的条件下考察不同提取次数(1、2、3、4、5)对党参多糖得率的影响。
1.5 响应面法优化党参多糖提取工艺
在单因素试验基础之上,同时根据Box-Behnken中心组合试验设计原理,选取提取时间(A)、提取温度(B)和料液比(C)为试验自变量因素,以提取率(Y)为响应值,设计3因素3水平的响应面试验方案,见表1。按照1.3项下提取方法,根据表1试验方案的提取温度、提取时间和料液比条件下对党参进行提取。
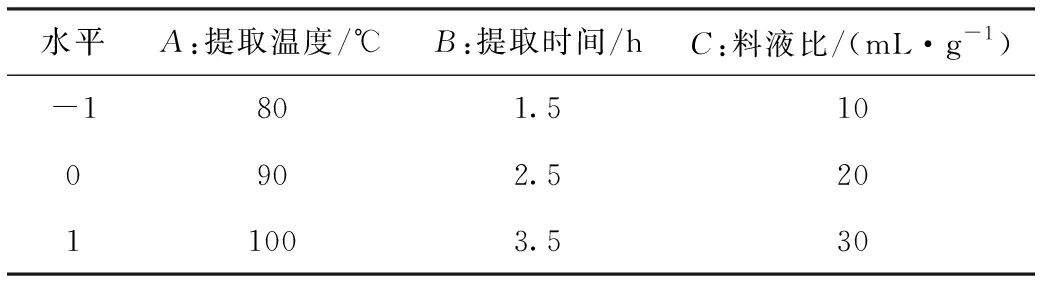
表1 响应面试验方案
1.6 党参多糖体外抗氧化活性
1.6.1 清除DPPH自由基能力
参考Shimada 等[15]的方法并进行改进。分别配制浓度为0.25、0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的党参多糖水溶液,与等体积的0.15 mmol/L 的DPPH无水乙醇溶液混合,摇匀后避光条件下37 ℃ 水浴30 min,以无水乙醇作对照,在517 nm波长处测定吸光度值。
1.6.2 党参多糖清除羟基自由基能力
参照Adid等[16]的方法并适当改进。分别配制浓度为0.25、0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的党参多糖溶液2 mL于试管中,分别等体积加入6 mmol/L 的FeSO4溶液,6 mmol/L的H2O2溶液,摇匀并静置10 min后加入6 mmol/L的水杨酸溶液2 mL,混合均匀后静置30 min。同样方法分别用蒸馏水代替水杨酸和党参多糖溶液配制对照溶液和空白对照溶液。以蒸馏水为空白于510 nm波长处测定样品溶液、对照溶液和空白对照溶液吸光度,并根据下式计算党参多糖羟基清除率。

式中,A样品:样品溶液吸光度;A对照:对照溶液吸光度;A空白对照:空白对照溶液吸光度。
1.6.3 党参多糖还原力
参照Oyaizu等[17]的方法,采用铁氰化钾法测定党参多糖还原力。分别配制浓度为0.25、0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的党参多糖溶液,分别取各浓度党参多糖溶液2.5 mL于10 mL离心管中,加入浓度为0.2 mol/L、pH值6.6磷酸缓冲液2.5 mL 和1%铁氰化钾溶液2.5 mL,摇匀,置于50 ℃水浴条件下反应20 min后,加入10%三氯乙酸溶液2.5 mL,于5 000 r/min条件下离心10 min,吸取上清液5 mL于10 mL离心管中,加入0.1%FeCl32.5 mL,摇匀后静置10 min。以蒸馏水代替FeCl3同样条件下配制空白溶液,于700 nm波长处测定吸光度。根据下式计算党参多糖还原力:
还原力=A0-A1,
式中,A0:样品吸光度;A1:空白溶液吸光度。
1.7 数据分析
利用Design-Expert.V.8.0.6进行响应面分析,利用Microsoft Excel 2016进行数据处理和分析。
2 结果与分析
2.1 标准曲线的绘制
根据试验结果进行线性回归,得到的标准曲线方程为Y=683.2X-0.0725,R2=0.997,在0.2~1.2 mg/mL范围内线性关系良好,可用于多糖含量测定。
2.2 党参多糖提取条件单因素试验
提取时间:由图1A可见,在1.5~2.5 h时,随着提取时间的延长,党参多糖得率增加,2.5 h后曲线趋于平缓,多糖得率无显著增加。因此选择1.5、2.5和3.5 h这3个水平进行响应面试验。
提取温度:由图1B可见,提取温度60~90 ℃时,多糖得率持续增加,温度超过90 ℃后多糖得率几乎没有变化。因此选择80、90和100 ℃这3个水平进行响应面试验。
料液比:由图1C可知,料液比为10~20 mL/g时,党参多糖得率快速增加,继续增大料液比,党参多糖得率基本保持不变。因此选择料液比为10、20和30 mL/g这3个水平进行响应面试验。
提取次数:由图1D可知,提取次数对党参多糖得率无明显影响,为提高提取效率,将提取次数固定为1次。

图1 提取时间(A)、提取温度(B)、料液比(C)和提取次数(D)对党参多糖得率的影响
2.3 响应面法优化党参多糖提取工艺
2.3.1 模型的建立与检验
以提取时间(A)、提取温度(B)、料液比(C)为变量,党参多糖提取率(Y)为考察指标,利用Design-Expert.V. 8.0.6.1软件中Box-Behnken组合设计法进行3因素3水平的响应面优化试验结果见表2。
2.3.2 党参多糖提取率响应面回归模型的建立及显著性分析
利用Design-Expert.V. 8.0.6.1软件对表2试验结果进行拟合,得到拟合模型公式为:Y=15.4-0.87A-0.49B+1.69C-0.2AB-0.84AC+0.83BC-2.81A2-0.84B2-2.41C2,对建立的党参多糖提取率响应面回归模型进行方差分析,结果见表3。模型的F值和P值分别为20.21和0.000 3,P<0.05达到显著水平,方差分析模型失拟项P=0.201 7>0.1,表明模型失拟不显著,建立的二次模型可用以分析和预测党参多糖提取率,可信度较高。相关系数R2=0.962 9,拟合模型的调整R2(AdjR2)=0.915 3,两者较接近,说明该模型预测情况与实际情况接近,拟合度良好。表3中对回归模型系数的显著性结果分析显示,一次项A、C以及二次项A2、B2系数的显著性均小于0.05,对提取率影响显著,表明A、C是党参多糖提取过程中的重要影响因素,A2、B2对最终结果影响显著,而交互作用系数均大于0.05,表明交互作用关系相对较弱,对最终结果无显著影响。3个影响因子对党参多糖提取的影响大小顺序为C(料液比)>A(提取时间)>B(提取温度)。

表2 响应面优化试验结果
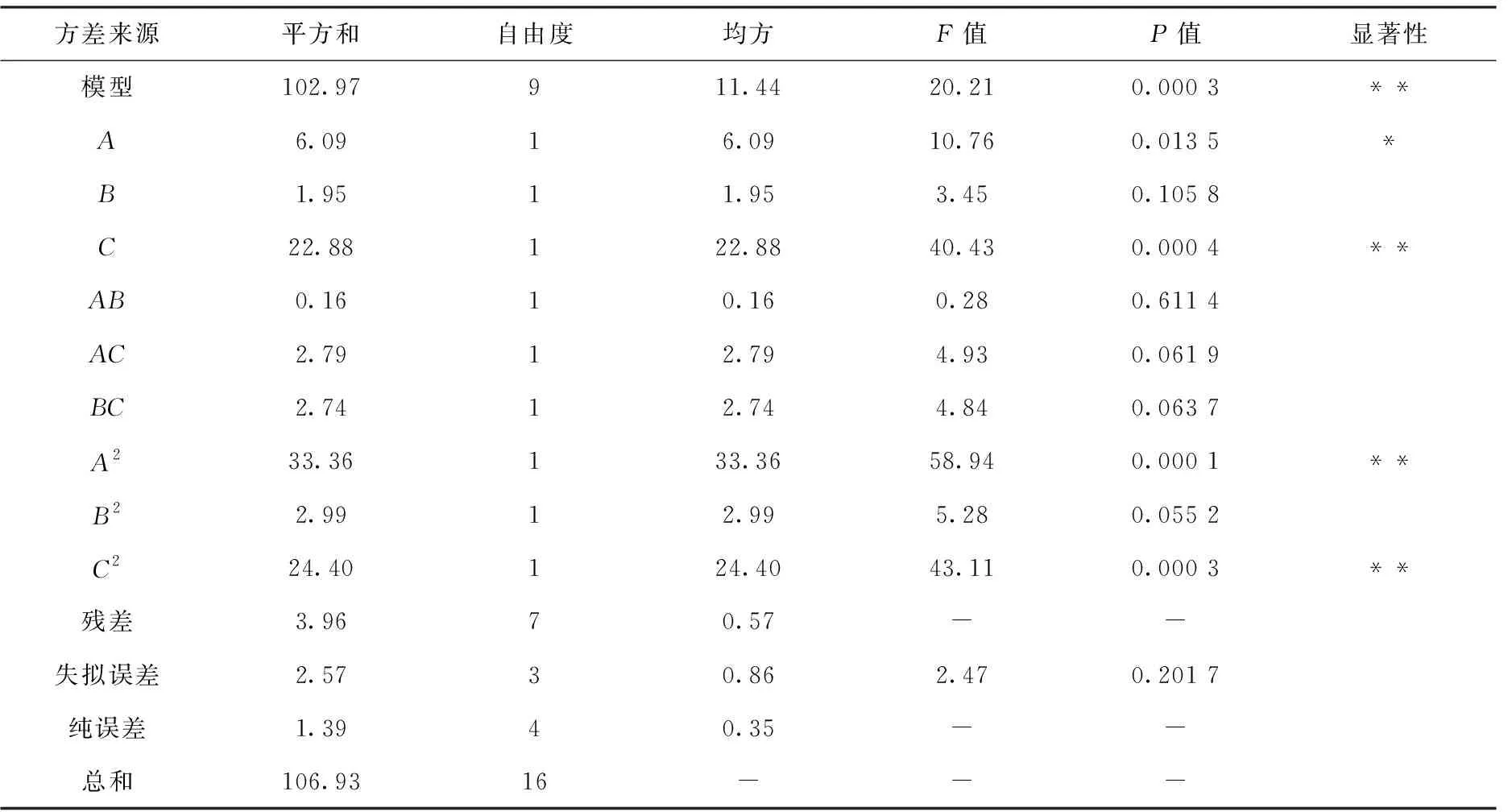
表3 响应面回归模型方差分析
2.3.3 党参多糖提取等高线图和三维响应面图分析
各因素交互作用等高线及响应面如图2。各因素交互作用越显著则等高线形状越接近于椭圆形,而交互作用越不显著则等高线形状越接近于圆形[18]。由图2以看出AB、AC、BC的交互作用等高线均呈椭圆形,但AC和BC交互作用形成的椭圆形趋势更明显,说明AC和BC交互作用更显著,这与方差分析结果一致,AC和BC交互作用的P值分别为0.061 9和0.063 7,接近显著水平。响应面坡度越陡,说明条件改变对响应值影响越大,由图2可见,党参多糖的提取率随着料液比和提取时间的降低先缓慢增加,到达最高点后急剧下降,形成较陡的坡度,说明提取率对料液比和提取时间的改变较为敏感,这与方差分析结果相一致。

图2 交互作用对党参多糖提取率的影响
2.3.4 验证试验
根据响应面法建立的模型预测党参多糖最佳提取工艺条件为:提取时间2.29 h、提取温度89.14 ℃、提取料液比23.72 mL/g,在此条件下党参多糖的提取率预测值为15.83%。为验证所建立模型的可靠性,根据操作的可行性对预测工艺条件稍作调整:提取时间2.3 h、提取温度89 ℃、提取料液比24 mL/g。在调整后的工艺条件下进行提取试验,平行提取3次,测得党参多糖的提取率为(15.66±0.04)%,与模型预测值较为接近,说明优化方法及建立的模型可靠,预测性良好。
2.4 党参多糖抗氧化性
2.4.1 清除DPPH自由基能力
由图3可知,VC对DPPH的清除作用强于党参多糖。党参多糖对DPPH的清除作用呈浓度依赖型,在0.25~4.0 mg/mL范围内随着浓度的升高清除作用增强显著,质量浓度大于4.0 mg/mL后,清除作用增强缓慢,浓度在8.0 mg/mL清除率在90%以上,接近于VC对DPPH的清除作用。对试验结果进行线性拟合得出回归方程为:Y=20.539lnX+51.393,R2=0.990 8,根据回归方程计算出党参多糖对DPPH半清除率IC50为0.93 mg/mL。

图3 党参多糖对DPPH自由基清除率
2.4.2 党参多糖清除羟基自由基能力
由图4可知,在0.25~8.0 mg/mL范围党参多糖对羟基自由基清除能力随着浓度的增大而增大,当质量浓度为8.0 mg/mL时,清除率达到86.88%,对试验结果进行线性拟合得出方程为:Y=5.7324X+46.276,R2=0.969 1,根据方程计算出党参多糖对羟基自由基的半清除率IC50为 0.65 mg/mL。

图4 党参多糖对羟基自由基清除率
2.4.3 党参多糖还原力
还原力测定可以作为评价氧化还原活性的重要指标,还原剂可以通过自身的还原能力清除自由基,将Fe3+还原为Fe2+,再进一步与FeCl3发生反应,生成在700 nm波长处有吸收的产物,还原力越强则吸光度越大。由图5可知,党参多糖还原力远弱于VC,但其还原力与自身浓度呈正相关,相关系数为0.97,当浓度为8.0 mg/mL时,还原力达到0.85。

图5 党参多糖还原能力
3 讨论
植物多糖是一类极性较强的大分子化合物,种类繁多,结构复杂,主要存在于细胞壁中,且易溶解于水中,不溶解于有机溶剂,故在植物多糖的提取中多以水作为溶剂,通过加热的方法加速多糖的释放,但提取温度、提取时间、料液比等因素对多糖提取率影响较大,合理的热水浸提提取条件可以有效提高多糖的提取率。利用酸、碱、酶、超声、微波等手段可有效破解细胞壁从而有效提取植物多糖,但这些方法同时会引起多糖的降解、分子结构改变等。本研究利用热水浸提法,在单因素试验基础上确定了响应面法关键因子及水平,并根据Box-Behnken 原理设计3因素3水平试验方案,通过响应面分析法对党参多糖提取工艺进行优化,在提取时间2.3 h、提取温度89 ℃、提取料液比24 mL/g的条件下,党参多糖的提取率为(15.66±0.04)%,与模型预测值较为接近,说明优化方法及建立的模型可靠,预测性良好。郜普源等[19]采用响应曲面法优化贵州木霉 NJAU4742 产木聚糖酶,优化后胞外蛋白产量提高了1.5倍,而木聚糖酶产量提高了1.25 倍,说明该方法对于优化菌株产酶也是有效的。
不同提取方法获得的多糖抗氧化活性存在一定差异,多种检测方法可系统反映抗氧化情况,自由基的清除能力和还原力测定是体外抗氧化能力评价中广泛采用的评价指标。本试验组合了不同体外检测方法,获得了党参多糖清除DPPH自由基能力、清除羟基自由基能力和还原力。党参多糖对DPPH自由基和羟基自由基有较强的清除能力,对2种自由基的半清除率IC50分别为0.93 mg/mL和0.65 mg/mL。当党参多糖浓度达到8.0 mg/mL时清除率达到90%以上和86%以上;而还原力与自身浓度呈正相关,当浓度为8.0 mg/mL时,还原力达到0.85。综上,党参多糖具有良好的抗氧化活性,后续试验将进一步对党参多糖进行纯化分离,深入研究其结构及药用价值。
