抗磺胺二甲氧嘧啶VHH抗体噬菌体库的构建和鉴定
2021-01-08贺东阳张齐张星星钟发刚张小莺王金泉
贺东阳,张齐,张星星,钟发刚,张小莺,3,王金泉
(1. 新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2. 新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子 832000;3. Department of Biomedical Sciences, Ontario Veterinary College, University of Guelph, Ontario N1G2W1,Canada)
磺胺二甲氧嘧啶(sulfadimethoxine, SDM)是一种磺胺类兽用抗生素,并具有一定毒性作用[1]。由于SDM抗菌谱广且成本低廉,所以在治疗和预防动物传染病方面的应用极其广泛,然而大量使用磺胺类兽用抗生素会导致动物体内以及食品中抗生素药物残留,过度摄入可能会引起过敏、造血系统功能障碍、急性溶血性贫血等不良症状,给食品安全带来潜在的隐患[2]。世界各国针对SDM在不同的动物性食品中的最高残留限量(maximum residue limit, MRL)给出了明确的规定,我国SDM在牛、山羊、猪、家禽肌肉中MRL限量为100 μg/kg,肝、肾和脂肪中为100 μg/kg,牛和羊乳中为25 μg/kg;欧盟(EU)设定了磺胺类药物在肉类、牛奶和鸡蛋等动物源性食品中的MRL为100 μg/kg[3];日本规定动物源性食品中单个磺胺类药物的MRL不超过20 μg/kg;英、美等国家规定肉品中磺胺类药物的MRL为100 μg/kg[4]。SDM在动物源性食品中的残留问题与食品安全关系密切,并受到人们广泛关注。
传统的药物残留分析主要是利用色谱技术和免疫检测等方法进行定性定量分析[5]。色谱方法结果准确、灵敏,但局限在于待检样品需经一系列的预处理,繁琐费时;此外色谱仪器价格昂贵,只有专业人员才能应用,临床难以推广[6]。免疫学方法是一种基于抗原抗体特异性结合而建立起来的方法。目前,国内外检测磺胺类抗生素残留主要基于多克隆抗体或小鼠杂交瘤细胞的单克隆抗体。多克隆抗体操作规程相对繁琐,耗时长,检测灵敏度不高,有时容易出现假阳性结果,且由于多克隆抗体具有多个抗原表位,特异性较低,检测过程中容易出现偏差;单克隆抗体虽然特异性较好,但是生产周期长,成本较高[7]。
近年来,基因工程抗体发展迅速,越来越受到科研工作者的青睐,抗体小型化是基因工程抗体的一个主要研究趋势。驼源重链单域抗体(variable domain of heavy chain of heavy-chain antibody, VHH)为骆驼科(骆驼、羊驼或美洲驼)及鲨鱼体内存在的天然缺失轻链的单链抗体,由3个互补决定区(complementarity determining regions, CDRs)构成,其晶体结构呈椭圆形,直径为2.5 nm,长为4 nm[8]。纳米抗体的优势在于具有更长的CDR3区、体积小、稳定性高、水溶性好、可在微生物系统中大量合成表达,已被广泛应用于食品安全检测及临床诊断[9]。本试验采用人工合成的免疫原(sulfadimethoxine-albumin bovine serum, SDM-BSA)免疫骆驼,构建抗SDM驼源纳米抗体库,以期为动物源性食品中SDM的残留检测提供一种新的方法。
1 材料与方法
1.1 试验动物和试剂
健康新疆双峰骆驼,由新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室提供;弗氏完全/不完全佐剂(FCA/FIA)(Sigma公司,美国);牛血清白蛋白(BSA)、卵清蛋白(OVA)、N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、四甲基联苯胺(TMB)、二甲基亚砜(DMSO)和RNA Simple Total RNA Kit (天根生物科技公司,北京);胶回收试剂盒、Axygen Mini Prep质粒小量抽提试剂盒(Omega生物科技有限公司,美国);RNA反转试剂盒(诺唯赞生物科技公司,南京);pCANTAB-5E噬菌体载体、限制性内切酶SfiⅠ、T4连接酶、DNA Marker、辅助噬菌体M13K07(NEB公司,美国);TRYPTONE、YEAST EXTRACT(OXOID公司,英国);SDM(国家标准物质中心);HRP标记抗M13抗体(Sigma公司,美国)。
1.2 引物设计
参考双峰驼VHH基因序列,利用Primer Premier 5.0软件设计引物,引物序列如表1所示。

表1 文库构建所用引物
1.3 磺胺二甲氧嘧啶人工抗原的合成及动物免疫
①A液制备:称取50 mg BSA溶于2 mL的1 mol/L Na2CO3中冰浴;②B液制备:称取33.2 mg SDM溶于3 mL 1 mol/L HCl中,完全溶解后冰浴15~30 min;③C液制备:称取10 mg亚硝酸钠溶于1 mL蒸馏水中冰浴;④D液制备:将C液逐滴加入B液中,摇匀并置冰浴反应5 min,淀粉KI试纸进行检验,若变紫,则加少量尿素,直至不再变紫为止;⑤将D溶液逐滴加入A溶液中,反应过程中保持pH值为9,在4 ℃搅拌反应6 h后,用0.01 mol/L PBS透析3 d,每天换液2次,即制备得SDM-BSA。同理,按此方法制备(sulfadimethoxine-ovalbumin, SDM-OVA),合成的抗原经紫外光谱扫描鉴定后于-20 ℃保存[10]。将合成的人工抗原SDM-BSA与弗氏佐剂等比例混匀并充分乳化(初次免疫使用FCA,之后免疫使用FIA),采用背部皮下多点注射的方式免疫骆驼,共5次,免疫间隔时间为2周。
1.4 噬菌体库的构建与库容测定
分离骆驼外周血淋巴细胞,提取总RNA,反转录为cDNA,然后用套式PCR扩增出骆驼VHH基因片段。首先使用VHH-First-F、VHH-First-R上下游引物,以cDNA为模板进行PCR扩增,通过凝胶电泳切胶回收扩增片段,然后以回收产物为模板,用VHH-Second-F、VHH-Second-R为上下游引物进行PCR扩增,得到VHH基因片段。分别用SfiⅠ,NotⅠ限制性内切酶进行酶切获得的VHH片段和pCANTAB-5E噬菌体载体,用T4连接酶将VHH片段和pCANTAB-5E载体置于16 ℃连接过夜。将重组质粒转化到TG1大肠杆菌感受态细胞中,取少量菌液涂布于氨苄抗性的LB固体培养板,37 ℃培养过夜。次日计算库容量,随机挑选单克隆,进行PCR扩增,用1%琼脂糖凝胶电泳鉴定噬菌体展示文库的重组率。然后将从平板上刮下来的菌落用LB培养基重悬,此为噬菌体抗体库,噬菌体库经实验室前期鉴定,其库容为1.08×105CFU,阳性率为96.6%;挑单克隆生长的菌液测序,剩余菌液加入50%终浓度的甘油,分装冻存于-80 ℃。
1.5 生物淘选与噬菌体克隆的鉴定
1.5.1 SDM噬菌体抗体库生物淘选
接种至少10倍库容量的活细胞于100 mL 2×YT-GA培养基的三角瓶中,37 ℃、220 r/min振荡培养至OD600约为0.4~0.6。按细胞数∶辅助噬菌体=1∶20的比例加入M13K07辅助噬菌体,37 ℃静置15 min后,37 ℃、220 r/min继续振荡培养30 min,将上述培养物4 500 r/min离心15 min,收集菌体,用100 mL 2×YT-AK培养液重悬菌体,30 ℃,250 r/min振荡培养8 h;次日取出,10 000 r/min,4 ℃,离心15 min,收集上清,加入1/5体积的PEG/NaCl溶液,混匀后置于冰上放置8~10 h至絮状沉淀出现。
采用固相淘选方法对已构建的噬菌体展示纳米抗体库进行4轮淘选。具体方法如下:1~4轮包被抗原浓度依次分别为:150、75、37.5和18.75 μg/mL,以2% BSA作为第1、3轮封闭液,2% OVA作为第2、4轮封闭液,加入100 μL噬菌体抗体库至已封闭的酶标板孔中(滴度约1×1011CFU);PBST(含0.5% Tween-20)洗涤10次,PBS洗涤10次;再以50 μL Gly-HCl溶液(pH=2.2)洗脱特异性结合的噬菌体,加入50 μL Tris-HCl (pH=8.5)中和洗脱物。吸取10 μL洗脱物进行滴定,余下的洗脱物扩增后用于下一轮淘选。
1.5.2 噬菌体克隆的鉴定
采用phage ELISA方法鉴定筛选的克隆是否能特异性地结合SDM小分子。取10 μL第4轮洗脱库,用2-YT培养液梯度稀释后侵染TG1,然后涂布于氨苄抗性的LB固体培养板上,37 ℃培养过夜。次日,随机挑取一定数量的单菌落接种LB (Amp)液体培养基,37 ℃、220 r/min培养8 h,以1∶100的比例转接,继续培养至OD600为0.4~0.5,再加入M13KO7辅助噬菌体,37 ℃静置30 min,再将其置于37 ℃、220 r/min培养45 min。再加卡那霉素(终浓度为10 ng/mL),30 ℃恒温摇床,培养过夜,5 000 r/min离心5 min,收集上清液。将SDM-OVA包被原稀释成5 mg/mL,100 μL/孔,4 ℃包被过夜,PBST洗涤3次,PBS洗涤3次,随后加入2% BSA,100 μL/孔, 37 ℃恒温箱封闭2 h,再加入噬菌体上清液,100 μL/孔,37 ℃孵育40 min,加入HRP标记的抗M13抗体,37 ℃孵育40 min,TMB显色液孵育10 min,50 μL 2 mol/L H2SO4终止,测定450 nm处吸光度。
2 结果与分析
2.1 PCR扩增VHH基因片段
提取骆驼外周血淋巴细胞总RNA,经1%琼脂糖凝胶电泳分析可见2条清晰条带28S rRNA和18S rRNA(图1A)。
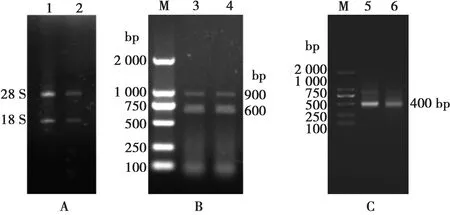
M. 2000 bp DNA Marker;1~2. 28S rRNA和18S rRNA;3~4. PCR第一轮扩增产物; 5~6. PCR第二轮扩增产物图1 套式PCR扩增VHH基因
以总RNA为模板,反转录为cDNA,用VHH-First-F、VHH-First-R上下游引物,以cDNA为模板,进行PCR扩增,通过琼脂糖凝胶电泳验证得到600 bp和900 bp的基因片段(图1B)。切胶回收600 bp基因片段并以此为模板,用VHH-Second-F、VHH-Second-R为上下游引物进行PCR扩增,得到400 bp VHH基因片段(图1C)。
2.2 噬菌体抗体库质量的鉴定
对随机挑取的11个转化后平板上的单菌落进行测序,用DNAMAN软件分析测序结果,序列之间显著不同,且序列符合VHH的典型特征(图2)。利用进化树系统对11个单菌落高变区氨基酸序列进行分析,其中VHH8噬菌体克隆菌落氨基酸序列与其他噬菌体克隆菌落氨基酸序列具有明显差别,氨基酸序列枝长各不相同,相似度各异(图3),证明了噬菌体抗体库具有良好的多样性。

注:黑色区域和灰色区域表示框架区域相同的氨基酸序列,方框中的氨基酸序列分别为CDR1、CDR2和CDR3可变区氨基酸序列图2 噬菌体展示纳米抗体氨基酸序列比对

图3 进化树分析噬菌体文库多样性
2.3 噬菌体库生物淘选
经过4轮生物淘选,噬菌体的回收率呈现增长的趋势,虽然在淘选过程中,第3轮的回收率有所波动,但结果表明噬菌体阳性克隆得到了富集,每轮淘选滴定结果如表2所示;每轮淘选都对洗脱库进行阳性克隆的鉴定,其结果如图4所示。对第4轮淘选的洗脱库进行滴定,挑取93个噬菌体克隆,采用phage ELISA方法进行鉴定,其中3、4、6、8、9、22、24、32、38等编号的噬菌体克隆对SDM具有明显的结合力(图5)。

表2 4轮生物淘选噬菌体库库容滴定

A.一级洗脱库;B.二级洗脱库;C.三级洗脱库;D.四级洗脱库;M. 2000 bp DNA Marker;1~20.各轮生物淘选随机挑取单个的噬菌体克隆菌落图4 4轮洗脱库阳性克隆PCR鉴定
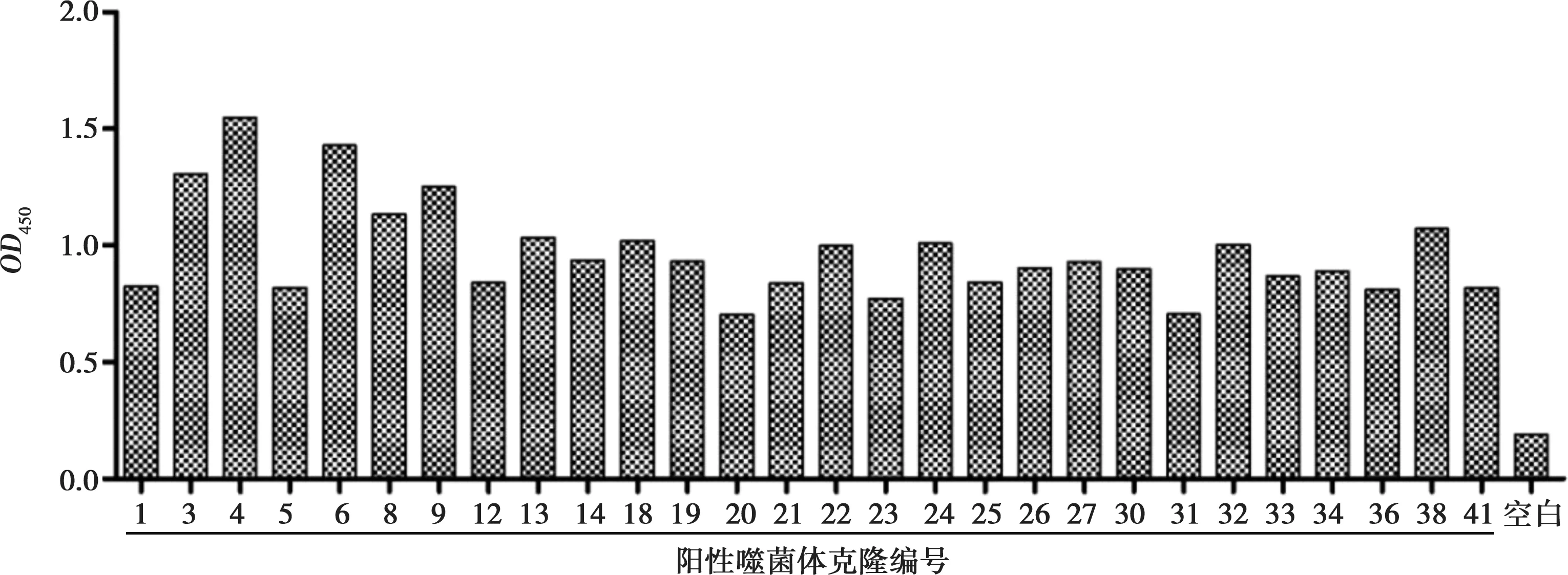
图5 噬菌体阳性克隆phage ELISA鉴定
3 讨论
本研究利用SDS-BSA人工合成抗原免疫双峰骆驼,扩增了骆驼重链抗体VHH基因, 建立噬菌体展示VHH免疫文库。本实验室前期初步测定库容量大小在1.08×105CFU,阳性率为96.6%。抗体库的库容量并不高,试验过程中在优化载体与目的基因片段连接的摩尔比时发现,在连接体系中有酶蛋白和缓冲液盐离子的存在,可能会影响和干扰连接产物的转化,使转化效率大大降低。尽可能减少对连接产物的干扰和基因片段的损耗,才能提高转化效率,使抗体库的质量得以明显的改善[11]。对于转化试验,目前应用最多的是电转化法和化学转化法,都是通过外部附加条件,改变细胞膜的通透性,实现转化的过程[12]。宋欢等[13]建库时优化连接体系,采用电转化的方法构建了针对猪繁殖与呼吸综合征病毒(PRRSV)非结构蛋白2 (Nsp2)的VHH噬菌体文库,其库容为6.5×107CFU;何雷等[14]针对中东呼吸综合征冠状病毒采用电转化法构建的噬菌体展示文库,其库容达到1.31×108CFU。相对于本试验所构建的抗体库,其库容提高了102~103倍,由此也印证了电转化法效率比化学转化法效率要高很多。尽管如此,仍然有许多因素会影响转化效率,VHH基因的多样性、感受态细胞的质量、转化时转化条件的优化等都会对构建抗体库的质量产生重大的影响[15]。
本研究采用了固相淘选方法对构建的SDM驼源纳米抗体库进行筛选。每轮筛选时,封闭液的交替使用、噬菌体投入量、洗脱液中Tween-20的含量、洗脱结合的时间及洗脱的次数等众多因素都有可能影响淘选结果[16]。抗体库中包含的特异性噬菌体克隆的亲和力不尽相同,在整个淘选过程中,逐轮增加洗涤的次数及Tween-20的含量,并逐次降低包被抗原的浓度,从而逐轮增加淘选的严苛度,以期获得高特异性的重组噬菌体。但是也并非严苛度越高,就能筛选到高特异性的噬菌体克隆,这样可能会造成特异性的噬菌体克隆的丢失,所以合理地控制淘选的严苛度,才能保障筛选出高亲和力的噬菌体。Alshamat等[17]构建的纳米抗体库库容为5×108CFU,阳性率为95.6%,进行3轮生物淘选使阳性克隆噬菌体得到明显富集;而本试验则采用了4轮生物淘选。生物淘选的轮数视试验的具体情况而定,确保阳性克隆噬菌体得到有效、更好地富集。
4 结论
本研究构建了抗SDM驼源纳米抗体库并对所构建的抗体库进行4轮生物淘选,最终获得了对SDM具有明显结合力的阳性克隆噬菌体。试验不仅为下游产品的开发奠定了良好的基础,同时也为SDM在动物源性食品中的残留检测方法提供了相应的参考,其应用前景十分广阔。
