有氧运动通过SIRT1/NF-ΚB信号通路改善睡眠剥夺大鼠的学习记忆
2021-01-07叶南邵玉萍
叶南,邵玉萍
1.湖北中医药大学基础医学院,老年医学研究所,湖北武汉430065;2.湖北中医药大学体育健康学院,湖北武汉430065
有氧运动作为一种简单方便的预防性手段,能有效改善认知障碍患者和健康人群的认知功能和学习记忆能力[1-2],能增强海马的增殖能力、提高神经可塑性和改善神经炎症。研究表明,老年人进行规律长期的有氧运动能改善其认知功能,降低老年痴呆的风险。阿尔兹海默症(Alzheimer's disease,AD)是以进行性认知功能障碍为特征的一种老年痴呆,会引起神经炎症和突触丢失,是临床最常见的一种慢性神经退行性疾病[3]。有氧运动[4]能显著改善AD 患者的认知功能,延缓相关的认知功能衰退。睡眠障碍会损坏海马记忆的形成和巩固,诱发免疫炎症反应,对认知功能和整体健康有不良影响[5]。研究表明,4 周跑台运动可预防急性睡眠剥夺引起的炎症反应及学习记忆的损伤[6],逆转由睡眠剥夺引起的认知功能下降[7],故本实验采用有氧运动作为干预方式。
在炎症反应中,沉默信息因子2 相关酶1(silent mating type information regulation 2 homolog1,SIRT1)/核因子B (nuclear factor-kappa-B,NF-ΚB)信号通路起到关键作用[8],SIRT1 可通过抑制NF-ΚB信号降低炎症反应,调节炎症因子TNF-α 、IL-6 的表达,发挥保护学习记忆的作用。因此,本实验通过构建睡眠剥夺模型并给予运动预干预,探究SIRT1/NFB 信号通路及相关炎症因子调节睡眠剥夺引起的炎症反应的具体作用机制,为有氧运动防治认知功能及学习记忆损伤提供一定的理论和研究依据。
1 材料与方法
1.1 动物分组及处理 SPF 级2月龄雄性SD 大鼠40只,体重180±20 g,由湖北省实验动物研究中心提供,许可证号:SCXK (鄂) 2015-001。将40 只大鼠随机分成空白对照组(CON)、完全睡眠剥夺组(TSD)、有氧运动组(EX)和运动+完全睡眠剥夺组(EX+TSD),每组10 只。动物分笼饲养,自由饮食,自然光照。
1.2 试剂及仪器Trizol,Ambion;HiScript Reverse Transcriptase (RNase H)、5×HiScript Buffer,VAZYME;SYBR Green Master Mix,VAZYME;BCA蛋白浓度测定试剂盒。自制睡眠剥夺箱,Morris 水迷宫,QuantStudio 6 实时荧光定量PCR 仪,Nano-100微量分光光度计,EDC-810 PCR 仪,DYCZ-24DN 垂直电泳槽,DG-3022A 酶标仪,HI650 离心机。
1.3 运动方案采用跑台运动方案[9],使用计算机控制的六道动物跑台,为减少非特异性应激反应,正式训练前EX 组及EX+TSD 组进行3 d 适应性跑台训练,每天训练10 min。正式跑台训练时间为4 周,跑台坡度保持为0°,速度均为15 m/min,第1 周和第2 周每天进行30 min的跑台运动,第3 周每天进行45 min的跑台运动,第4 周每天进行60 min 的跑台运动,每运动15 min 后休息5 min。
1.4 模型建立在跑台运动结束之后的第2 天,TSD 组、EX+TSD 组的大鼠采用多平台水环境法进行72 h 的连续睡眠剥夺,建立大鼠完全睡眠剥夺模型。自制睡眠剥夺鼠箱(70 厘米×50 厘米×30 厘米),将连体并且呈2×3 排列的圆形小平台(高8.0 厘米,直径7.0 厘米) 置于睡眠剥夺箱内,箱内注水至水位在圆形平台以上1 厘米。大鼠进入快速眼动睡眠阶段后,会因为骨骼肌的张力下降,引起大鼠触落入水而惊醒。在正式睡眠剥夺实验开始前,需让大鼠适应小平台3 d,每天进行1 h。
1.5 Morris 水迷宫实验跑台运动结束1 d 后开始Morris 水迷宫测试,Morris 水迷宫分为空间探索实验以及定位航行实验,实验设备由圆形水池(直径100 厘米,高80 厘米)、可移动大鼠站台(直径10 厘米,高30 厘米)、影像收集及分析系统等部分组成。实验时圆池水面需没过大鼠站台1-2 厘米,水池分成4 个象限,将站台放入第一象限定为目标象限。Morris 水迷宫共进行7d,前5 d 为空间探索实验,将大鼠从第三象限的中间点面朝着水池的池壁放入到水池中,如果大鼠在60 秒的时间内未找到站台,则将大鼠引到站台上停留10 s,统计大鼠上平台潜伏期,游泳总路程。第6 天休息,第7 天撤取平台后开始定位航行实验,记录大鼠60s 内初次抵达平台时间和目标象限停留时间,评价睡眠剥夺和跑台运动对学习记忆的影响。
1.6 动物取材及处理 行为学实验结束之后,将大鼠麻醉处死,放置在冰上迅速剥离大脑,取出海马,置于做好标记的冻存管中,置于-80℃冰箱中保存。
1.7 Real-Time PCR 检测TNF-α 和IL-6mRNA 的表达水平 取出海马组织置于匀浆器中,用Trizol 法提取海马总RNA,然后用逆转录试剂盒,将总mRNA 逆转录为cDNA 后进行扩增,具体实验步骤参照试剂盒的说明书。RT-PCR 扩增条件为:95℃15 s,60℃60 s,95℃15s,共进行40 个循环,于65~95℃绘制溶解曲线,采用2-△△Ct值进行数据分析。使用HiScript Reverse Transcriptase (RNase H)(VAZYME,中国)和SYBR Green Master Mix(VAZYME,中国)试剂盒进行逆转录和qPCR 反应。引物序列及扩增长度见表1。
1.8 Western-Blotting 法检测海马SIRT1 和Ac-NF-ΚB P65 蛋白表达水平 取大鼠海马组织裂解液置于自动匀浆机中进行裂解研磨后,提取海马总蛋白,蛋白浓度的测定采取BCA 法。将提取的蛋白上清与5×上样缓冲液混合后进行沸水浴,变性完成后冷却至室温放入-80℃保存备用。制备分离胶和浓缩胶,将制备好的蛋白样品加入到上样孔中进行电泳至溴酚蓝到凝胶底部。电泳结束后取出凝胶进行转膜。转膜完成后用含5% 脱脂奶粉的TBST(封闭液)浸泡PVDF 膜,室温摇床封闭2 h,一抗兔抗GAPDH (1∶1000)、鼠抗P65(1∶1000)、兔抗ac-p65(1∶1000)、兔抗Sirt1(1∶1000)4℃孵育过夜,充分洗膜,二抗(1∶50000)室温摇床孵育2h,洗膜5 次。使用ECL试剂化学显色拍照。
1.9 免疫荧光染色 检测海马中SYN 和PSD95 蛋白表达水平海马组织爬片用4%多聚甲醛固定,取出切片入PBS 浸泡,山羊血清封闭,加入一抗兔抗PSD95(1∶200)和兔抗SYN(1∶200),4℃孵育过夜,PBS冲洗3 次后加入荧光二抗(1∶100)37℃孵育1 h,再用PBS 冲洗4 次,滴加DAPI 复染细胞核避光孵育5 min,PBS 洗去多余的DAPI,用含抗荧光淬灭剂的封片液封片,在荧光显微镜下采集图像。
1.10 统计学分析 数据采用SPSS20.0 软件进行统计分析。计量资料用均数±标准差(±s)表示,经正态性检验与方差齐性检验后,正态分布且方差齐性的计量资料,2 组间比较行独立样本t 检验,多组间比较采用单因素方差分析(One-way ANOVA),P<0.05 表示差异有统计学意义。
2 结果
2.1 有氧运动对睡眠剥夺模型大鼠定位航行实验的影响与CON 组比较,TSD 组大鼠的上平台潜伏期和游泳总路程延长(P<0.05);与TSD 组比较,EX+TSD组和EX 组上平台潜伏期减少(P<0.05),游泳总路程显著减少(P<0.01)。见图1。
2.2 有氧运动对睡眠剥夺模型大鼠空间探查实验的影响与CON 组比较,TSD 组大鼠目标象限停留时间减少(P<0.05),初次抵达平台时间显著延长(P<0.01);与TSD 组比较,EX+TSD 组和EX 组大鼠目标象限停留时间显著增加(P<0.01),初次抵达平台时间减少(P<0.05)。见图2。
2.3 有氧运动对炎症因子TNF-α 、IL-6mRNA 表达的影响与CON 组相比,TSD 组促炎因子TNF-α 、IL-6表达显著上调(P<0.01);与TSD 组相比,EX+TSD组促炎因子TNF-α 和IL-6 表达下调(P<0.05),EX组促炎因子TNF-α 、IL-6 表达显著下调(P<0.01)。见图3。
2.4 有氧运动对SIRT1、Ac-NF-ΚB P65 蛋白表达的影响与CON 组相比,TSD 组SIRT1 蛋白表达显著降低(P<0.01),Ac-NF-ΚB P65蛋白表达显著升高(P<0.01);与 TSD 组相比,EX+TSD 组 SIRT1 表达升高(P<0.05),Ac-NF-ΚB P65 蛋白表达下调(P<0.05),EX 组SIRT1 表达显著升高(P<0.01),Ac-NF-ΚB P65蛋白表达显著降低(P<0.01)。见图4和图5。

表1 引物序列

图1 定位航行实验结果
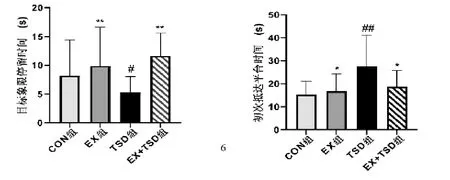
图2 空间探索实验结果
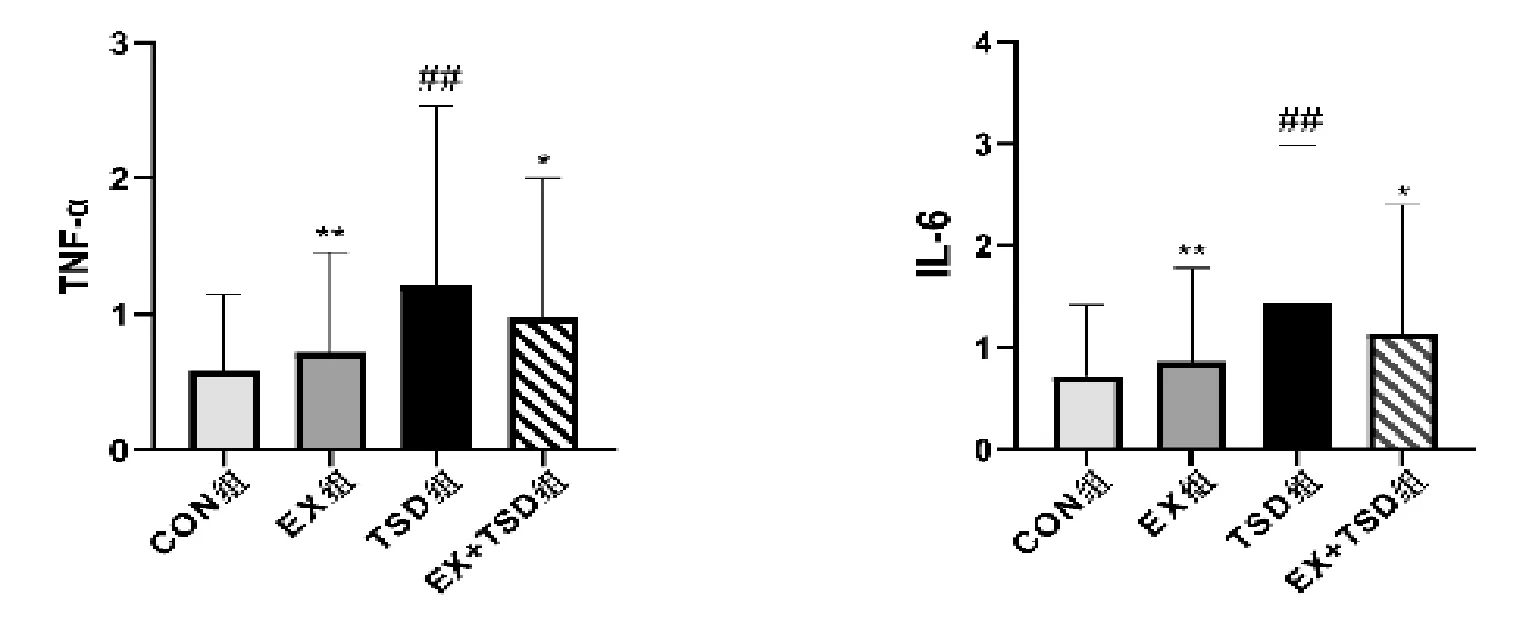
图3 大鼠海马中TNF-α 、IL-6mRNA 表达含量
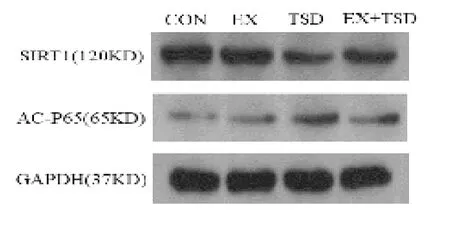
图4 大鼠海马SIRT1、Ac-NF-ΚB P65 蛋白表达电泳
2.5 有氧运动对PSD95、SYN 标记荧光蛋白表达的影响图中显红色为标记蛋白,蓝色为细胞核。与CON组相比,TSD 组大鼠海马中PSD95、SYN 的蛋白表达量降低,与TSD 组比较,EX 组和EX+TSD 组大鼠海马中PSD95、SYN 的蛋白表达量增加,见图6。
3 讨论

图5 大鼠海马中SIRT1、Ac-NF-ΚB P65 表达含量
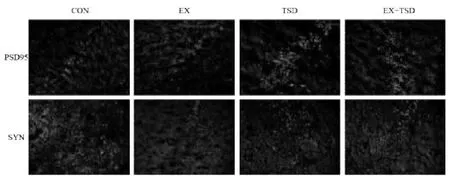
图6 有氧运动对睡眠剥夺大鼠海马PSD95、SYN 蛋白表达的影响(×400)
有氧运动是以大肌群进行中等强度,持续约0.5 h 以上的一种运动方式,能增强机体代谢能力,提高大脑血流量,改善心肺功能等,是降低认知功能损伤,预防和改善AD 有效手段[10]。经常运动的老年人患AD 的风险比不常运动的低40%[11]。认知功能属于海马的高级功能,海马是与认知功能和情绪调节相关的重要脑区,也是昼夜节律和学习记忆的整合体。睡眠影响学习与记忆的获取及回忆,但睡眠与海马神经发生及学习记忆之间的关系尚未完全明了。本研究发现,TSD 组大鼠的上平台潜伏期、游泳总路程、初次抵达平台时间显著延长,目标象限停留时间显著减少,表明睡眠剥夺会损伤大鼠的学习记忆。而经有氧运动预干预的EX+TSD 组、EX 组大鼠的上平台潜伏期、游泳总路程、初次抵达平台时间减少,目标象限停留时间显著增加,表明有氧运动能提高睡眠剥夺大鼠的学习记忆。
睡眠对认知功能健康非常重要,睡眠剥夺会引发炎症反应。TNF-α 、IL-6 是衡量炎症反应的关键指标,TNF-α 能诱导炎症因子IL-6 的产生和释放并加强炎症反应[12],本研究表明,TSD 组促炎因子TNF-α 、IL-6 mRNA 表达显著上调(P<0.01),说明睡眠剥夺会促使促炎因子TNF-α 和IL-6 的分泌,产生炎症反应。而经有氧运动干预后EX+TSD 组TNF-α 、IL-6表达下调,说明有氧运动能调控炎症因子TNF-α 和IL-6 的含量变化,在一定程度上预防和改善睡眠剥夺引起的学习记忆的损伤及炎症反应,逆转睡眠剥夺引起的短时记忆损伤。
睡眠剥夺会诱发炎症反应,NF-ΚB 抑制因子I B 的磷酸化会促使NF-ΚB 转位至细胞核,激活炎症反应。NF-ΚB 是TNF-α 、IL-6 等炎症基因的关键转录调节因子,NF-ΚBp65 赖氨酸位点K310 乙酰化能重点增强p65 与DNA 的结合能力,提高其转录激活的功能。NF-ΚB 的活化会促生炎性细胞因子,影响SIRT1 的活性。SIRT1 可直接作用于NF-ΚB 的p65亚单位,下调p65 的乙酰化程度,抑制I B 磷酸化和下游炎性因子IL-6、TNF-α 的转录[13],防止炎症引起的神经元损伤[14],减轻炎症反应。SIRT1 通过NFB 脱乙酰化产生抗炎作用,能预防NF-ΚB 的核易位和促炎基因的表达[15]。本研究表明,TSD 组SIRT1蛋白表达显著降低,Ac-NF-ΚB P65 表达显著升高,说明睡眠剥夺引起了炎症反应的发生;而EX+TSD 组海马中SIRT1 表达上调,Ac-NF-ΚB P65 的表达下调,说明有氧运动能促使SIRT1 活化,促进NF-ΚB P65脱乙酰化,减少Ac-NF-ΚB P65 和促炎因子的表达,进而调控炎症过程,改善睡眠剥夺引起的大鼠学习记忆损伤。
突触的可塑性是海马学习记忆的神经生物学基础。突触素( synaptophysin,SYN) 位于突触前膜,是突触前终末的特异性标志物,可间接反映突触密度和分布,主要调节神经递质的释放。突触后致密蛋白PSD95 位于突触后膜,是信息传递和记忆形成的主要场所,能维持突触的功能和形态。有研究采用免疫荧光对标志性蛋白PSD95 和SYN 进行检测,观察突触的功能损伤情况,发现有氧运动干预能够使SYP、PSD-95 的表达上调,改善大鼠的学习记忆能力[16]。本实验表明,TSD 组大鼠海马中PSD95、SYN 的蛋白表达量降低,说明睡眠剥夺会造成一定的突触损伤,而EX+TSD 组大鼠海马中PSD95、SYN 的蛋白表达量增加,说明有氧运动能改善睡眠剥夺引起的海马突触损伤。睡眠和记忆属于大脑基本的生理功能,可见,良好的睡眠能增强突触可塑性,有助于学习记忆能力[17]。
综上,睡眠剥夺能损伤学习记忆,而4 周的有氧运动能有效改善这种损伤,其机制可能通过调节SIRT1/NF-ΚB 信号通路及相关炎性因子的含量,改善由睡眠剥夺引起的大鼠学习记忆损伤。
