氨氯地平分散片的产业化研究
2021-01-06刘洪杰周鹏
刘洪杰, 周鹏
氨氯地平分散片的产业化研究
刘洪杰, 周鹏
(东北制药集团沈阳第一制药有限公司,辽宁 沈阳 110027)
由于氨氯地平在水中溶解度为微溶,极大程度地影响了其溶出效果,降低了生物利用度。本文将原料以微粉化的方式提高了氨氯地平的生物利用度,并以粉末直压的生产工艺直接制成氨氯地平分散片。并以性状、溶出度、有关物质、含量等一些列的关键质量参数对其进行了稳定性考察,稳定性存放的测试结果完全符合中国药典的要求。并按要求开展与原研品进行质量一致性评价,评价结果为相似。
氨氯地平;溶解度;微粉化
高血压是一种动脉血压升高,并且伴有心脏、血管、脑、肾等器官功能性或器质性改变的全身性疾病。氨氯地平在1992 年由 FDA 批准上市,商品名为“络活喜”[1-3],1993年进入中国市场,由大连辉瑞制药有限公司生产[4-8]。氨氯地平为二氢吡啶类钙通道阻滞剂,有苯磺酸盐、马来酸盐、甲磺酸盐几种盐型,氨氯地平的几种盐型可以互换,用于治疗高血压及冠心病。为提高自制马来酸氨氯地平分散片的质量,参照“仿制药质量一致性评价工作方案”和“普通口服固体制剂溶出度试验技术指导原则”,开展了适合产业化生产的马来酸氨氯地平分散片的处方优化。
1 仪器与试药
微晶纤维素,批号c2009022,眀台化工股份有限公司;菠萝香精,批号202006061,苏州禾田香料有限公司;交联聚维酮,批号191202;二氧化硅批号20191209,德国WACKER公司;RC1208D型溶出试验仪,天津市天大天发科技有限公司;安捷伦1260型高效液相色谱仪,美国安捷伦公司;氨氯地平对照品,批号100386-201703,中国食品药品检定研究院。
2 方法和结果
2.1 处方筛选
根据原研产品络活喜的处方组成,以交联聚维酮为崩解剂,以微晶纤维素为主要的填充剂,以二氧化硅为润滑剂,以橙子香精为矫味剂。以上所选用的微晶纤维素、联羧聚维酮、二氧化硅,菠萝香精均为口服级药用辅料。
原辅料相容性实验:跟据《化学药物制剂研究技术指导原则》《化学药物(原料药和制剂)稳定性研究技术指导原则》,考察氨氯地平的含量和有关物质。从表1中可以得出,原辅料在上述条件下各检测指标均符合标准要求且无增加趋势,相容性良好。

表1 原辅料相容性实验
2.2 处方用量筛选
参考原研品络活喜处方组成,设计自制品的片重约为0.560 g,采用微晶纤维素作为填充剂,由于氨氯地平原料微溶于水,前期采用微粉化碎前处理工艺处理,并以粉末直压的工艺进行制备,以片剂的外观、含量、分散均匀性、脆碎度、流动性和可压性作为考察指标,对处方量进行筛选,试验结果见表2。

表2 处方筛选试验结果
制备工艺:称取处方量的原料,将微粉化的原料过200目筛后备用。按照等量递加的原则逐步加入辅料混合,按理论片重粉末直压。

表3 处方筛选试验结果
通过以上的检测结果可以得出,随着联羧甲基纤维素钠用量的增加,片剂的溶散性增加,脆碎度变化不大,可压性更好,综合考虑各因素,处方3的工艺参数更好,所以选择处方3的用量作为本品的处方量。
2.3 稳定性试验考察
按以上优化后的处方3,自制3个批次的样品,在温度为40±2 ℃,湿度为RH 75%±5%进行加速试验,所自制的氨氯地平分散片采用双铝包装,结果见表4。

表4 氨氯地平片稳定性blxt-1批供试品加速试验数据表
2.4 溶出曲线考察
参照日本橙皮书收载的溶出方法:桨法,溶出介质体积900 mL,转速60 r·min-1,溶出介质为 0.01 mol·L-1盐酸溶液,依法操作,选取 5、10、15 、20、30 、60 min 时取溶液10 mL,过滤作为供试品溶液。结果:参比制剂和自制制剂在0.01 mol·L-1的盐酸溶液介质中15 min均大于85%,属速释制剂。参照《普通口服固体制剂溶出曲线测定与比较指导原则》比较被评价制剂与参比制剂的溶出曲线相似性结果,通常以非模型依赖法中的相似因子(f2)法。但由于参比制剂15 min的溶出量不低于85%,则无须比较f2,自制样品溶出15 min溶出量亦不低于85%,即认为相似。
从图1中可以看出,原研和自制制剂在15 min溶出量均已达到了85%,根据《普通口服固体制剂溶出曲线测定与比较指导原则》比较被评价制剂与参比制剂的溶出曲线相似性结果,通常以非模型依赖法中的相似因子(f2)法。但由于参比制剂15 min的溶出量不低于85%,则无须比较f2因子,自制样品溶出15 min溶出量亦不低于85%,即认为相似。所以自制的氨氯地平分散片与原研制剂体外溶出一致。
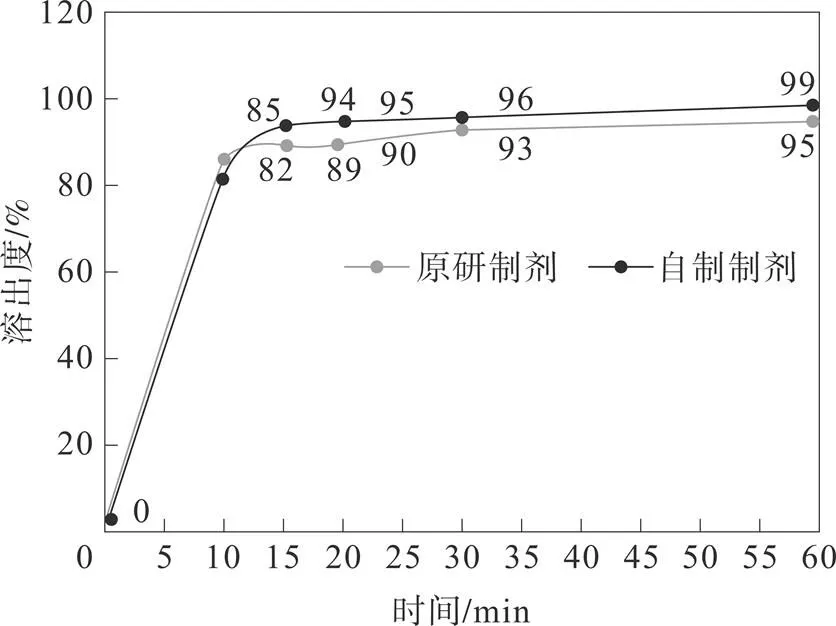
图1 溶出曲线相似性f2因子评价
3 结 论
1)通过对原料微粉化的前期处理,再增加有黏合剂之称的微晶纤维素,进一步提高了其制剂的溶散性。
2)应用粉末直压技术提高了生产工艺水平,减少了制粒、整粒和干燥等繁重环节。
3)自制的氨氯地平分散片的各项关键质量参数完全符合2015版药典的质量要求。
4)通过溶出曲线的考察,进一步的说明了自制制剂与参比制剂溶出行为一致性。
[1]杜芯瑜,崔鹏,潘金鹏,等.氨氯地平对高血压患者颈动脉粥样硬化的影响[J].临床医学进展,2019,9(11):1261-1265.
[2]杨亚梅,赵卫国,王宏业,等.平衡针灸联合左旋氨氯地平降压及纠正非杓型高血压的临床研究[J].中国中西医结合急救杂志,2020,27(5):582-585.
[3]王春燕,齐跃,任海霞.硝苯地平和氨氯地平治疗高血压的应用进展分析[J].健康必读,2020(28):114.
[4]宋宁宁.氯沙坦钾与氨氯地平治疗2型糖尿病合并高血压的临床疗效[J].中国保健营养,2020,30(30):259-260.
[5]樊会卒. 左旋氨氯地平治疗73例变异性心绞痛患者临床疗效分析[J].健康大视野,2020(23):18.
[6]汪云.苯磺酸氨氯地平和苯磺酸左旋氨氯地平治疗高血压的效果比较[J].中国当代医药,2020,27(21):130-133.
[7]闫丽.小剂量氨氯地平联合替米沙坦治疗老年高血压的效果分析[J].中国现代药物应用,2020,14(20):158-160.
[8]欧阳洪林,龚隆辉.苯磺酸氨氯地平联合氯沙坦钾治疗老年高血压的效果评估[J].基层医学论坛,2020,24(26):3767-3769.
Study on Industrialization of Amlodipine Dispersible Tablets
,
(Northeast Pharmaceutical Group Shenyang No.1 Pharmaceutical Co., Ltd., Shenyang Liaoning 110027, China)
The solubility of amlodipine in water is slightly soluble,which greatly affects its dissolution effect and reduces its bioavailability. In this paper, the bioavailability of amlodipine was improved in the form of ultrafine powder,and amlodipine dispersible tablets were directly prepared by the production process of powder direct compression. The stability was investigated by analyzing some key quality parameters, such as character, dissolution, related substances, content and so on. The test results of stable storage completely met the requirements of Chinese Pharmacopoeia. According to the requirements,the quality consistency evaluation with the original research products was carried out,and the evaluation results were similar.
Amlodipine; Solubility; Micronization
2020-10-24
刘洪杰(1982-), 女,辽宁省沈阳市人,中级工程师,研究方向:药学。
R972+.4
A
1004-0935(2020)12-1484-03
