GATA-3、AR在非三阴与三阴性乳腺癌中的表达及与临床病理特征的相关性
2021-01-05夏云陶珊珊桂星星瞿伟涂剑宏
夏云 陶珊珊 桂星星 瞿伟 涂剑宏

[摘要] 目的 探讨GATA结合蛋白3(GATA-3)、雄激素受体(AR)在非三阴性与三阴性乳腺癌中的表达差异及两者的表达与临床病理特征的关系。 方法 收集本院2019年1月至2020年12月确诊的200例乳腺癌患者,其中非三阴性(Non-TNBC)100例和三阴性(TNBC)100例,采用免疫组织化学法检测患者GATA-3、AR的表达情况,对比两者在非三阴性和三阴性乳腺癌中的表达差异及其与乳腺癌临床病理特征的相关性。 结果 非三阴性和三阴性患者的年龄、肿瘤大小、淋巴结转移、脉管转移等比较,差异均无统计学意义(P>0.05),与组织学分级呈相关性(P<0.05)。GATA-3在非三阴性的表达率为99%,在三阴性患者表达率为84%,差异有统计学意义(P<0.05)。AR在非三阴性乳腺癌的表达率为97%,在三阴性表达率为36%,差异有统计学意义(P<0.05)。 结论 GATA-3、AR在非三阴性乳腺癌患者的阳性表达率明显高于三阴性患者,三阴性乳腺癌患者组织学分级更高。
[关键词] GATA-3;AR;非三阴性乳腺癌;三阴性乳腺癌
[中图分类号] R737.39 [文献标识码] A [文章编号] 1673-9701(2021)31-0012-04
[Abstract] Objective To explore the differences in the expression of GATA-binding protein 3 (GATA-3) and androgen receptor (AR) in non-triple-negative and triple-negative breast cancer, and to investigate the correlation between their expressions and clinicopathological features. Methods A total of 200 breast cancer patients, including 100 non-triple negative(Non-TNBC) and 100 triple negative(TNBC) cases, admitted to our hospital from January 2019 to December 2020 were collected, and the expressions of GATA-3 and AR in patients were determined by immunohistochemistry. The differences between their expressions in non-triple negative and triple negative breast and their correlation with clinicopathological features of breast cancer were compared. Results There was no significant differences in age, tumor size, lymph node metastasis, and vasculature metastasis in the non-triple negative and triple negative patients(P>0.05).It showed the expressions were correlated to histological grade(P<0.05). The expression rate of GATA-3 in non-triple-negative patients was 99% and the expression rate in triple-negative patients was 84%,with statistically significant difference(P<0.05).The expression rate of AR in non-triple breast cancer was 97% and the expression rate in triple-negative patients was 36%, with statistically significant difference(P<0.05). Conclusion The positive expression rates of GATA-3 and AR are significantly higher in non-triple-negative patients than those in triple-negative breast cancer patients, and the histological grade of triple-negative breast cancer patients is higher.
[Key words] GATA-3; AR; Non-triple-negative breast cancer; Triple-negative breast cancer
乳腺癌是一種高度异质性肿瘤,在女性恶性肿瘤发病率中居第一位[1]。其中依据ER、PR、HER-2、Ki-67的表达,可被分为4种亚型:Luminal A型、Luminal B型、HER-2过表达型和三阴性乳腺癌,其中ER-、PR-、HER-2-即为三阴性乳腺癌。Burstein等[2]通过基因组分析,进一步将三阴性乳腺癌细分为腔型雄激素受体型(Luminal androgen receptor,LAR)、间质型(Mesenchymal,MES)、基底样免疫抑制型(Basal-like immune-suppressed,BLIS)、基底样免疫激活型(Basal-like immune-actived,BLISBLIA)共4个亚型[2]。基于抗雌激素治疗手段的广泛使用,ER及PR在乳腺癌中的作用已被深入研究。但另外一个重要的类固醇激素核受体,即雄激素受体(AR)也在不同分子分型乳腺癌中有不同程度的表达,但其在乳腺癌发生发展中所起的作用及机制还未阐明。三阴性乳腺癌具有侵袭性强、无靶向药物治疗、对激素不敏感、预后差、发病年龄轻、复发、转移率高、组织学分级高等特点,引起临床与病理的高度关注与重视,现报道如下。
1 资料与方法
1.1 一般资料
收集南昌市第三医院2019年1月至2020年12月诊断的乳腺癌患者,两位副主任医师复阅切片确认诊断无误。选取肿块切除标本中具有代表性的蜡块进行免疫组化检测。乳腺癌分子分型采用免疫组织化学替代分型,选择非三阴性乳腺癌(Non-TNBC)100例和三阴性乳腺癌(TNBC)100例,患者年龄23~89岁,所有患者临床资料完整,包括患者的年龄、肿瘤大小、组织学分级、淋巴结转移、脉管转移等。所有患者入院前均未进行任何形式的治疗。
1.2 方法
1.2.1 主要试剂 SP免疫组化试剂盒及DAB显色试剂盒均购自福州迈新生物技术开发有限公司;鼠抗人GATA-3、兔抗人AR购自河南赛诺特生物技术有限公司;HER-2抗体购自罗氏诊断公司;ER、PR、Ki-67抗体购自福州迈新生物科技开发有限公司。HER-2荧光原位杂交试剂盒购自武汉康录生物技术股份有限公司。
1.2.2 免疫组织化学检测 手术切除乳腺癌肿块组织标本,立即固定于10%中性缓冲福尔马林液内6~48 h,石蜡包埋组织,4 μm切片,60℃烤箱中过夜。采用非生物素二步法,结果采用DAB染色显色,实驗用阳性对照片做阳性对照,用PBS代替一抗做阴性对照。
1.2.3 荧光原位杂交(FISH)检测 如果HER-2免疫组化检测结果为2+,则进一步加做FISH,探针购自湖北康录生物技术股份有限公司。按说明书进行操作,根据HER-2基因有无扩增分别判为HER-2阳性或阴性,然后进行分子分型。
1.3 观察指标
GATA-3阳性判读标准:存在肯定的细胞核染色即为阳性;AR阳性判读标准:细胞核出现染色阳性,大于10%癌细胞为阳性[3]。ER、PR的判读标准依据2010年美国临床肿瘤学会(ASCO)/美国病理医师学院(CAP)发布的ER/PR免疫组织化学检测指南,将1%作为ER/PR阳性的临界值[4]。HER-2免疫组化判读根据2019版检测指南[5],即0:无着色或≤10%的浸润性癌细胞呈现不完整的、微弱的细胞膜染色;1+:>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;2+:分两种情况,第一种为>10%的浸润性癌细胞呈现弱-中等强度的完整的细胞膜染色;第二种为≤10%的浸润性癌细胞呈现强而完整的细胞膜染色;3+:>10%浸润性肿瘤细胞呈强、完整且均匀的细胞膜染色。0和1+都定义为染色阴性,3+定义为染色阳性,如HER-2免疫组化结果为2+,则加做荧光原位杂交(FISH)检测,根据荧光原位杂交结果判断为阳性或阴性入组。
1.4 统计学方法
本研究采用SPSS 20.0统计学软件进行处理。发病年龄、肿瘤直径、淋巴结转移、组织学分级、脉管转移,GATA-3、AR蛋白表达率等组间差异采用χ2检验,当不满足χ2检验条件时采用Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 临床病理学资料
本研究所纳入的患者均为女性,年龄23~89岁。在非三阴性乳腺癌组,组织学类型分别为浸润性导管癌88例,浸润性小叶癌6例,黏液癌3例,浸润性实性乳头状癌1例,浸润性微乳头状癌2例。在三阴性乳腺癌组,组织学类型分别为浸润性导管癌82例,浸润性小叶癌(多形性)2例,伴髓样特征的浸润性癌12例,富糖原透明细胞癌1例,伴大汗腺分化的浸润性癌1例,化生性癌2例。
2.2 非三阴性和三阴性乳腺癌患者临床病理特征比较
在100例非三阴性和100例三阴性乳腺癌患者中,两组患者的年龄、肿瘤大小、淋巴结转移、脉管转移比较,差异无统计学意义(P>0.05)。两者之间三阴性乳腺癌组织学分级更高,两者比较,差异有统计学意义(P<0.05)。见表1。
2.3 GATA-3、AR在非三阴性和三阴性表达情况
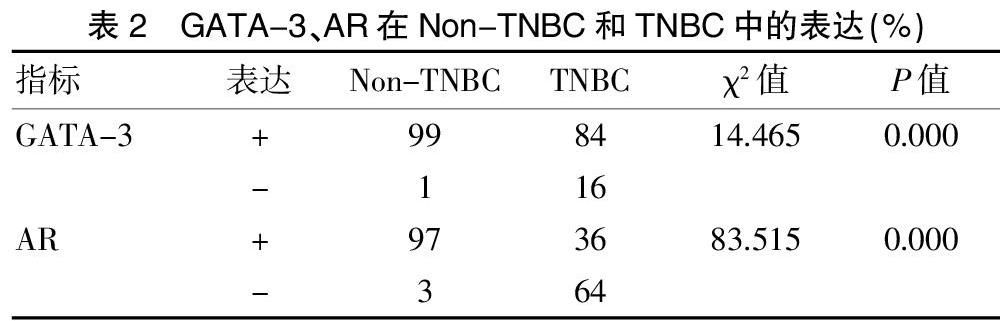
GATA-3在非三阴性患者的表达率为99%,在三阴性患者的表达率为84%,两者比较,差异有统计学意义(P<0.05)。AR在非三阴性患者的表达率为97%,在三阴性患者的表达率为36%,两者比较,差异有统计学意义(P<0.05)。见表2。
3 讨论
乳腺癌是高度异质性肿瘤,依据ER、PR、HER-2、Ki-67的表达可被分为4种亚型:Luminal A型、Luminal B型、HER-2过表达型和三阴性乳腺癌,其中ER、PR、HER-2均为阴性即三阴性乳腺癌。本研究选取100例非三阴性和100例三阴性乳腺癌患者临床病理资料统计分析发现,非三阴和三阴性乳腺癌患者年龄、肿瘤大小、淋巴结转移、脉管转移比较,差异无统计学意义(P>0.05),与周华平[6]报道不一致,该作者总结600例非三阴和三阴性乳腺癌患者临床资料,得出非三阴性患者比三阴性患者腋窝淋巴结更容易转移(52.9%),三阴性乳腺癌患者肿瘤直径更大,结果差异可能是因为本研究样本量更小导致。本研究中,三阴性乳腺癌患者在组织学分级更高,是因为三阴性乳腺癌患者很多为伴髓样特征的浸润性癌和组织学Ⅲ级的浸润性导管癌患者,所以导致组织学分级更高。
转录因子GATA(1-6)在调控细胞增殖与分化、调控细胞运动中具有广泛作用。GATA-3是乳腺上皮中表达最高的转录因子,在乳腺上皮细胞分化中具有关键作用,GATA-3敲除中雌激素受体α(ERα)阳性细胞显著减少,是乳腺癌肿瘤分级、雌激素受体状态和临床预后的一个强有力的独立预测因子。有结果表明,GATA3与雌激素受体信号通路之间存在广泛联系,因此GATA3阳性更常见于ER阳性乳腺癌,与本研究结果一致[7-8]。本研究中,GATA-3在非三阴性乳腺中表达为99%,在三阴性中表达为84%,两者之间比较,差异有统计学意义,与文献报道类似。
乳腺肿瘤细胞分化程度越低,GATA-3阳性表达率越低,说明GATA-3在乳腺癌分化调节中具有重要作用,在促进正常乳腺细胞生长、分化的同时,也促进乳腺癌细胞分化,与乳腺癌的发展有密切关系[9-10]。由于其在乳腺癌中的表达对肿瘤预后及预测均有重要作用,本科已将GATA-3作为乳腺癌的常规诊断和预后判断指标。
由于GATA-3表达是ERα阳性状态的重要预测因子[11-12],临床工作中,GATA3阳性患者,如果ER阴性,需要重复试验或找到染色阴性的原因以排除实验失败导致假阴性。
AR属于核受体超家族中的类固醇激素受体,是信号通路组成的关键部分,在调节基因表达中起着至关重要的作用,是三阴性乳腺癌中可能唯一表达的核激素受体,能作为三阴性乳腺癌预后转归的一个预测因子。在本研究中,AR在非三阴性乳腺癌中表达率为97%,在三阴性乳腺癌中表达为36%,比孙向洁等[3]报道要高,与其他[13-14]报道相似。之所以研究报道数据有差异,认为可能是实验室条件不尽相同,而且对AR、ER、PR等阳性判断标准也不一致。本研究中AR采用10%,ER、PR采用1%作为阳性临界值。
ER阳性乳腺癌中AR的阳性表达率远高于ER阴性乳腺癌,提示AR在这两类乳腺癌发生及进展中的机制不同,有研究显示,在ER+AR+乳腺癌细胞中,AR结合配体被激活后,与结合配体的ER竞争性结合核内雌激素相关的应答元件,抑制ER转录活性,导致细胞凋亡。相反,在ER-AR+细胞中,由转录因子FOXA1介导AR进入核内,促进下游基因转录,导致细胞增殖。
三阴性乳腺癌患者没有针对性治疗方案,治疗方式仍然以化疗为主。尤其在年轻女性中发病率更高,而且容易早期转移和化疗耐受,目前仍缺乏较好的治疗手段。但三阴性乳腺癌是一种异质性很强的疾病,其中管腔雄激素受体亚型(LAR)高表达ARDNA及AR蛋白,对抗雄激素治疗敏感,约为三阴性乳腺癌22%[15]。AR的检测为这些患者提供了新的靶向治疗的潜在机会。尽管目前还没有关于AR靶向治疗市场时间的相关研究,但综合看起来,这些数据表明AR状态可能对三阴性乳腺癌患者的治疗和预后有重要作用,目前许多药物性AR抑制剂已被应用在三阴性乳腺癌治疗中,多项实验证明其能够有效抑制AR阳性的三阴性乳腺癌细胞增殖、减慢肿瘤生长速度,临床实验也证实其有效的临床收益率和良好的药物耐受性,能显著提高患者生存期[16]。
血清雄激素水平增加与乳腺癌风险之间有显著相关性,在参与乳腺癌的发生、进展中,雄激素除了能直接与雌激素协同作用来刺激乳腺癌细胞的生长和增殖;另外在ER、PR都呈阴性乳腺癌患者中,能间接地转化为雌激素而发挥其生物学作用,特别是绝经后女性乳腺癌发生、进展的高危因素。由于AR在各型乳腺癌中表达差异,以及提示可能为三阴性乳腺癌的潜在治疗靶点,提倡每个乳腺癌患者都应该进行检测,或至少对三阴性乳腺癌进行检测。
[参考文献]
[1] Wanqing C,kexin S,Rongshou Z,et al.Cancer incidence and mortality in China,2014[J]. Chin J Cancer Res,2018, 30(1):1-12.
[2] Burstein MD,Tsimei A,Poage GM,et al.Comprehensive genomic analysis identifies novel subtypes and targets of triple-negative breast cancer[J].Clin Cancer Res,2015, 21(7):1688-1698.
[3] 孫向洁,左珂,唐绍娴.雄激素受体在浸润性乳腺癌中的表达及其与乳腺癌分子分型的关系[J].中华病理学杂志,2017,46(7):476-480.
[4] Hammond ME,Hayes DF,Dowsett M,et al.American society of clinical oncology/college of American pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J].J Clin Oncol,2010,28(16):2784-2795.
[5] 杨文涛,步宏.乳腺癌HER-2检测指南(2019版)[J].中华病理学杂志,2019,48(3):169-175.
[6] 周华平.600例三阴性及非三阴性乳腺癌临床分析[J].牡丹江医学院学报,2014,35(4):92-94.
[7] 彭辉,李伟平,杨海峰.1009例乳腺癌GATA3免疫组化染色结果分析[J].临床与实验病理学杂志,2018,34(12):1369-1371.
[8] Takaku M,Grimm SA,Roberts JD,et al.GATA-3 zinc finger 2 mutations reprogram the breast cancer transcriptional network[J].Nature Communitations,2018,9(1):1059.
[9] Lee JY,Park YJ,Oh N,et al.A transcriptional compelx composed of ER(a),GATA-3,FOXA1 and ELL3 regulates IL-20 expression in breast cancer cells[J].Oncotarget,2017,8(26):42 752-42 760.
[10] Fararjeh AS,Tu SH,Chen LC,et al.The impact of the effectiveness of GATA-3 as a prognostic factor in breast cancer[J].Human Pathology,2018,80(10):219-230.
[11] Ng CK,Schultheis AM,Bidard FC.Breast cancer genomics from microarrays to massively parallel sequencing:Paradigms and new insighhs[J].J Natl Cancer Inst,2015, 107(5):djv015.
[12] 張继君,陶丽丽,赵夫娟.FOXA1、GATA-3与ER在乳腺癌中的表达及预后意义[J].暨南大学学报(自然科学与医学版),2019,43(3):225-233.
[13] 任晓燕,陶玉梅,金晓霞.雄激素受体在不同分子分型乳腺癌中的表达及临床病理意义[J].南京医科大学学报(自然科学版),2020,40(1):62-66.
[14] 王丽,任国平,沈朋.浸润性乳腺癌中AR的表达及其预后意义[J].临床与实验病理学杂志,2020,36(7):766-769.
[15] Jezequel P,Loussouarn D,Guerin-Charbonnel C,et al.Gene-expression molecular subtyping of triple-negative breast cancer tumours:Importance of immune response[J].Breast Cancer Res,2015,20(17):43.
[16] Traina TA,Miller K,Yardley DA,et al.Enzalutamide for the treatment of androgen receptor-expressing triple-negative brerst cancer[J].J Clin Oncol,2018,36(9):884-890.
(收稿日期:2021-03-19)
