AM真菌共生系统中硝态氮吸收转运途径及对寄主生长的作用*
2021-01-05李梦瑶蒋湘艳金海如
李梦瑶,蒋湘艳,金海如
(浙江师范大学化学与生命科学学院,浙江金华 321004)
同位素示踪技术及酶学和基因表达分析至今已证实AM真菌吸收氮素并转运给植物,其能利用无机态的铵态氮、硝态氮,有机态的氨基酸等[1-5],而且Jin等[5-7]利用AM真菌(Glomus intraradices)与毛根农杆菌质粒DNA转化的胡萝卜根(Ri T-DNA transformed carrotroots)建立的双重培养系统研究提出了AMF菌丝内氮素运转模型,即AM真菌也可以从土壤吸收多种不同来源的氮,如NH4+、NO3-和氨基酸,这些不同的氮源通过AM真菌根外菌丝内谷氨酰氨合成酶-谷氨酸合成酶(GS-GOGAT)途径被吸收利用,而吸收的氮大都整合入精氨酸(Arg)分子,合成的精氨酸可以被AM真菌根外菌丝完整地运转至根内菌丝,而且可以在菌丝体内双向运转,再将被输送的精氨酸通过尿素循环(urea cycle)释放出N,以形式传递给植物寄主。这为进一步研究AM真菌对氮素的吸收和传递特点提供了理论依据。
1 材料与方法
1.1 离体培养菌根
采用分隔培养皿方法将毛根农杆菌质粒DNA转化的胡萝卜根(Ri T-DNA trans-formed carrot roots)(Daucus carotaL.)于24℃培养在含有4 g·L-1植物胶的改进型M培养基中[5]。菌根室的培养基依照Jin等[5]方法改进后限制氮浓度。
1.2 对不同碳、氮源的吸收和13C/15N的标记
氮素吸收和15N标记实验在经改良不含葡萄糖的 液 体M培 养 基 中 进 行[18]。用180 mg·L-1CaCl2·2H2O代替288 mg·L-1Ca(NO3)2·4H2O,标记的15N底物为氮素唯一来源。13C/15N标记的底物(98%)为:[15N,98%]KNO3+13C1,2乙酸盐或13C6-葡 萄 糖、[15N]KNO3(4 mmol·L-1)、15NH4NO3(4 mmol·L-1)、NH415NO3(4 mmol·L-1)和[15N,98%]15NH4SO4。标记物溶液过滤消毒后加至60 mm灭菌培养皿中培养,不加其他氮源。配好培养基后调节pH至6.0。每种氮源重复处理6个培养皿,作为3个重复。
1.3 游离氨基酸提取
培养1天、3天、1周、3周和6周后,用38 μm网状筛收集菌根和菌丝及孢子,去离子水清洗。样品冷冻干燥后加入少许酸洗过的沙用研钵研磨,用4℃ NH4HCO3缓冲液(pH = 8,含0.2% NaN3)提取。提取液在40 mL NH4HCO3缓冲液中于4℃透析24 h,透析膜允许分子量2 000的分子透过。收集渗透液,冷冻干燥后-20℃储存。然后溶解于2 mL 0.01 mol·L-1HCl,装入阳离子交换柱(0.3 mL的DOWEX 50 X 8-200-阳离子型),柱先用2 mol·L-1NH4OH、2 mol·L-1HCl和去离子水润洗,再用去离子水洗至流出液为中性。用5 mL去离子水洗下柱的中性复合物,再用2 mL 1 mol·L-1的NH4OH洗脱收集游离氨基酸。洗提液收集后冷冻干燥用于GC-MS和HPLC分析。孢子中游离氨基酸提取和分析时用外标法计算各种氨基酸的浓度,每个样品重复3次。
1.4 AM真菌菌根中可溶性蛋白质的酶水解
1.3中透析膜内物质离心后,上层含有可溶性蛋白质,冷冻干燥后重新悬浮在600 μL 20 mmol·L-1的NH4HCO3缓冲液中(pH = 8,含0.2% NaN3)。加入新鲜溶解蛋白酶(2 μL氨肽酶M,2 μL链霉蛋白酶E,2 μL羧肽酶Y),30℃振荡培养6 h。加入新鲜的酶继续培养6 h,4℃ 10 000 r·min-1转下离心10 min,上层清液冷冻干燥并重新悬浮于2 mL水中,随后冷冻干燥悬浮于1 mL水中。所得可溶性蛋白氨基酸按照1.3步骤纯化,用MS进行15N的测定。
1.5 自由氨基酸的同位素分析
用GC-MS分析标记氨基酸[5]。从组织中提取的氨基酸进行衍生化反应。先加入10~20 μL的N,N-二甲基甲酰胺(DMF),根据样品量加30~50 μL的N-甲基-N-特丁基二甲基硅烷-三氟乙酰胺(MTBSTFA),110℃电炉上加热30 min。
甲硅烷基化的提取物注射入Finnigan Trace MS 2000设备,0.25 μm厚的石英毛细管柱(直径0.25 mm,长30 m,RTX-5MS,Restek Inc.Flemington,NJ),此柱连接到质谱仪的四极质量检测器(Thermo Electron,Madison WI)上,He作为载气,流速1 mL·min-1。程序升温:110℃ 2 min,10℃·min-1升温至260℃,维持5 min。电子冲击离子化能量70 eV,检测器扫描质量范围150~600 m·z-1,时间0.5 s,与20种标准氨基酸比较,鉴定样品中的氨基酸。除Arg外,Orn和其他氨基酸通过N-(特丁基二甲基硅)-N-甲基三氟乙酰胺(MTBSTFA)衍生化后测定M-57离子确定。
1.6 HPLC分析氨基酸的含量
根据Endres和Mercier[19]的方法用WatersTM(Milford,MA)717HPLC系统测定各种氨基酸含量。设备包括Waters510自动取样器和泵,一个Waters可调吸收检测器和Millenium数据处理软件。提取的氨基酸溶解于500 μL 0.1 mol·L-1HCl,Pico-Tag工作台上真空干燥,加入乙醇、水和三乙胺(体积比2︰2︰1)后真空干燥。随后加入乙醇、水、三乙胺和异硫氰酸苯酯(体积比7︰1︰1︰1)室温放置20 min,进行氨基酸衍生反应,衍生物真空干燥后备用。每个样品取20 μL注射至反相C18柱(3.9 mm内径× 150 mm长)。38 mL的Pico-Tag洗脱液A和B作为流动相;洗脱液流速为1 mL·min-1,其中洗脱液B比例逐渐上升。检测波长254 nm。测定前所有溶液真空条件除气1 min。与已知标准氨基酸的峰值和保留时间比较,计算样品中各种氨基酸的含量。
1.7 AM真菌不同无机态氮吸收利用对寄主植物甜玉米生长的实验
在特制培养盒中加入适量灭菌的沙土。选取饱满的新鲜甜玉米种子,消毒后播种。接种 AM 真菌根内球囊霉(G. intraradices),每隔一周,施加改良的霍格兰德营养液 50 mL补充营养,培养一段时间后移栽入大田中。继续施加改良的霍格兰德营养液,共施加5次,同时补充不同氮素(尿素、尿素+有机肥、硝酸钾、硝酸钙和硫酸铵)。氮浓度为 4 mmol·L-1的无机氮源。此外,分别施加浓度为0.15 g·L-1(高磷)和 0.05 g·L-1(低磷)的磷酸二氢钾溶液,每次100 mL。实验玉米共生长60 d后回收分析其株重。甜玉米试验每种氮源重复处理15株。
1.8 统计分析
对重复样品分析得到的结果采用SPSS 18.0软件进行相关统计分析。
2 结 果
2.1 AM真菌对不同无机态氮素的吸收特征

图1 AM真菌共生系统中菌丝室用15NH4NO3或NH415NO3处理6天时其根外菌丝(a)和菌根组织(b)自由氨基酸的15N标记Fig. 1 15N labelling of free amino acids in extraradical mycelium(ERM)(a)and mycerrhizal tissues(b)in the hypha compartment of the AM fungi symbiosis treated with 15NH4NO3,NH415NO3 or 15NH4 for 6 days
2.2 AM真菌共生系统中外源碳和氮源对菌丝合成精氨酸的影响
AM真菌根外菌丝加13C6-葡萄糖培养6周后,菌根组织的精氨酸和蛋白质中均未发现13C(表1),说明其根外菌丝不能利用葡萄糖。而无侵染的根组织培养于13C6-葡萄糖6周后,根组织中的自由精氨酸13C丰度为22.8%±1.8%,根蛋白质中13C丰度为17.7%±1.0%,表明根组织可以吸收利用葡萄糖合成精氨酸,其自由精氨酸浓度为10.9%±4.8%,菌根蛋白质中精氨酸浓度为10.2%±0.5%。菌丝室加13C1,2-乙酸钠后,菌根组织的精氨酸和蛋白质中都发现有13C标记,分别为8.5%±2.3%和7.6%±0.7%,说明其根外菌丝能吸收利用乙酸盐中的碳素,此时其自由精氨酸浓度为10.3%±0.3%,菌根蛋白质中精氨酸浓度为8.3%±0.8%。
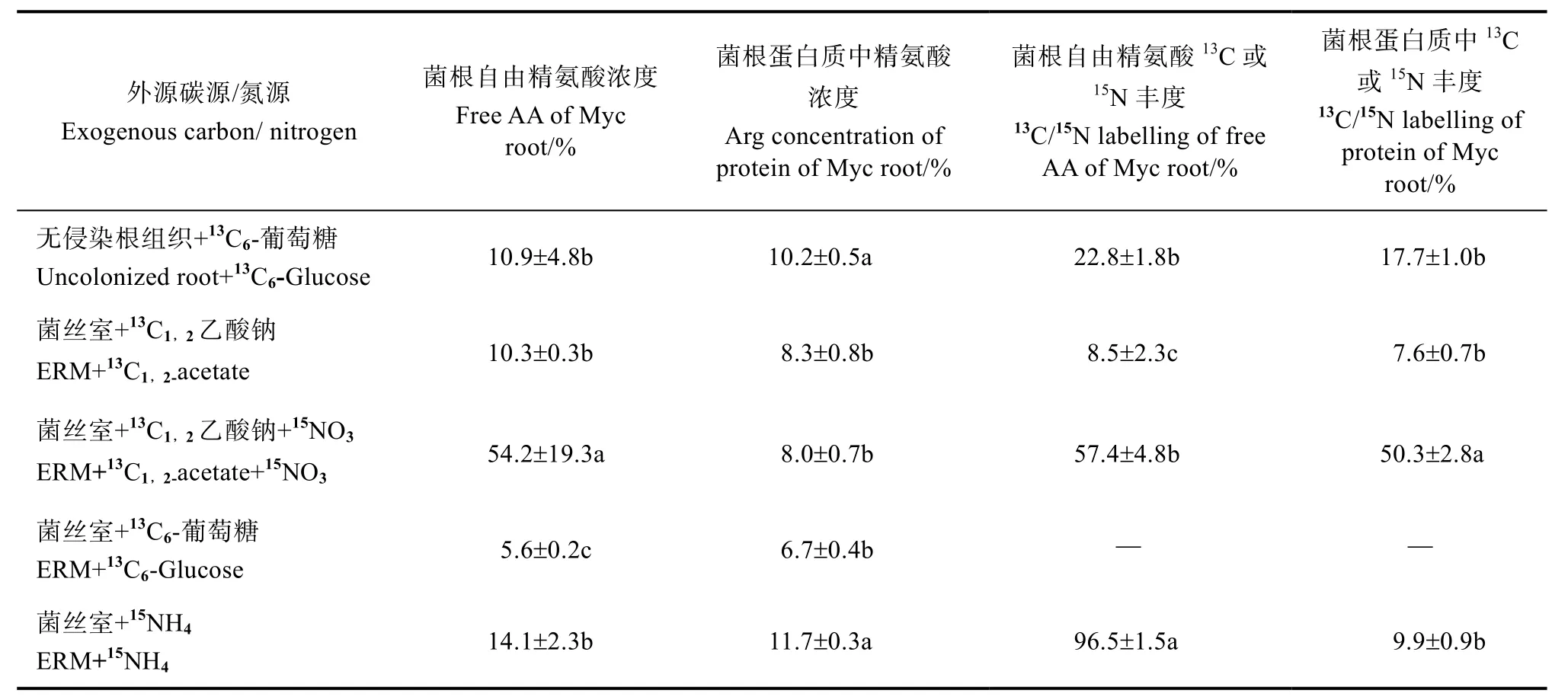
表1 外源碳和氮源对菌根组织及其蛋白质中精氨酸浓度和同位素丰度的影响Table 1 Effect of exogenous carbon and nitrogen input on formation and 13C/15N labelling of Arg in mrcorrhizal tissues and protein
菌丝室加13C1,2乙酸钠+15NO3后,随着氮源的增加,其自由精氨酸浓度提高为54.2%±19.3%,菌根蛋白质中精氨酸浓度变化不大,为8.0%±0.7%;同时菌根组织的精氨酸和蛋白质中C/N同位素标记丰度大大提高,分别为57.4%±4.8%和50.3%±2.8%。说明菌丝室增加可利用碳源乙酸和氮源,可以提高精氨酸的合成。
2.3 AM真菌吸收利用不同无机态氮对寄主植物甜玉米生长的影响
大田试验中(如图2),在低磷条件下,接种AM真菌并添加硝酸钾菌根化玉米茎叶重明显提高,相对无菌根化低磷条件下的甜玉米提高了12.28%,其次硝酸钙也有提高作用,可提高2.94%;硫酸铵则不如硝酸钾对AM真菌菌根化甜玉米株重的促进作用,反而是降低了其生物量8.19%,尿素则降低了13.02%,但尿素和有机肥则缓解这种生物量抑制作用。

图2 不同氮素形态在高磷和低磷下对甜玉米株重的影响Fig. 2 Effect of form of applied nitrogen on per-plant weight of sweet corn cultured in soil high/low in P concentration
在高磷条件下,接种AM真菌并添加硝酸钾菌根化玉米穗重显著提高,相对无菌高磷提高达31.75%,其次硝酸钙提高2.43%;硫酸铵则不如硝酸钾,只有1.32%,尿素在高磷下则减少其生物量11.97%,施加尿素和有机肥则缓解抑制作用,反而提高3.52%。
3 讨 论
3.1 AM真菌吸收和转运无机态氮素的模式差异
3.2 外源碳和氮素对AM真菌合成精氨酸的影响
精氨酸是AM真菌菌丝转运氮素的载体。在菌丝和菌根组织中的精氨酸浓度反映了其合成、转运及分解的平衡结果。Jin等[5]用HPLC分析了AM菌丝吸收利用合成精氨酸的浓度,是菌丝中自由氨基酸的主要成分。本研究发现AM真菌根外菌丝加13C6-葡萄糖,培养6周后,菌根组织的精氨酸和蛋白质均未发现13C,说明其根外菌丝不能利用葡萄糖。菌丝室加13C1,2乙酸钠后,菌根组织的精氨酸和蛋白质中均发现13C,说明其根外菌丝能吸收利用乙酸盐中的碳素;菌丝室加13C1,2乙酸钠+15NO3后,随着氮源的增加,其自由精氨酸浓度提高为54.2%±19.3%,菌根蛋白质中精氨酸浓度变化不大;同时菌根组织的精氨酸和蛋白质中C/N同位素标记丰度大大提高。说明菌丝室增加可利用碳源乙酸和氮源,可以提高精氨酸的合成,但是不清楚精氨酸合成是在根内菌丝还是寄主根内合成为主。在AM真菌共生系统施加有机质,可以部分分解为氨基酸和有机酸(乙酸等)等再被菌丝吸收利用,减少从寄主吸收碳水化合物,从而缓解AM真菌对寄主生物量的抑制作用。
3.3 AM真菌吸收不同氮素对寄主植物生长的影响
大田试验中,本研究发现在低磷条件下,接种AM真菌并添加硝酸钾后,菌根化玉米茎叶重明显提高。硫酸铵则不如硝酸钾对AM真菌菌根化甜玉米株重的促进作用,尿素则降低了13.02%,但是尿素再加有机肥则可以缓解这种生物量抑制作用。Thirkell等[27]也报道了AM真菌菌丝接触有机质后可以提高寄主植物氮和磷水平,同时也提高了寄主生物量。
在高磷条件下,接种AM真菌并添加硝酸钾后,菌根化玉米穗重明显提高;硫酸铵则不如硝酸钾,尿素在高磷下则减少其生物量11.97%,施加有机肥则缓解抑制作用,反而提高3.52%。相比较,国内邓胤等[14]研究了不同氮磷水平对玉米生长的影响,以NH4NO3为氮源,在高浓度外界氮和磷下,接种AM真菌对玉米营养无贡献,只有在正常氮浓度2 mol·L-1时,显著提高生物量。显然,该作者没有区别AM真菌对不同无机态氮素的吸收差别。冉琼和钟章成[28]则发现AM真菌能够通过促进玉米幼苗N、P吸收及叶绿素含量增加,光化学效率、气孔导度增大,从而提高玉米幼苗光合作用能力促进生长。
4 结 论
AM真菌对铵和硝态氮的吸收和转运有两种不同模式,对于铵态氮(和尿素),AM真菌通过根外菌丝内谷氨酰氨合成酶-谷氨酸合成酶(GS-GOGAT)途径被吸收利用的,而吸收的氮大都整合入精氨酸(Arg)分子,合成的精氨酸可以被AM真菌根外菌丝完整地运转至根内菌丝,而且可以在菌丝体内双向运转,再将被输送的精氨酸通过尿素循环(urea cycle)释放出N,以形式传递给植物寄主。对于硝态氮则除了小部分被ERM吸收还原为进入尿素循环,大部分则是通过根外菌丝转运(可以排除菌丝扩散作用,经检测培养基中浓度很低,数据未发表)至IRM的丛枝结构(检测菌根组织中积累了数据未发表),进而推测在硝酸盐还原酶(Nitrate reductase)和亚硝酸盐还原酶作用下形成铵,再传递给寄主植物利用(硝酸还原酶基因表达数据;宿主植物受到AM真菌诱导的铵吸收转运蛋白基因的表达数据在后续文章中发表)。这个新模式是首次报道了硝态氮转运吸收途径。
