白藜芦醇抑制氧化应激减少人气道上皮细胞黏蛋白5AC表达
2021-01-04王博寒史锁芳
王博寒,史锁芳
(1.南京中医药大学,江苏 南京 210029;2.南京中医药大学附属医院,江苏 南京 210029)
支气管哮喘(简称哮喘),是一种以可逆性的气道高反应为特点、由多种细胞及细胞组分参与的气道慢性炎症性疾病。全球约有3亿哮喘患者,其发病率呈逐年上升的趋势[1]。哮喘的发病机制尚未明确,除了气道高反应、免疫-炎症反应等,氧化应激在哮喘的发病机制中占据重要地位,如“氧化/抗氧化失衡”、气道“自由基损伤”等学说[2]。氧化应激可以刺激MUC5AC过表达,使黏液分泌增多,限制黏膜纤毛摆动,降低气道清除能力,进而形成黏液栓引起气道阻塞,是哮喘死亡的重要因素之一[3]。故抑制氧化应激减少MUC5AC表达在哮喘的治疗过程中尤为重要。白藜芦醇具有多种生物活性,是公认的具有抗炎、抗氧化、抗衰老作用和癌症化学预防剂[4]。深入挖掘氧化应激在哮喘中的作用机理,探究白藜芦醇抗氧化应激在哮喘治疗中的作用靶点具有重要的意义。基于以上认识,本实验以人气道上皮细胞16HBE为研究对象,并通过H2O2诱导细胞氧化应激模型,加以白藜芦醇干预,检测氧化应激相关指标以及MUC5AC表达水平,探讨白藜芦醇对H2O2作用下人气道上皮细胞中MUC5AC表达的影响。
1 材料与方法
1.1 主要材料
人气道上皮细胞16HBE(中国科学院上海生命科学研究院细胞资源中心);白藜芦醇(S1396)(美国Selleck 生物科技有限公司);胎牛血清(41F9144K)、RPMI 1640培养基(8117079)、青霉素-链霉素(C0222)(美国Thermo fisher scientific公司);H2O2(101830329)(美国Sigma公司);活性氧ROS测试盒(E004-1-1)、总抗氧化能力T-AOC测试盒(A015-1-2)(南京建成生物工程研究所);MUC5AC抗体(sc-21701)(美国Santa Cruz公司);羊抗兔IgG(7074S)(美国Cell Signaling科技公司);蛋白裂解液(106M4000V)、蛋白酶抑制剂(410035)、磷酸酶抑制剂(510024)(瑞士Biotool公司);BCA蛋白定量试剂盒(P0010)(上海碧云天生物技术有限公司);ECL发光显色液(170-5060)(美国Bio-Rad公司)。
1.2 主要仪器
HeraCell 150i型培养箱(美国Thermo fisher scientific公司);Ni-U型正置荧光显微镜(德国Jena公司);125-BR垂直电泳仪、221-BR电转移装置、ChemiDocTM型成像系统(美国Bio-Rad公司);VIIA7DX型实时荧光定量PCR仪(新加坡 Life technologies公司)。
1.3 细胞培养及分组
配制含有10%胎牛血清及1%青霉素-链霉素溶液的RPMI 1640培养基培养16HBE细胞,细胞置于37 ℃、5% CO2培养箱中。待细胞融合达70%~80%时用0.5%胰蛋白酶消化进行后续实验。
分组1:①对照组;②H2O2不同浓度组(H2O2浓度分别为5、10、20 μmol/L),均处理48 h。
分组2:将细胞分为H2O2不同时间组(5 h、24 h、48 h、72 h)。分别予以H2O220 μmol/L干预细胞相应时间。
分组3:①对照组;②H2O2组(H2O220 μmol/L);③H2O2+白藜芦醇组(H2O220 μmol/L+白藜芦醇50 μmol/L);④白藜芦醇组(白藜芦醇50 μmol/L),均处理24 h。
1.4 检测指标
1.4.1 活性氧ROS水平
按“分组1”和“分组3”相应要求处理后的16HBE细胞,采用无血清RPMI 1640培养基稀释 DCFH-DA荧光探针,稀释比例为1∶1 000,每孔加入500 μL,放置培养箱避光孵育30 min。弃去孔内液体,PBS冲洗2次,每孔加入PBS 500 μL荧光显微镜下观察并拍照。
1.4.2 总抗氧能力T-AOC水平
按“分组3”相应要求处理后的16HBE细胞进行T-AOC检测。1)配制测定管及对照管溶液,充分混匀后置于37 ℃水浴锅水浴30 min。2)对照管和测定管中分别加入4号试剂和5号试剂,测定管加样品。3)漩涡震荡充分混匀后,采用酶标仪设置吸光度为520 nm测定吸光度。
细胞中T-AOC能力=(测定管OD值-对照管OD值)/0.3×40/待测蛋白浓度
1.4.3 MUC5AC蛋白表达水平
采用Western blot法检测MUC5AC蛋白表达水平。按“分组1”和“分组3”要求处理后弃去原有培养液,16HBE细胞PBS清洗后加入适量体积细胞裂解液。收集细胞裂解液上清采用BCA法测定蛋白浓度。10% SDS-PAGE 凝胶电泳,转膜后切取目的条带。5%脱脂奶粉封闭液封闭2 h,加入MUC5AC和β-actin抗体4 ℃过夜。TBST洗涤后加入羊抗兔IgG二抗室温孵育2 h,TBST洗涤后采用ECL发光液显色。实验结果采用Image J软件进行灰度值分析。
1.4.4 MUC5AC mRNA水平
采用RT-PCR法检测MUC5AC mRNA水平。按“分组1”“分组2”和“分组3”要求处理后弃去原有培养液,16HBE细胞采用PBS清除培养基后加入RNAiso Plus分离总RNA。采用 First-Strand Synthesis 试剂盒进行逆转录。取逆转物产物进行PCR扩增,扩增条件为:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min 共 45个循环,以 β-actin基因为内参,引物设计如下:
β-actin:上游5′-CCAACCGCGAGAAGATGA-3′,下游5′-CCAGAGGCGTACAGGGATAG-3′,MUC5AC:上游5′GCTTCCTGCTCCGAGATGT3′,下游 5′AAGACGCAGCCCTCATAGAA3′。
通过计算 2-ΔΔCt分析MUC5AC mRNA相对表达量。
1.5 统计学处理
2 结果
2.1 H2O2诱导16HBE细胞氧化应激
DCFH-DA探针检测“分组1”的 16HBE细胞ROS水平,结果显示H2O2作用后可以增高16HBE细胞内ROS水平,且随着H2O2浓度升高,ROS水平也随之升高。见图1。
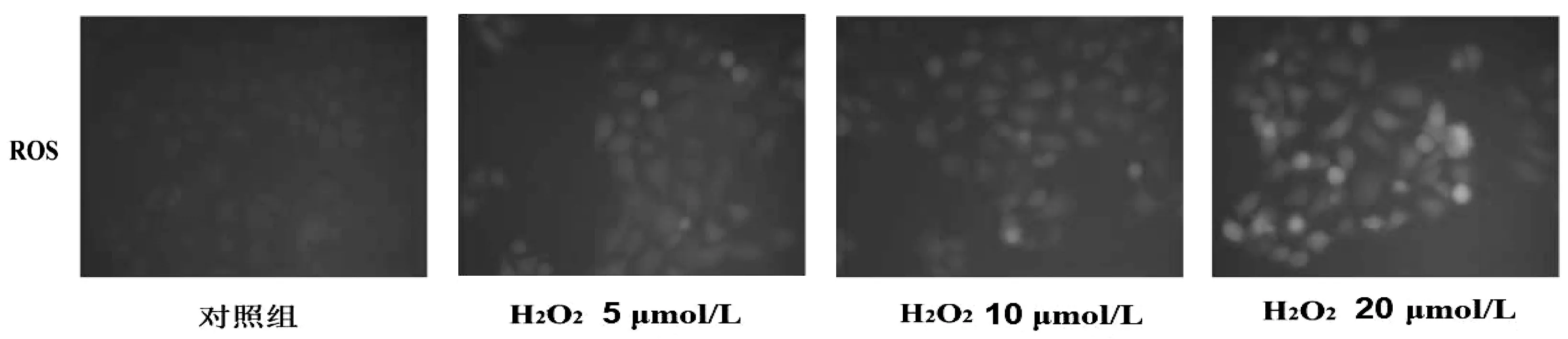
图1 H2O2诱导16HBE细胞氧化应激
2.2 H2O2诱导16HBE细胞MUC5AC表达量
RT-PCR法检测“分组1”和“分组2”MUC5AC mRNA水平,结果显示H2O2作用后16HBE细胞的MUC5AC mRNA水平随浓度升高而升高,与对照组比较,20 μmol/L H2O2作用后MUC5AC mRNA水平升高了约6倍(P<0.001),见图2A。H2O2不同时间组(5 h、24 h、48 h、72 h)MUC5AC mRNA水平比较,作用24 h的MUC5AC mRNA水平最高,比对照组升高了约5倍(P<0.001),见图2B。Western blot法检测“分组1”的MUC5AC蛋白水平,与对照组比较,20 μmol/L H2O2作用后MUC5AC蛋白水平升高了约2倍(P<0.001),见图2D。综上,H2O2能够诱导16HBE细胞MUC5AC表达量增加,H2O220 μmol/L干预24 h MUC5AC表达量最高。
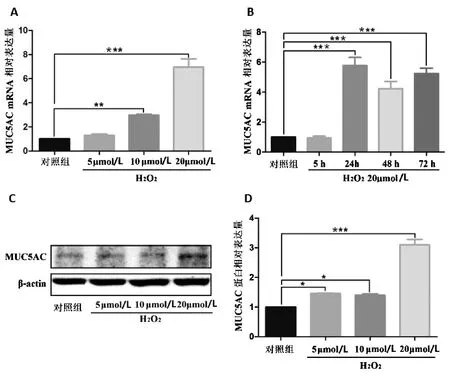
注:*P<0.05,**P<0.01,***P<0.001。
2.3 白藜芦醇抑制H2O2诱导的16HBE细胞氧化应激
检测“分组3”的 16HBE细胞ROS和T-AOC水平,20 μmol/L H2O2作用后可以升高细胞内ROS水平,而加入白藜芦醇50 μmol/L共同作用后可以抑制H2O2诱导的细胞内ROS升高,见图3A。对于T-AOC水平,20 μmol/L H2O2作用后T-AOC水平较对照组降低了约2/7(P<0.05),与H2O2组比较,H2O2+白藜芦醇组的T-AOC水平升高了约0.3倍(P<0.05),见图3B。
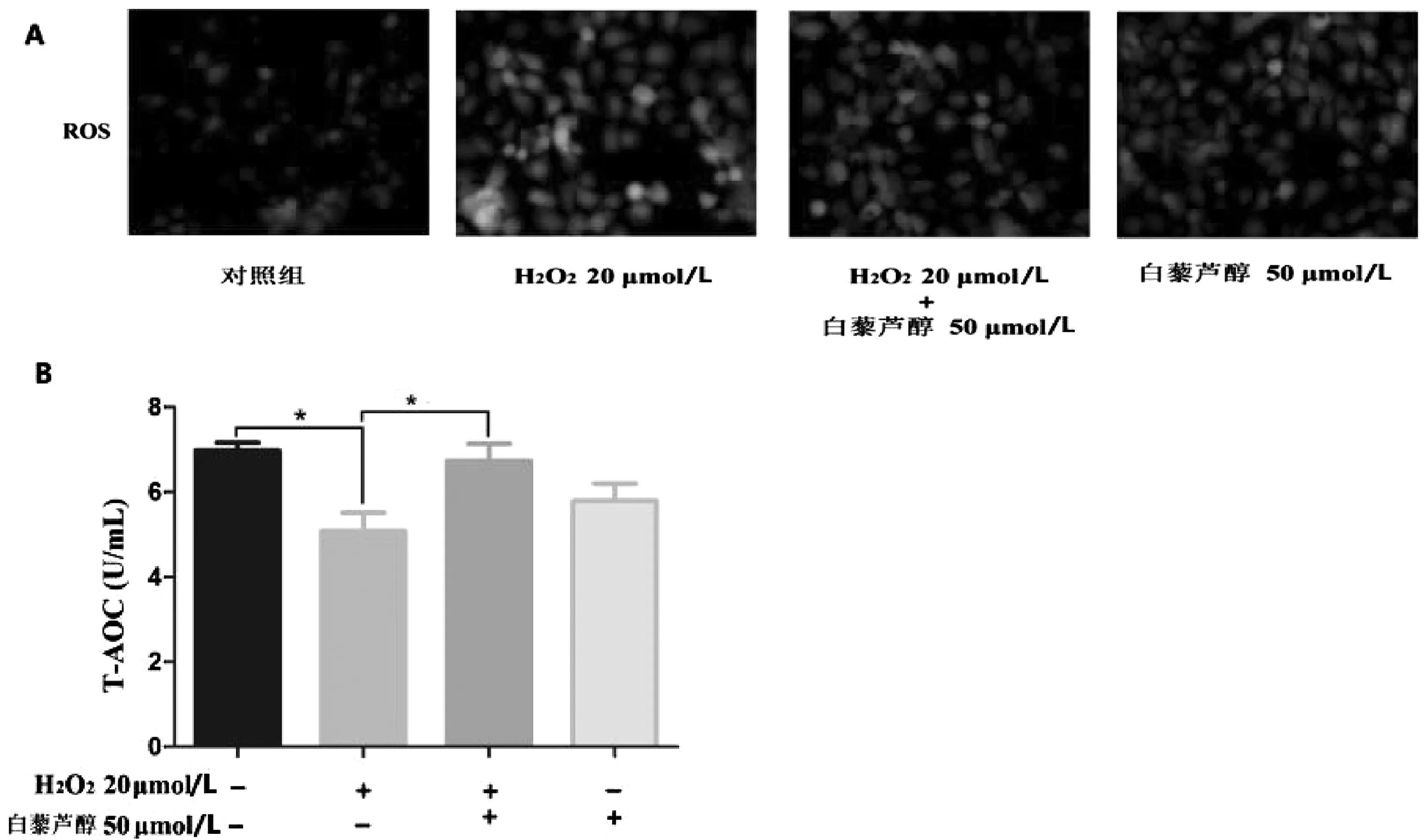
注:*P<0.05。
2.4 白藜芦醇逆转H2O2诱导的MUC5AC表达
检测“分组3”的16HBE细胞的MUC5AC mRNA水平和MUC5AC蛋白水平,与对照组比较,H2O2组的MUC5AC mRNA水平升高了约5倍(P<0.001),MUC5AC蛋白水平升高了约0.8倍(P<0.001)。与H2O2组比较,H2O2+白藜芦醇组的MUC5A CmRNA水平降低了约5/6(P<0.001),MUC5AC蛋白水平降低了约2/5。说明白藜芦醇能够逆转H2O2诱导的MUC5AC表达(P<0.001)。见图4。
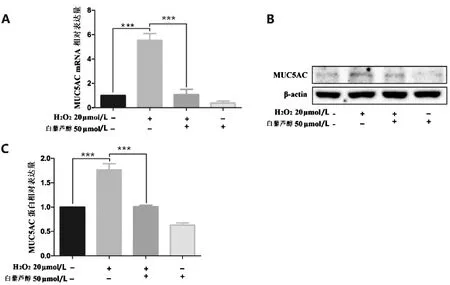
注:***P<0.001。
3 讨论
在人体内环境稳定的情况下,氧化和抗氧化处于动态平衡的状态。氧化应激是指在多种理化刺激及自身免疫等因素的影响下,体内产生过多的ROS,氧化程度超出了氧化物的清除,氧化和抗氧化处于失衡状态,导致中性粒细胞浸润和氧化损伤。大量临床和动物实验研究发现,氧化应激是哮喘发生和发展的重要机制之一[5]。氧化应激启动并加重炎症反应,其主要物质活性氧ROS是一种强化学介质,能作用于细胞膜的受体激酶,调控多种信号转导途径,激活对氧化还原敏感的转录因子,使其与MUC5AC基因对应的位点结合,促进 MUC5AC基因转录与翻译,导致气道黏液过度分泌[6]。因此针对黏液分泌的信号通路进行抗氧化应激处理,能够有效抑制黏液高分泌。基于白藜芦醇的抗氧化、抗炎等作用,本实验提出了白藜芦醇能够抑制氧化应激减少黏蛋白MUC5AC表达的假说。
ROS是需氧细胞在代谢过程中产生一系列活性氧簇,在调控细胞生物学行为中起到重要作用。过量的ROS能够损伤细胞的大分子结构例如DNAs,类脂和蛋白质,造成组织损伤,参与黏液高分泌[7]。T-AOC代表的是机体总抗氧化体系,包括了抗氧化酶(如SOD等)、非抗氧化酶(H2S等)两类抗氧化系统,这些抗氧化物质能够清除自由基,减轻氧化应激对机体的损伤[7]。本研究发现,H2O2刺激16HBE细胞后,细胞内ROS水平升高,T-AOC水平降低,证实H2O2诱导的氧化应激模型成立。白藜芦醇作用后,与模型组相比,ROS水平降低,T-AOC水平升高,证实白藜芦醇具有抑制氧化应激的作用。
气道黏液高分泌是支气管哮喘的重要病理学改变之一[8],黏液分泌增多会导致纤毛清除功能受损,进而形成黏液栓,引起气道阻塞、气流受限,并为细菌感染提供机会。黏蛋白是气道黏液的主要成分,由气道上皮杯状细胞及黏膜下腺体产生,可分为膜结合型和分泌型。MUC5AC为分泌型黏蛋白,是哮喘发作时气道黏液中的主要黏蛋白,对维持正常的黏液弹性和纤毛清除功能起着重要作用。故MUC5AC的过量表达可以作为气道黏液高分泌形成的主要标志[9]。本研究发现,用H2O2刺激16HBE细胞后,MUC5AC mRNA及其蛋白表达明显增高,揭示H2O2能够诱导16HBE细胞MUC5AC表达量增加。而白藜芦醇作用后,与模型组相比,MUC5AC mRNA及其蛋白表达明显降低,证实白藜芦醇能够逆转H2O2诱导的MUC5AC过表达。
黏蛋白合成的机制研究众多,且较为复杂,已知MAPK/p38、JAK/STAT、Ras/Raf/Erk/MAPK等信号通路均在其合成过程中发挥着重要的作用[10]。对于氧化应激诱导黏液高分泌的具体机制尚不明确,本研究通过体外实验进一步验证了氧化应激与MUC5AC过表达相关,且白藜芦醇能够抑制氧化应激减少MUC5AC表达,然而其具体作用机制仍待进一步研究。
