应用3D大脑类器官研究人类神经发育和疾病
2021-01-02唐晓艳张馨月徐敏刘妍
唐晓艳 张馨月 徐敏 刘妍
很多人对医疗事业的未来,都存在这样一种憧憬:当身上的组织器官出现问题时,人们可以在体外培养新鲜健康的相同组织器官用于移植。其实在当下,类器官的出现就是这种技术的成果体现。
类器官模型是在模式动物模型不能完全代替人体模型,且人体实验和流产胚胎存在伦理限制的情况下出现的。早在1965—1985年,科研工作者就已经使用“类器官”来研究发育生物学,但当时的“类器官”只是因为其形态类似器官被冠以此名。直至多能干细胞学科的兴起,才使类器官“名副其实”,真正拥有类似器官的功能和结构。
人多能干细胞(包括胚胎干细胞和诱导性多能干细胞)在特定诱导条件下可分化为体内任意一种细胞或组织类型。随着近年来干细胞领域的不断发展,类器官技术应运而生。类器官是指利用人体干细胞或者由器官特异性祖细胞,在三维环境中培养出类似于器官的组织,具有自我更新和自我组织的能力。类器官的发展是从肠类器官培养系统开始的。2009年,研究者将小鼠肠道干细胞放置在凝胶基质中生长,用以模拟组织的细胞外基质微环境,结果发现这些干细胞最终形成了表面有孔、内部有类似肠道绒毛和隐窝的球状结构[1]。随着类器官培养技术的不断发展,目前已培育出人的肠、视网膜、大脑、肝脏和肾类器官。
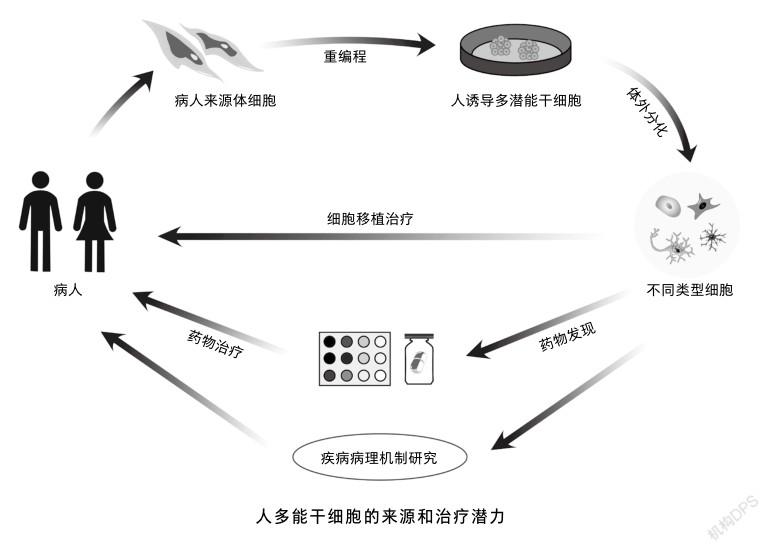
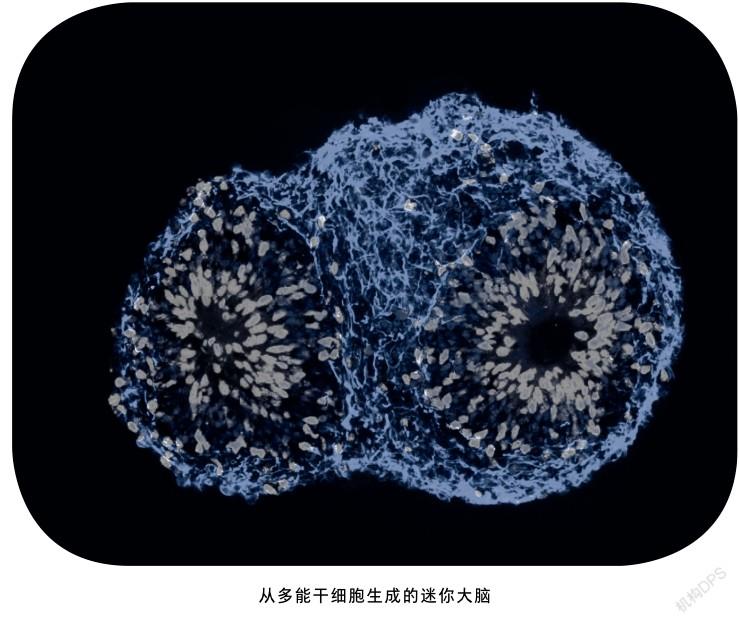
传统模拟神经系统疾病的方法是从人多能干细胞中分化得到神经元。这是一种2D培养体系,该体系分化得到的细胞无法模拟人类大脑3D空间的内环境,也无法反映出3D层面细胞间的相互作用,所以3D培养体系应运而生。从人多能干细胞产生3D大脑类器官的最普遍方法是先形成拟胚体(形态学上与哺乳动物早期胚胎发育阶段有着很高相似度的一种球状结构),再将这些悬浮培养的拟胚体样聚集体逐渐分化为几个极化的神经前体细胞花环结构,随即重新吹悬成神经球,最后用含有高水平神经元的细胞外基质蛋白的基质胶进行包埋。
迄今为止,利用人多能干细胞已经可以培育区域特异的类脑器官,如大脑皮质、前脑、中脑、下丘脑、小脑和海马等。2011年,最早用3D技术培育出完整的神经组织:视杯类器官。2013年,研究者利用人胚胎干细胞,运用凝胶基质包埋的方法在3D培养环境中培育出大脑类器官,其具备人类大脑发育初期的一些主要区域,如视网膜、背侧皮层、腹侧前脑、中脑、脉络丛和海马等结构,并利用此模型阐明了小头畸形的发病机理。还有研究者运用微型生物反应器生成3种类型的脑区域性类器官(前脑、中脑和下丘脑),揭示了寨卡病毒影响人类大脑发育的机制。此外,通过将人胚胎干细胞异位表达乙型肝炎病毒变体2,诱导在大脑皮层类器官中生成血管样网络结构,创建了具有脉管系统的血管化类器官。2017年,研究者首次在体外构建了皮层和基底前脑融合类器官,重现了胚胎发育时期中间神经元的迁移过程。近日,有课题组构建了大脑皮层和后脑/脊髓的类器官,并将它们与人类骨骼肌类器官融合,形成3D“皮质—脊髓—肌肉”运动组装体。他们用该运动组装体证实皮质下行神经元投射可调节脊髓功能网络,同时脊髓源性运动神经元可进一步控制肌肉产生节律波动。研究人员对于3D大脑类器官模型的每一步探索都是在努力构建更贴合人体结构的体外模型,以此深入了解人體神经系统的结构。
探究人脑神经发育障碍疾病
神经发育障碍是由胚胎阶段大脑发育异常所致的一类中枢神经系统功能受损的疾病,是一种广泛、多样化的神经行为学障碍。患者往往伴有认知、语言、社交互动及运动行为的缺陷。常见的神经发育障碍包括小头畸形、自闭症、提摩西氏综合征、精神分裂症、癫痫、威廉姆斯综合征、唐氏综合征、智力障碍、无脑回畸形、蕾特氏症等。类器官技术的出现,规避了由于使用动物模型及流产胚胎而面临的种属差异和伦理问题,为研究神经发育疾病及药物筛选提供了新的技术平台。
以小头畸形为例,该疾病是一种由于患者的祖细胞产生和细胞凋亡的失衡致使脑内神经元和神经胶质细胞数量减少,继而导致大脑结构发育异常的疾病。小头畸形分为原发性小头畸形和继发性小头畸形,其中原发性小头畸形是常染色体隐性遗传的散发性神经发育疾病,发病原因是祖细胞有丝分裂过程中纺锤体失控和细胞周期动力学异常。
迄今为止,研究人员已经筛选出与原发性小头畸形发生相关的18个基因突变。兰开斯特(Lancaster)等首次使用大脑类器官对小头畸形进行建模,他们将携带了编码CDK5调节亚基相关蛋白2(CDK5RAP2)突变基因的小头颅病患者的诱导性多能干细胞分化为大脑类器官[2]。结果显示,与对照组相比,在分化而成的患者脑类器官中,中神经前体细胞显示出增殖减少和提前分化等病理表型。同时,研究人员使用CRISPR/Cas9基因编辑技术将对照组类器官的CDK5RAP2基因进行敲减,结果显示敲减组类器官同样表现出相似的病理表型。此后,还有研究者构建了WDR62基因突变的人源性脑类器官模型,证实WDR62基因缺陷可使其下游效应因子中心体蛋白CEP70被募集到初级纤毛基体的过程中断,纤毛分解延迟、纤毛长度增加、细胞周期进程受损,从而导致神经前体细胞增殖减少和提前分化,最终造成小头畸形类器官体积减小,验证了WDR62基因表达异常可导致小头畸形患者神经发育障碍。这些研究结果表明,构建患者来源的类器官模型可在很大程度上推动脑部疾病遗传机制相关研究的发展。
小头畸形的另一个主要致病因素是寨卡病毒。曾有多个研究小组使用寨卡病毒感染大脑类器官来观察病毒致病的机制。在对包括美国食品药品监督管理局批准的药物、临床试验候选药物和药理活性化合物在内的约6000种化合物的药物筛选过程中,研究者发现caspase-3活性抑制剂Emricasan和Niclosamide(B类驱虫药)可挽救寨卡病毒诱导的皮质神经前体细胞的凋亡,并有效抑制寨卡病毒的复制,因此确定了抗寨卡病毒药物开发的先导化合物[3]。由此可见,基于人脑类器官的研究不仅加深了我们对小头畸形发病机制的认识,也为验证候选药物提供了新的药物筛选平台。
探究人脑神经退行性疾病
神经退行性疾病又称神经系统变性疾病,是一类以中枢神经系统和外周神经系统变性导致的结构和功能进行性退化为特征的疾病,主要包括阿尔茨海默病、帕金森病、亨廷顿病和肌萎缩性侧索硬化症。这些神经退行性疾病严重影响了美国600万人的生活质量,且其病理机制尚不明确,针对此类疾病,目前尚无有效的治疗方法。该综合征病理特征复杂多样,而动物模型不能完全概括人类神经系统的独特性和复杂性,在开发用于神经退行性疾病治疗药物的过程中,科研人员面临巨大挑战。因此,基于多能干细胞技术的3D类器官模型则为研究上述疾病开辟了新的道路。
以阿尔茨海默病为例,该疾病又称老年痴呆,临床上往往表现为记忆、认知和执行功能的进行性和不可逆转性衰退。截至目前,仅有两种经美国食品药品监督管理局批准的用于治疗阿尔茨海默病的临床药物:乙酰胆碱酯酶抑制剂和N-甲基-D-天冬氨酸受体拮抗剂,但以上两类药物的治疗效果非常有限,因此,开发新型药物疗法为当前生命医学领域关注的一个焦点。
阿尔茨海默病主要的病理学特征为β-淀粉样蛋白斑块和tau蛋白缠结。这些病理过程的下游效应为神经元变性、突触和神经元丢失,最终导致神经系统的萎缩。研究者在人神经干细胞来源的3D大脑类器官培养系统中发现,β-淀粉样蛋白前体蛋白和早老素1突变可诱导显著的β-淀粉样蛋白细胞外沉积;此外,在神经突触中也可见银阳性的P-tau聚集物及丝状tau蛋白。其他研究者在类器官中过表达家族性阿尔茨海默病基因,也观测到了β-淀粉样蛋白的聚集及迟发tau病理学特征。
另一项关于阿尔茨海默病患者来源类器官的研究证实了标志性阿尔茨海默病病理的自发出现,包括淀粉样蛋白聚集体的生成和tau蛋白的异常磷酸化。此外,β-和γ-分泌酶抑制剂处理可有效减轻类器官中阿尔茨海默病的相关病理表型[4]。同时,研究者发现散发性阿尔茨海默病与APOE位点基因突变有关,其中APOE4突变被认为是散发性阿尔茨海默病最大的遗传危险因素。研究团队利用CRISPR/ Cas9基因编辑技术将APOE4基因引入健康人诱导性多能干细胞系,结果显示,携带APOE4基因型的大脑类器官表现出β-淀粉样蛋白积累和tau蛋白磷酸化增加,同时APOE4基因型来源的星形胶质细胞和小胶质细胞对β-淀粉样蛋白42的吸收率降低,而将APOE4转变成APOE3基因后,可明显改善其阿尔茨海默病的病理特征。以上结果证实了APOE4基因在散发性阿尔茨海默病发病过程中的关键作用。
由此可见,利用中枢神经系统类器官建立的神经系统疾病模型是探究人类迟发性神经退行性疾病潜在病因的一个有力工具,同时也为筛选治疗药物提供了强有力的技术平台。
3D脑类器官技术的发展至今还不足10年,仍处于起步阶段。就其细胞和分子组成而言,目前脑类器官的体系可以模仿妊娠中期的人类胎儿大脑。然而,由于大脑类器官缺乏血管循环系统,因此其主要依靠自由扩散从培养基中进行氧气交换和吸取营养。当在体外进行长期培养时,由于缺乏氧气和营养,类器官中间的细胞会出现大量凋亡。因此,建立一种改进的脑类器官循环系统为大势所趋。
最近,已成功地从诱导性多能干细胞中分化出血管类器官,包含自组装成毛细管网络的内皮细胞和周细胞。血管类器官可移植到小鼠中形成稳定的灌注血管树,包括动脉、小动脉和小静脉[5]。在未来针对人脑类器官技术的优化中,可将人脑类器官与血管类器官结合在一起,以期建立功能性的封闭循环系统,以支持体外的长期培养并用于研究神经血管的相互作用。
人脑细胞组成不仅仅包含源自神经外胚层的神经细胞,还包含各种类型的非神经细胞。当前大多数关于类器官的研究主要集中在将胚状体诱导为神经外胚层,从而缺失了大量非神经细胞,例如小胶质细胞、内皮细胞、造血细胞和脑膜等。因此,当前的大脑类器官体系尚无法对由非神经元细胞之间的相互作用或非神经细胞与神经细胞之间的相互作用介导的大脑疾病进行建模。研究表明,在没有添加双重SMAD蛋白抑制剂的情况下,大脑类器官可自发生成中胚层祖细胞,它们能够在神经外胚层细胞提供的中枢神经系统微环境作用下分化为成熟的小胶质细胞。此外,2D分化的小胶质细胞与大脑类器官的共培养体系也有助于研究小胶质细胞与神经细胞之间的相互作用。因此,大脑类器官与更广泛的支持性非神经细胞的共培养将成为未来的一项研究热点。
人脑皮质沟回形成是其大脑皮层面积远大于啮齿类动物的一个重要原因,沟回的形成与认知能力高度相关。然而,使用当前体系在大脑类器官中通常未观察到明显的沟回结构。有趣的是,最近的一项研究表明,通过激活PTEN-Akt信号转导通路可使大脑类器官中产生类似沟回的褶皱[6]。这表明,进一步的技术改良有望使大脑类器官产生与实际人脑更为相似的结构。
总之,尽管目前大脑类器官培育体系尚存在技术缺陷,也不具有人体天然器官的立体结构及复杂的功能。但不可否认的是,3D大脑类器官模型已为人类研究大脑发育及疾病机制带来了巨大进展,关于大脑类器官的构建及应用研究仍将是未来生命医学领域的关注热点,且应用类器官移植替代药物疗法治愈神经系统疾病依然是未来精准医疗的一个重要发展方向。作为一种新兴的生物培养技术,大脑类器官在研究人脑发育、疾病机制、组织替代疗法以及药物筛选等方面,均有着巨大的研究潜力和应用价值。
[本文相关研究得到国家自然科学基金(81922022, 91849117, 81471301)和国家重点研究与发展计划(2016 YFC1306703)的资助。]
[1]Sato T, Vries R G, Snippert H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 2009, 459(7244): 262-265.
[2]Lancaster M A, Renner M, Martin C A, et al. Cerebral organoids model human brain development and microcephaly. Nature, 2013, 501(7467): 373-379.
[3]Xu M, Lee E M, Wen Z, et al. Identification of small-molecule inhibitors of Zika virus infection and induced neural cell death via a drug repurposing screen. Nature Medicine, 2016, 22(10): 1101-1107.
[4]Raja W K, Mungenast A E, Lin Y T, et al. Self-organizing 3D human neural tissue derived from induced pluripotent stem cells recapitulate alzheimer’s disease phenotypes. PLoS One, 2016, 11(9): e0161969.
[5]Wimmer R A, Leopoldi A, Aichinger M, et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature, 2019, 565(7740): 505-510.
[6]Li Y, Muffat J, Omer A, et al. Induction of expansion and folding in human cerebral organoids. Cell Stem Cell, 2017, 20(3): 385-396. e383.
關键词:大脑类器官 多潜能干细胞 神经系统疾病 ■
