柚籽非脂溶性抗氧化成分提取及鉴定
2020-12-31丘苑新杨静娴马路凯何娣
丘苑新,杨静娴,马路凯,何娣
(仲恺农业工程学院 轻工食品学院,广东 广州, 510225)
柚子中柚籽约占整果重的10.3%[1],一直以来,中医上都会利用柚籽来辅助治疗疝气、肺寒咳嗽、发黄、乳腺增生等症状[2]。柚籽作为采后处理加工环节的主要副产物,由于其苦味,目前仅有少量用作中医药材原料,绝大部分被丢弃。其本身所具有的保健、药用和经济价值尚未引起足够的重视。
柚籽提取物的黄酮、类柠檬苦素、多糖等抗氧化成分及活性的相关研究甚少,绝大部分的研究集中在柚子果肉和果皮中。阳梅芳等[3]、庄远红等[4]研究了柚子中黄酮和总酚的含量,发现不同部位黄酮和总酚的分布差异大,而柚籽中总体上偏低,正是由于柚籽中活性成分的含量较低,因此对柚籽的研究较多的集中在柚籽油中,柚籽油中含有多种不饱和脂肪酸,但提取完柚籽油后的籽粕利用率很低,周强[5]研究了柚皮和柚籽中的活性成分,并仅对柚籽中类柠檬苦素进行了结构鉴定;金海莉等[6]研究了葡萄柚籽提取物对黄牛肉保鲜效果,SAVKIN发现添加了葡萄柚籽提取物的黄牛肉保鲜期延长了2~4 d,说明柚类籽提取物的开发具有一定的应用价值。因此,本研究以梅县金柚的柚籽为原料,通过提取和萃取,获得其不同极性溶剂的分步萃取物,测定不同极性溶剂萃取物的氧化能力和还原能力,利用超高压液相-高分辨质谱联用(ultra high performance loquid chromatography-mass spectrometry,UHPLC-MS)技术快速分析萃取物中有效萃取物的化学成分,以期为开发利用柚籽资源提供一定的技术依据,为开发先导药物提供原料,有效促进柚子产业的健康、可持续发展。
1 材料与方法
1.1 材料与试剂
柚籽,梅州市客家土特产提供;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) ,ABTS]、水杨酸、VC,上海源叶生物科技公司;Na2HPO4、NaH2PO4、铁氰化钾、三氯乙酸、FeCl3、FeSO4、H2O2、过硫酸钾、HCl、无水乙醇、石油醚、二氯甲烷、乙酸乙酯、正丁醇,广州特一生物科技有限公司,以上试剂均为分析纯;乙腈、甲酸,麦克林公司,均为色谱级;对照品柚皮苷、柠檬苦素、黄柏酮、香豆素、阿魏酸(纯度≥98%),成都曼思特生物科技有限公司。
1.2 仪器与设备
TU-1900双光束紫外可见分光光度计,天津凯尔曼丰科技有限公司;Infinite®200 PRO酶标仪,深圳市恩科生物科技有限公司;超高效液相色谱仪,Q-Exactive 型质谱仪,美国赛默飞公司。
1.3 试验方法
1.3.1 柚籽不同极性溶剂分步萃取物的制备
取干燥的柚籽粉碎,经亚临界设备除油,用70%乙醇、料液比1∶20(g∶mL)、水浴温度50 ℃条件下提取6 h,得到乙醇浸膏。取柚籽乙醇提取浸膏,用石油醚、氯仿、乙酸乙酯和正丁醇分步萃取,浓缩冻干得到固体粉末,备用。
1.3.2 柚籽乙醇粗提物及其溶剂萃取物抗氧化活性研究
1.3.2.1 DPPH自由基清除能力测定
参照ZHAO等[7]的方法并作适当的修改。以VC为阳性对照,取20 μL不同浓度的样品和VC于96孔板中,再加入180 μL浓度为150 μmol/mL的 DPPH溶液测定的吸光度值为A1;以蒸馏水为空白此时吸光度值为A0,以20 μL蒸馏水+150 μmol/mL DPPH溶液(180 μL)为对照,吸光度值为A2,用酶标仪在517 nm处测定吸光值。清除率计算如公式(1)所示:
(1)
1.3.2.2 ABTS自由基清除能力测定
参照SAVIKIN等[8]的方法并作适当的修改。取0.4 mL不同浓度的样品溶液于玻璃试管中,加入3 mL ABTS工作液,室温下避光反应30 min,于732 nm处测定吸光值A1,无水乙醇代替ABTS工作液扣除样品溶液的本底吸收,吸收值为A2,用相同体积的样品溶剂代替样品溶液作为对照,吸光值为A0,用VC作为阳性对照,清除率计算如公式(2)所示:
(2)
1.3.2.3 羟自由基清除能力测定
参照ZHAO等[7]的方法并作适当的修改。各测定管中依次加入1 mL的9 mmol/L FeSO4溶液,1 mL的9 mmol/L水杨酸-乙醇溶液,1 mL不同浓度的待测样品溶液,1 mL 0.03%(体积分数)H2O2。混匀后,37 ℃水浴加热15 min后取出,在510 nm测不同样品的吸光值,以VC为阳性对照Ax,设空白对照A0。以蒸馏水代替水杨酸-乙醇为样品本底Ay,清除率计算如公式(3)所示:
(3)
1.3.2.4 总还原能力测定
参照ZHAO等[7]的方法并作适当的修改。在10 mL离心管中依次加入1 mL不同浓度的样品溶液、2.5 mL 0.2 mol/L的PBS缓冲溶液(pH=6.6)和2.5 mL 10 g/L铁氰化钾溶液,50 ℃水浴20 min,向混合液中加入2.5 mL 100 g/L TCA,充分混匀,离心10 min。取上清液2.5 mL,再依次加入2.5 mL蒸馏水和0.5 mL 0.1%的FeCl3溶液,室温下反应10 min测定吸光度值A1,以蒸馏水为空白测定吸光度值A0,在700 nm处测定其吸光值,其总还原力计算如公式(4)所示:
A总还原力=A1-A0
(4)
1.3.3 柚籽乙酸乙酯部位化学成分分析
UHPLC条件:色谱柱Zorbax Eclipse C18(1.8 μm×2.1 mm×100 mm);以0.1%(体积分数)甲酸水溶液为流动相A,以乙腈为流动相B;梯度洗脱:0.0~2.0 min,5% B,2.0~6.0 min,5%~30% B,6.0~7.0 min,30% B,7.0~12.0 min,30%~78% B,12.0~14.0 min,78% B,14.0~17.0 min,78%~95% B,20~21 min,95%~5% B,21~25 min,5% B,流速0.3 mL/min,自动进样器温度4 ℃,色谱柱温度30 ℃。
质谱条件:电喷雾离子源(ESI),选择正、负离子模式同时检测,离子源喷雾电压3.5 kV;鞘气流速45 arb;辅助气流速15 arb;离子传输管温度330 ℃。扫描方式为一级扫描与数据依赖性二级质谱扫描(Full Scan/dd-MS2),一级分辨率120 000,二级分辨率60 000,扫描范围(m/z)100~1 500。
1.3.4 对照品溶液的制备
分别精确称取柚皮苷、黄柏酮、柠檬苦素、阿魏酸、香豆素对照品适量,用乙腈溶解定容至10 mL,经0.22 μm滤膜过滤。
1.4 数据分析
所有数据均平行测定3次。用SPSS 25软件对所有数据进行方差分析(ANOVA)。利用邓肯多重比较法对数据进行显著性分析。利用Compound Discoverer 3.1数据分析系统进行分析。根据二级质谱信息利用Thermo mzCloud在线数据库, Thermo mzValut本地数据库等对物质鉴定。
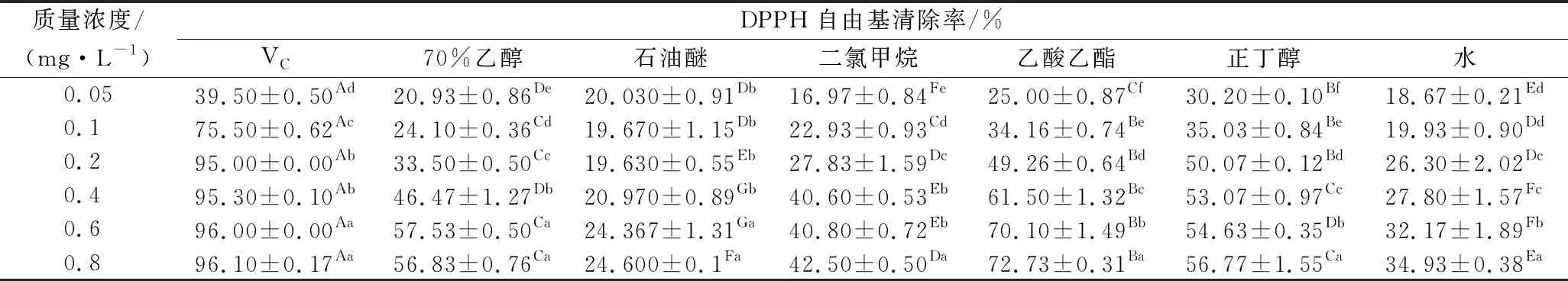
表1 柚籽不同极性溶剂分步提取物对DPPH自由基的清除能力Table 1 DPPH free radical scavenging activity of different polar solvent separate-step extracts from pomelo seed at different concentrations
2 结果与分析
2.1 柚籽不同极性溶剂萃取物抗氧化活性评价
2.1.1 柚籽不同极性溶剂萃取物对DPPH自由基清除能力
由表1可知,柚籽不同极性溶剂不同质量浓度的萃取物对DPPH自由基的清除效果存在显著性差异(P<0.05),且相同质量浓度的不同提取物之间也存在显著性差异(P<0.05)。其中乙酸乙酯萃取物对DPPH自由基的清除率随质量浓度的增加可见明显的趋势,在质量浓度为0.8 mg/mL时清除率为(72.73±0.31)%,其IC50值为0.21 mg/mL,与其他极性萃取物存在显著性差异(P<0.05),但其清除率效果与阳性对照(VC)比较相对较弱。清除效果最差的为石油醚萃取物,且随着质量浓度的增加其清除率增加较慢。其DPPH自由基清除能力顺序为:VC(IC500.04 mg/mL)>乙酸乙酯(IC500.21 mg/mL)>正丁醇(IC500.34 mg/mL)>70%(体积分数)乙醇(IC500.48 mg/mL)>水(IC501.47 mg/mL)>二氯甲烷(IC501.50 mg/mL)>石油醚(IC504.24 mg/mL)。
2.1.2 柚籽不同极性溶剂萃取物对ABTS自由基清除能力
由表2可知,柚籽不同极性溶剂萃取物及VC阳性对照品对ABTS自由基均具有较强的清除作用。当质量浓度为0.05 mg/mL时,VC阳性对照品的清除率为(86.08±0.71)%,与其他萃取物存在显著性差异(P<0.05),但随着质量浓度的增加,其清除率增加相对较快,在质量浓度为0.6 mg/mL时,乙酸乙酯萃取物的清除率为(97.11±0.20)%和VC阳性对照(98.13±0.12)%无显著差异(P>0.05),且其质量浓度在0.4、0.6和0.8 mg/mL时的清除率无明显差异(P>0.05)。石油醚萃取物对ABTS自由基的清除效果最弱,在质量浓度为0.05 mg/mL时清除率仅为(10.30±0.36)%。其ABTS自由基清除能力的大小顺序为:VC(IC500.00 mg/mL)>乙酸乙酯(IC500.03 mg/mL)>正丁醇(IC500.04 mg/mL)>70%(体积分数)乙醇(IC500.06 mg/mL)>二氯甲烷(IC500.13 mg/mL)>水(IC500.21 mg/mL)>石油醚(IC501.08 mg/mL)。
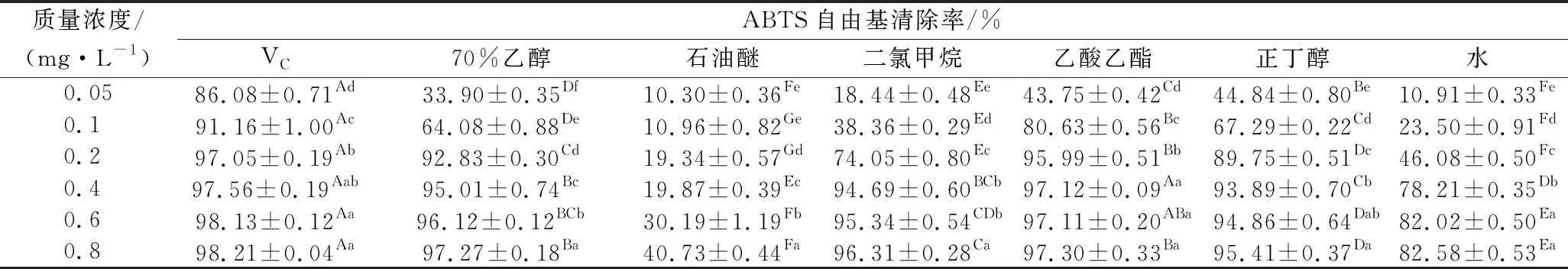
表2 柚籽不同极性溶剂萃取物对ABTS自由基的清除能力Table 2 ABTS free radical scavenging activity of different polar solvent separate-step extracts from pomelo seed at different concentrations
2.1.3 柚籽不同极性溶剂分步提取物对羟自由清除能力
由表3可知,柚籽不同极性溶剂萃取物及VC阳性对照品对羟自由基的清除均有一定的效果。其中VC阳性对照对羟自由基的清除率最高,在质量浓度达到0.8 mg/mL时,其清除率达到(97.44±0.31)%,IC50值为0.12 mg/mL。6组极性溶剂萃取物清除羟自由基的能力均低于VC,且存在显著差异(P<0.05),且质量浓度在0.05~0.4 mg/mL时,其清除率均<50%,随着质量浓度的增加,其清除率增加相对较慢,其中70%(体积分数)乙醇提取物和乙酸乙酯萃取物的清除效果显著高于其他4组(P<0.05),当质量浓度为0.8 mg/mL时,其清除率分别为(54.33±0.89)%和(55.75±0.14)%。其对羟自由基清除能力的大小顺序为:VC(IC500.12 mg/mL)>乙酸乙酯(IC500.60 mg/mL)>70%(体积分数)乙醇(IC500.66 mg/mL)>正丁醇(IC500.95 mg/mL)>二氯甲烷(IC501.74 mg/mL)>石油醚(IC502.12 mg/mL)>水(IC502.79 mg/mL)。
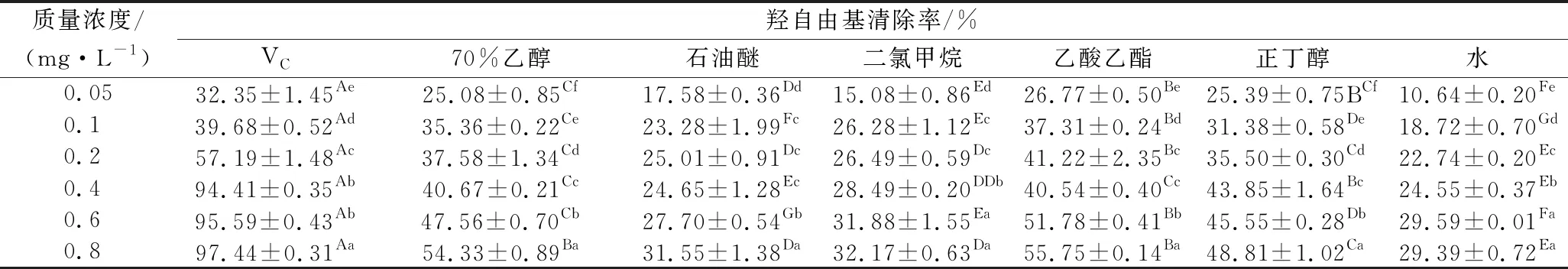
表3 柚籽不同极性溶剂萃取物对羟自由基的清除能力Table 3 Hydroxyl free radical scavenging activity of different polar solvent separate-step extracts from pomelo seed at different concentrations
2.1.4 柚籽不同极性溶剂萃取物总还原能力
由表4可知,柚籽不同极性溶剂萃取物的总还原能力与VC阳性对照相比较差,其中VC阳性对照品的质量浓度在0.4~0.8 mg/mL时,其还原能力已无显著差异(P>0.05),但柚籽不同极性溶剂萃取物的还原能力与浓度明显存在一定的量效关系,且不同极性溶剂萃取物的还原能力差异显著(P<0.05)。其中乙酸乙酯萃取物的还原能力相对较好,当质量浓度在0.8 mg/mL时,其还原能力为0.936±0.011,但其还原能力还是远低于VC阳性对照品。水萃取物的还原能力最差,在质量浓度为0.8 mg/mL时,其还原力仅为(0.193±0.005)。其还原能力的大小顺序为:VC(IC500.02 mg/mL)>乙酸乙酯(IC500.38 mg/mL)>70%(体积分数)乙醇(IC500.50 mg/mL)>正丁醇(IC500.60 mg/mL)>石油醚(IC500.89 mg/mL)>二氯甲烷(IC500.96 mg/mL)>水(IC502.37 mg/mL)。
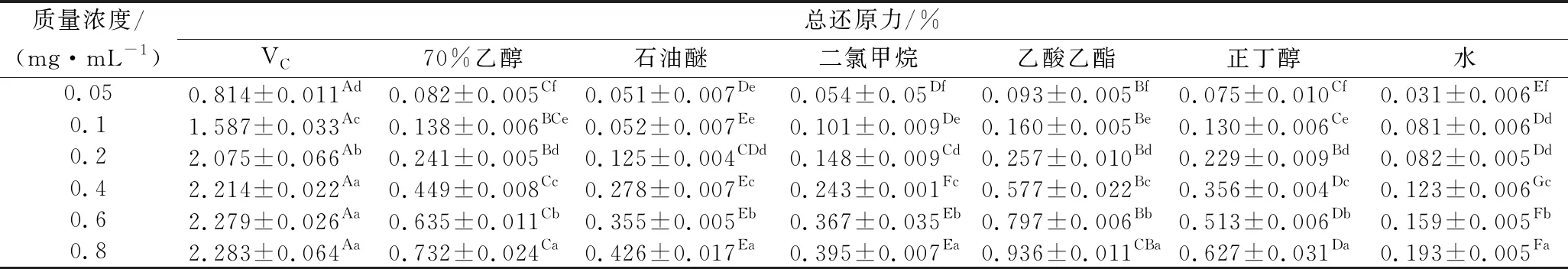
表4 柚籽不同极性溶剂萃取物的总还原力Table 4 Reducing power of different polar solvent separate-step extracts from pomelo seed at different concentrations
2.2 柚籽乙酸乙酯萃取物化学组成
对抗氧化结果分析,乙酸乙酯萃取部位的抗氧化性优于其他5组,故针对乙酸乙酯萃取物进行UHPLC-MS分析。在正、负离子检测模式下,获得样品的总离子流图,共鉴定出33种化合物,其中5种化合物经与对照品比对确认,见图1,化学鉴定结果如表5所示。
2.3 化合物结构鉴定
根据结构鉴定表可知,乙酸乙酯萃取物含有较丰富的黄酮及其苷类、酚类等化合物,此类物质具有较强的抗氧化效果[9-10],对部分化合物进行二级质谱裂解途径分析。其中,黄酮类化合物在植物体内大部分与糖结合,形成苷类或以碳糖基的形式存在,部分以游离的形式存在。其质谱裂解规律主要是失去CO、CO2、C2H2O、H2O 等中性离子,易发生逆狄尔斯-阿尔德(Diels-Alder reaction,RDA)裂解[11]。以山奈酚为例,山奈酚保留时间为7.103 min,在正离子模式下准分子离子峰为m/z287.054 66[M+H]+,推测其元素组成为C15H10O6。其可能的裂解途径见图2,准分子离子峰首先裂解失去中性离子CO,再分别失去C6H6O碎片基团和H2O分子,形成m/z241.049 06[M+H-CO-H2O]+和m/z165.018 26[M+H-CO-C6H6O]+碎片离子,同时,准分子离子峰先后失去C4H4O4碎片基团和H2O分子,产生m/z153.018 25[M+H-C4H4O4-H2O]+碎片离子,随后m/z153.018 25发生RDA裂解,经过数据库检索及结合文献[12-13]报道,主要的碎片离子峰与山奈酚的裂解规律一致,可以推测该化合物为山奈酚。
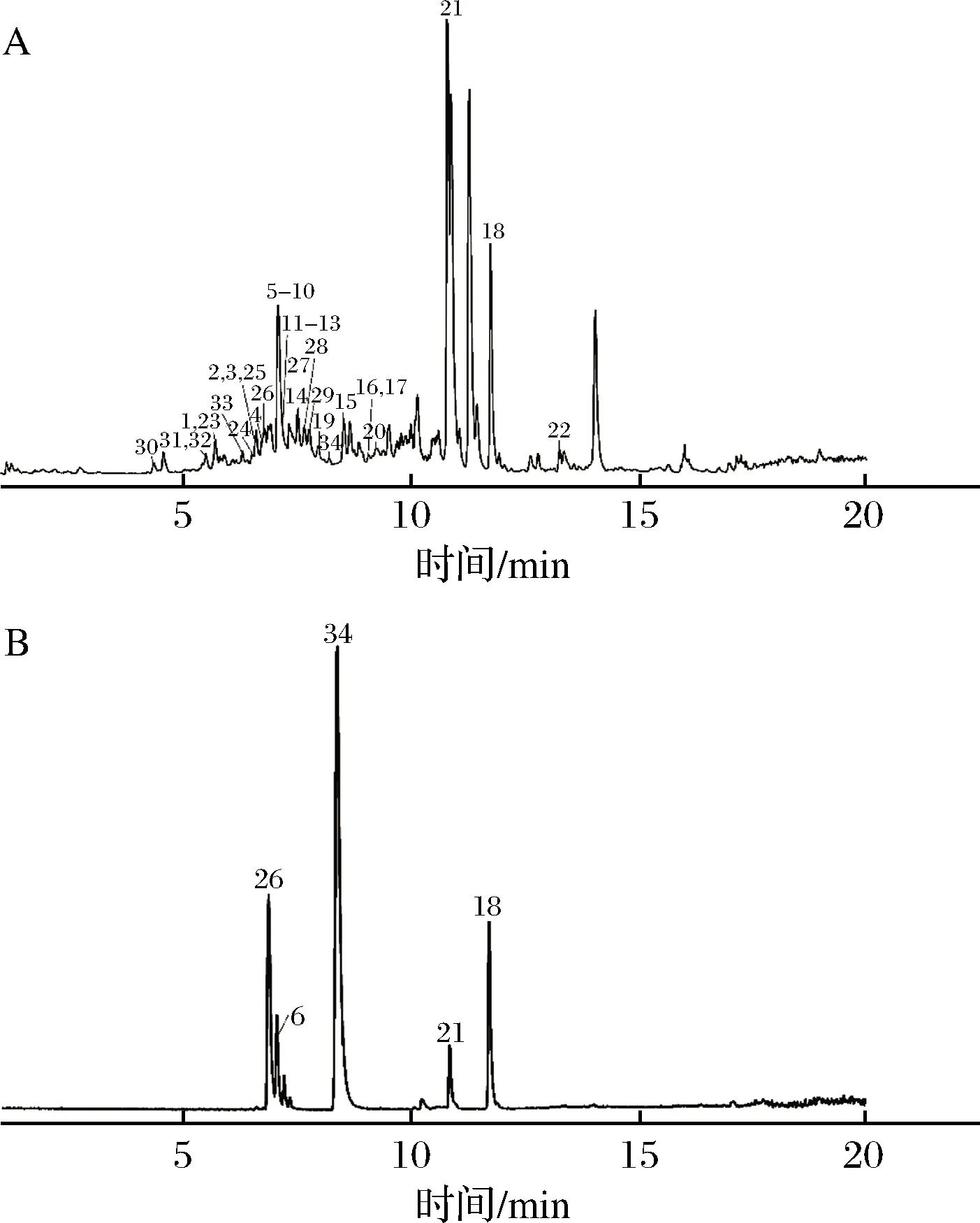
A-乙酸乙酯萃取物;B-对照品图1 正离子模式总离子流图Fig.1 Total ion chromatogram in positive mode注:图中编号物质与表5一致
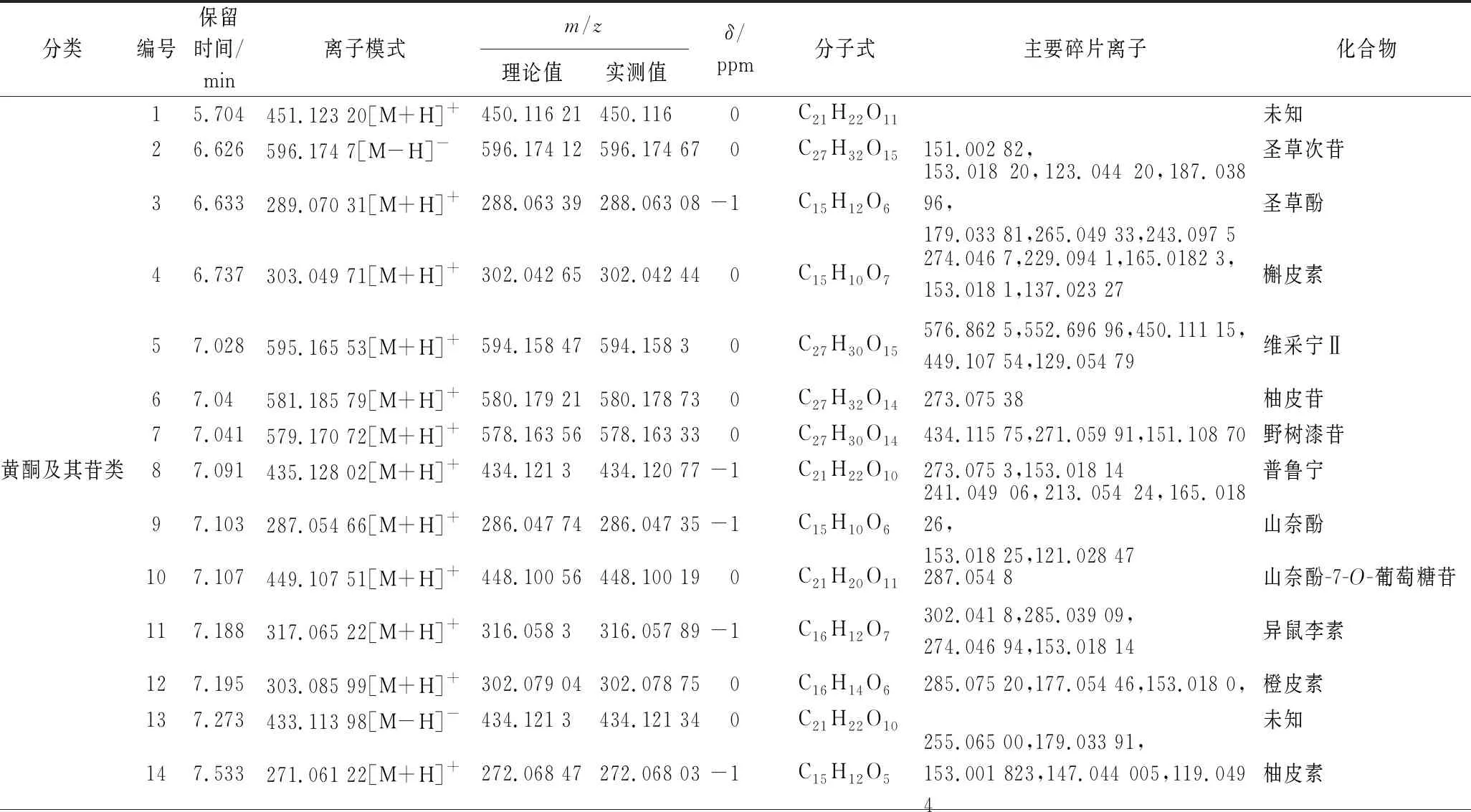
表5 柚籽乙酸乙酯部位化学成分鉴定表Table 5 Identification of chemical constituents in ethyl acetate fraction of pomelo seed
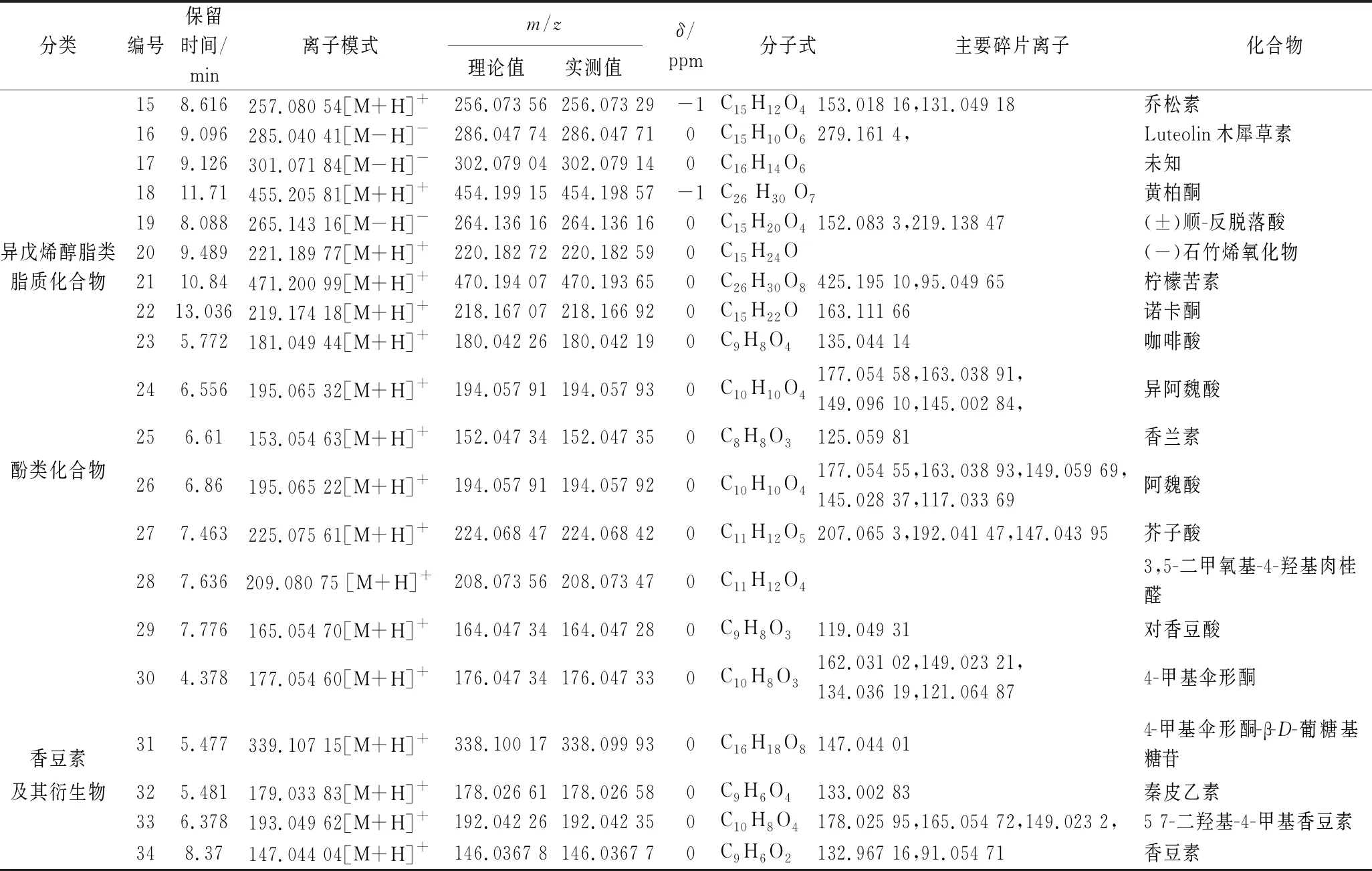
续表5
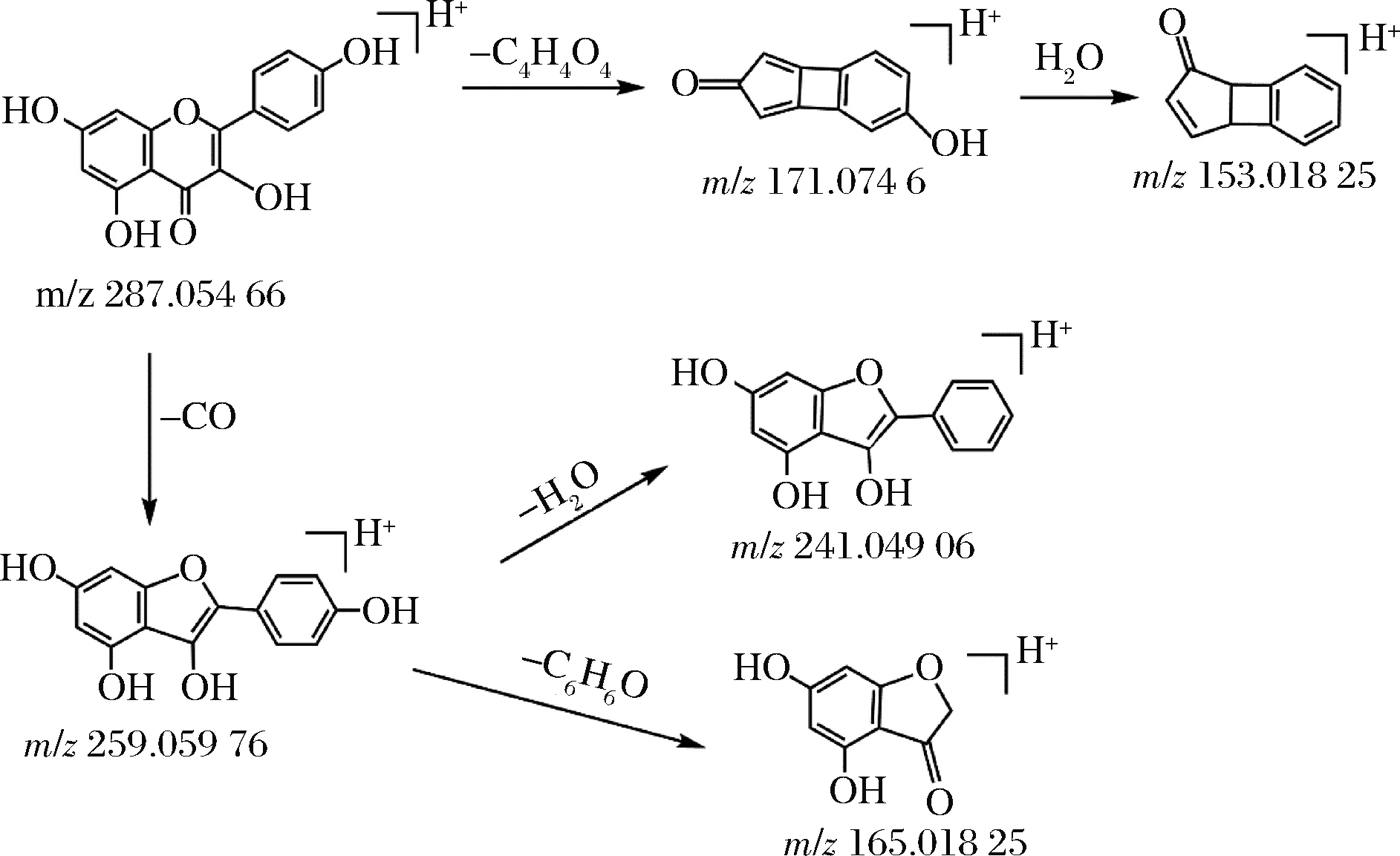
图2 山奈酚可能的裂解途径Fig.2 Possible fragmentation pathways of kaempferol
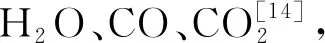
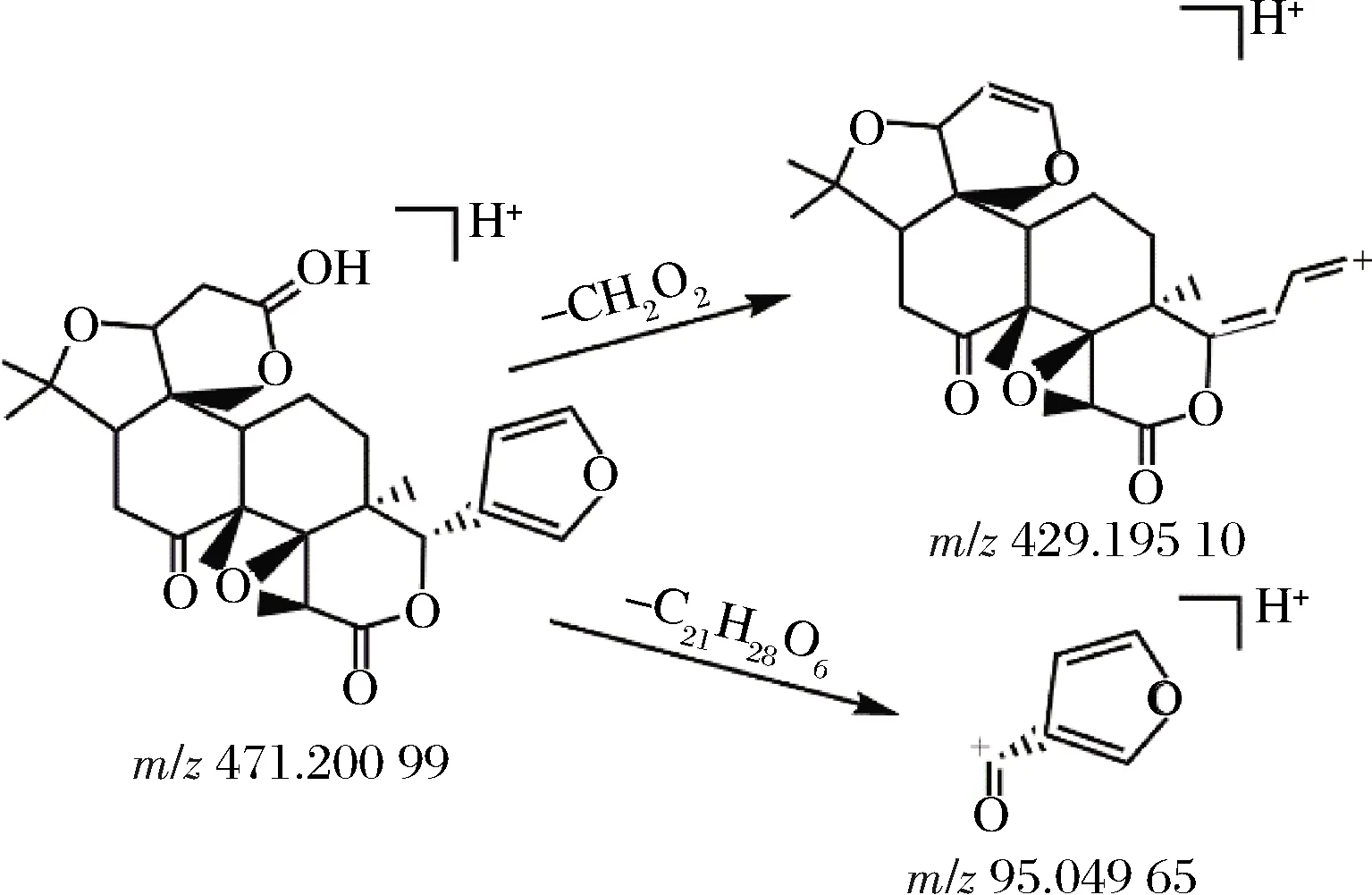
图3 柠檬苦素可能的裂解途径Fig.3 Possible fragmentation pathways of limonin
酚类化合物的裂解规律主要是丢失H2O、HCOOH、CO2等中性分子[16-17]。以阿魏酸为例推测其可能的裂解途径(图4),在正离子模式下得到准分子离子m/z195.065 22[M+H]+,保留时间为6.947 min,预测其元素组成为C10H10O4。准分子离子峰发生裂解,失去H2O分子,形成m/z177.054 55[M+H-H2O]+碎片基团;或失去1分子CH3OH形成碎片m/z163.038 93[M+H-CH3OH]+,继而再失去1分子H2O,形成碎片m/z145.028 37[M+H-CH3OH-H2O]+碎片基团;准分子离子峰裂解或还以失去一分子HCOOH形成碎片m/z149.059 69[M+H-HCOOH]+,再失去1分子CH3OH碎片基团,形成m/z117.033 69[M+H-HCOOOH-CH3OH]+碎片基团。经过数据库检索及结合文献报道[15],主要碎片离子峰与柠檬苦素的裂解规律一致,可以推测该化合物为阿魏酸。
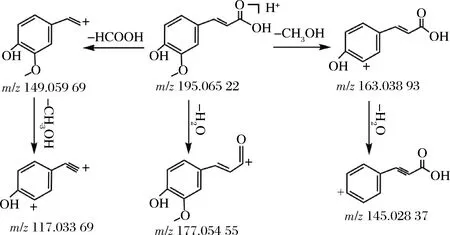
图4 阿魏酸可能的裂解途径Fig.4 Possible fragmentation pathways of ferulic acid
3 讨论
天然抗氧化剂主要来源于黄酮类化合物以及植物酚类[18],从植物中寻找天然的抗氧化剂成为近代科学研究的热点之一。在本研究中,柚籽的6种极性部位萃取物的抗氧化效果均表现出一定的差异,其中,乙酸乙酯萃取物的抗氧化活性优于其他5组,通过液相色谱-质谱联用仪进行成分鉴定发现,柚籽中黄酮的种类较丰富,正负离子模式下共鉴定出17种化合物,根据峰面积的大小,计算其在整个柚籽成分中的相对含量为18.152%。进一步证实柚籽中黄酮类化合物的含量较低,分析其原因可能为自然界中黄酮类物质多数以糖苷元的形式存在[9], 柚皮和囊衣层中黄酮含量较高可能是由于柚皮、囊中含有大量的纤维素,黄酮类物质容易与糖类物质结合形成黄酮苷类,因此在柚皮和囊中起到一定的富集作用,而柚籽中的成分主要为粗脂肪和蛋白质,不利于总酚和黄酮类物质的富集。
从乙酸乙酯萃取物共鉴定出4类具有生物活性的化合物,如黄酮及其苷类化合物、酚类化合物、香豆素类及肉桂酸类,据研究,张华等[19]对15种柑橘果皮种的主要物质进行抗氧化比较,其中咖啡酸、阿魏酸表现出较强的抗氧化活性,圣草酚、圣草次苷具有中等的抗氧化活性;王之路[20]对柚皮苷、普鲁宁和柚皮素3种物质进行抗氧化比较发现,普鲁宁对DPPH自由基具有较好的清除作用,IC50值为(4.09±0.02)mg/mL,柚皮素对ABTS自由基的清除能力较强,IC50值为1.03 mg/mL;已有研究报道[21-24],山奈酚,槲皮素、异鼠李素、诺卡酮、对香豆酸、秦皮乙素等均具有抗氧化活性;本文在柚籽乙酸乙酯萃取物鉴定出的物质中,除包括上述所提到的各种物质外,还有柚皮苷、山奈酚-7-O-葡萄糖苷、柠檬苦素、橙皮素、木犀草素、香豆素等具有生物活性的物质,因此推测柚籽抗氧化活性高的可能原因为各种抗氧化物质协同作用的效果,多种抗氧化功效因子可能通过相互修复再生形成抗氧化还原系统,促进柚籽抗氧化效果的提高。目前国内外对于天然产物中抗氧化成分之间的构效关系、协同作用和拮抗作用等方面仍缺乏系统性的研究,因此柚籽中的各类物质之间的抗氧化活性和相互作用机制还需进一步探讨。
本实验采用UHPLC-MS技术对柚籽成分进行分析,通过质谱数据及已报道的文献[25],对部分化合物进行裂解分析推测,根据其各自的二级特征碎片离子推测了山奈酚、普鲁宁、柠檬苦素及阿魏酸的裂解途径,黄酮类化合物母核质谱裂解通常发生在碳环上,易丢失CO、CO2、C2H2O、H2O 等中性离子,发生RDA裂解;萜类化合物易丢失H2O、CO、CO2;酚类化合物易丢失H2O、HCOOH、CO2等中性分子。
4 结论
柚籽不同极性溶剂萃取物与VC对照品对ABTS自由基具有较强的清除效果,对DPPH自由基和羟基自由基有一定的清除效果,总还原能力相对较弱。其中,乙酸乙酯萃取物对3种自由基的清除能力和还原能力均优于其他5种提取物,但均低于VC对照品。经UHPLC-MS共鉴定出33种化合物,推测柚籽抗氧化效果显著的原因可能为多种抗氧化物质的协同作用,各种抗氧化功效因子在体系中产生游离基相互作用生成新的抗氧化物质,使得抗氧化活性增强。本实验对柚籽提取物中的化合物进行较全面的分析,综上,柚籽提取物具有较好的抗氧化活性,但仍需进一步阐明组成与其抗氧化性之间的关系,明确柚籽中各组分之间可能存在的协同作用。
