急性缺血性脑卒中患者血清成纤维细胞生长因子4水平变化及其与病情严重程度和预后的关系
2020-12-29魏依兰申晓平杜录吕英雷高星窦志杰
魏依兰,申晓平,杜录,吕英雷,高星,窦志杰
承德医学院附属医院,河北承德067000
脑卒中是一种发病率、致残致死率和复发率均较高的疾病,居我国成年人导致残疾和死亡疾病的首位。近年来,随着社会老龄化和城市化进程加快,居民不健康生活方式流行,脑卒中危险因素普遍突显,我国脑卒中发病率呈持续增长状态,疾病负担暴涨,且呈现年轻化趋势,因此对脑卒中的进一步研究仍意义重大[1]。急性缺血性脑卒中是我国最常见的脑卒中类型,占脑卒中比例的69.6%~70.8%[2],其损伤机制多种多样,如血流动力学改变、氧化应激反应、炎症反应、兴奋性氨基酸、血脑屏障破坏等[3]。成纤维细胞生长因子(FGF)是一组家族性结构相关蛋白多肽,大部分家族成员与成纤维细胞生长因子受体(FGFR)特异性结合,参与细胞的增殖、迁移、存活和分化,在机体的生长发育、调整代谢、组织修复再生、炎症反应、神经系统控制等方面发挥重大作用[4]。成纤维细胞生长因子4(FGF4)是属于FGF家族典型旁分泌4亚科中的一员,可通过结合和激活FGFR1c、FGFR2c、FGFR3c、FGFR4来调节生物学效应[5],而目前该亚科研究较少。本研究观察了急性缺血性脑卒中患者血清FGF4的表达水平,并分析其与患者病情严重程度和预后的关系。
1 资料与方法
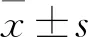
1.1 临床资料 选取2018年11月~2019年3月于承德医学院附属医院神经内科就诊的急性缺血性脑卒中患者 152例作为实验组,其中男102例、女50例,年龄(61.00±12.46)岁;另选取同期于体检中心体检的健康人108例作为对照组,其中男60例、女48例,年龄(62.11±10.93)岁。实验组研究对象均于发病72 h内入院,且符合最新急性缺血性脑卒中诊断标准[2]。实验组纳入标准:①急性起病;②局灶性神经功能缺失(如一侧肢体麻木或无力、口角歪斜等),少数为全面性缺失;③影像学检查出现责任病灶或症状持续24 h以上;④排除出血性卒中;⑤排除非血管性疾病(如低血糖反应)。排除标准:①年龄<18岁;②既往出血或症状性缺血性卒中史;③合并出血转化、先天性心脏病、心肌梗死、严重心肝肾功能不全、严重感染或慢性炎症、代谢或自身免疫性疾病;④近期外伤或手术史;⑤不配合治疗或失访者。两组受检对象年龄、性别、BMI、吸烟史、饮酒史、高血压史、糖尿病史、冠心病史等一般资料具有可比性(P均>0.05)。两组纳入对象均签署知情同意书。
1.2 两组受检对象血清FGF4检测 入院后当日或第二日晨起时,采集两组受检对象空腹肘静脉血3 mL置于采血管中,室温血液自然凝固10~20 min,离心分离血清,采用ELISA法检测血清FGF4。
1.3 血清FGF4水平与急性缺血性脑卒中患者病情严重程度的关系分析 急性缺血性脑卒中患者都在入院时经由2名及以上专业培训的神经内科人员按照美国国立卫生研究院卒中量表(NIHSS)评分,将实验组患者分为轻型脑卒中组(NIHSS≤3分,111例)和非轻型脑卒中组(NIHSS>3分,41例),分析血清FGF4表达水平与急性缺血性脑卒中患者疾病严重程度的关系。NIHSS评分越高提示神经系统功能缺损程度越严重。
1.4 血清FGF4水平与急性缺血性脑卒中患者预后的关系分析 实验组患者持续治疗后14 d后,通过电话或门诊随访的形式按照改良Rankin量表(mRS)评估患者预后状况,根据预后状况将实验组患者分为预后良好组(mRS评分≤2分,118例)和预后不良组(mRS评分>2分,34例),分析血清FGF4表达水平与患者预后的关系。mRS评分越高提示预后不良。
2 结果
2.1 两组受检对象血清FGF4水平比较 实验组血清FGF4表达水平为(257.83±37.11)pg/mL,对照组血清FGF4表达水平为(143.02±47.29)pg/mL,两组相比,P<0.01。
2.2 血清FGF4水平与急性缺血性脑卒中患者病情严重程度的关系 轻型脑卒中组患者血清FGF4表达水平为(244.13±28.43)pg/mL,非轻型脑卒中组患者血清FGF4表达水平为(294.90±32.35)pg/mL,两组相比,P<0.01。Spearman相关性分析结果显示,血清FGF4表达水平与急性缺血性脑卒中患者NIHSS评分呈正相关关系(r=0.816,P<0.01)。
2.3 血清FGF4水平与急性缺血性脑卒中患者预后的关系 预后良好组患者血清FGF4表达水平为(245.62±29.32)pg/mL,预后不良组患者血清FGF4表达水平为(300.19±29.48)pg/mL,两组相比,P<0.01。Spearman相关性分析结果显示,血清FGF4表达水平与急性缺血性脑卒中患者mRs评分呈正相关关系(r=0.647,P<0.01)。
3 讨论
成纤维细胞生长因子家族(FGFs)是一类具有多种生物学活性的多肽生长因子,具有促有丝分裂和细胞存活特性,由22种不同的FGF组成,分子量为17~34 kDa不等,且结构氨基酸之间存在高度同源性[6],需要与FGFR结合后发挥作用。人体内FGFR分为五大类,即由四种高度保守的跨膜受体酪氨酸激酶(FGFR1、FGFR2、FGFR3、FGFR4)和一种能结合FGF配体但缺乏细胞内激酶结构域的受体(FGFR5/FGFRL1)组成[7],其中据不同结构域又细划分为FGFR1b、FGFR1c、FGFR2b、FGFR2c、FGFR3b、FGFR3c、FGFR4、FGFR5[6]。受体和配体结合后,FGFRs二聚化并触发一系列下游信号通路,包括促分裂原活化蛋白激酶(MAPK)通路、信号传导及转录激活子(STAT)通路、磷酸肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)通路及通过磷酸脂酶C-γ激活二酯酰甘油-蛋白激酶C(DAG-PKC)和三磷酸肌醇(IP3)-Ca2+信号分支,发挥胚胎发育、组织恢复、血管生成、细胞存活和凋亡等作用[8]。
FGF4隶属于FGF家族中FGF4亚家族(FGF4、FGF5、FGF6),其基因位于染色体11q13.3位置,分子量较小,可与受体FGFR1c、FGFR2c、FGFR3c、FGFR4相结合,且与前两者结合能力高于后两者[9,10]。FGFR1、FGFR4主要在神经元中表达。FGFR1为大脑中含量较丰富的受体,也可在放射状胶质细胞上表达,是海马和锥体神经细胞生长所必需的。FGFR2位于在少突胶质细胞上,参与祖细胞增殖、学习和记忆。FGFR3于星形胶质细胞中表达,与形成正常的大脑皮层有关[11]。有研究[13]表明,FGF4通过激活PI3K/Akt/p21信号级联反应,促进中枢神经系统损伤后星形胶质细胞向神经干/祖细胞去分化[12]。FGF4可提高神经元分化效率,FGF4联合VEGF-A的基因治疗,可加快血液动力学恢复,增加血管密度,改善缺血组织损伤[14]。
目前脑血管病是造成我国期望寿命损失的首位原因,且呈持续性增长及年轻化趋势。急性缺血性脑卒中的主要治疗方式为一定时间内溶栓治疗,但由于地域等因素限制,大部分患者会错过最佳治疗时机,故开发急性缺血性脑卒中新治疗靶点是一项艰巨的任务。FGFs各成员在多种生理过程中发挥重要作用,但FGF4在脑血管病方面研究较少,本研究旨在探讨FGF4与急性缺血性脑血管病间的关系。本研究结果显示,实验组和对照组基线资料无显著统计学差异,有可比性;血清FGF4在急性缺血性脑卒中患者中高表达,而在健康患者体内低表达,说明FGF4与脑血管病存在一定关系。我们将急性缺血性脑卒中患者入院时按NIHSS划出轻型脑卒中组和非轻型脑卒中组,比较两组血清FGF4表达水平,发现轻型脑卒中组明显低于非轻型脑卒中组;同理,按治疗后mRs评分分组比较,提示预后不良组血清FGF4表达水平高于预后良好组。进一步应用Spearman相关系数分析验证,结果显示血清FGF4表达水平与NIHSS、mRS评分都有正性相关的关系,即FGF4随神经缺损程度、预后等级的升高而升高。
综上所述,血清FGF4水平在急性缺血性卒中患者和健康体检者中不同,前者明显高于后者,且疾病越严重、预后越不良,血清FGF4表达水平越高,这说明FGF4与急性缺血性脑血管病存在相关性,参与疾病的发生发展。但关于FGF4的具体作用机制还有待进一步研究。
