FLASH 放疗技术相关热点分析
2020-12-29张樱子姚升宇陈佳艺
张樱子 姚升宇 陈佳艺 刘 勇
1(上海交通大学附属第一人民医院肿瘤放疗科 上海201620)
2(上海交通大学医学院附属瑞金医院肿瘤放疗科 上海200025)
放射治疗是目前治疗恶性肿瘤的重要手段之一,其原理是通过电离辐射对癌细胞造成损伤,进而导致癌细胞死亡。然而,放疗也会对肿瘤周围的正常组织造成急性和慢性毒性[1-5]。这些辐射诱发的毒性限制了递送至肿瘤的辐射剂量,从而限制了放疗对肿瘤的局控效果。此外,随着肿瘤患者生存期的延长,由放疗引起的迟发性毒性的出现概率逐步增加,严重影响患者的生活质量。因此,如何使其在有效抑制肿瘤的同时降低对周围正常组织的损伤,是临床放疗追求的目标[6]。
几十年来,放射肿瘤学领域一直在寻求物理、化学和生物学方面的创新来提高治疗率。剂量分割(Dose fractionation)、精确成像(Precision imaging)、放化疗(Chemoradiotherapy)以及加速器和计算技术的进步,都有助于提高放疗的治疗指数。然而,相当一部分肿瘤仍对常规放射治疗(Conventional radiation therapy, CRT)具有辐射抗性,而CRT 的剂量是以正常组织的耐受剂量为前提的,这就导致需要进一步探讨放射治疗的新方法来满足临床需要[7-8]。其中,剂量率是影响放射治疗生物疗效的重要因素之一,但还没有得到充分的探索。
FLASH 放疗(FLASH radiotherapy,FLASHRT)是指利用超高剂量率照射所产生的对正常组织有保护作用的机制进行的放射治疗,对于FLASH-RT的剂量率,当前尚无确切的界定值,目前实验研究中所用剂量率大都在40 Gy/s 以上,照射时间一般小于1 s[9]。它和常规剂量率放疗(Conventional dose-rate radiotherapy, CONV-RT)的比较见表1。
1959 年,Dewey 等[10]发现相较于普通剂量率照射,细菌受到大脉冲电子辐射(约100~200 Gy,2 ms 内完成)照射时放射敏感性降低,这是FLASH 效应首次被观察到。1967 年,Town 等[11]报道了在脉冲长度更短的脉冲X 射线照射后获得的细胞存活曲线与在常规剂量率为1 Gy/min的60Co γ射线照射下获得的细胞存活曲线之间的差异。1969 年,Berry 等[12]的研究证明,哺乳动物细胞接受超高剂量率照射比接受常规剂量率照射具有更强的生存能力。1971 年,Hornsey 等[13]发现高剂量率电子束(60 Gy/min 及以上)会引发组织缺氧,进而降低组织的辐射敏感性。尽管20 世纪60、70 年代对FLASH 效应的研究有了一些结果,但未能成功将研究结果向临床应用转化。2014年,Favaudon等[14]进一步发现,小鼠的正常组织和肿瘤组织对超高剂量率照射的差异性反应。FLASH-RT发展史见表2。
近年来,随着FLASH 效应再次受到广泛关注,各国科学家开始重新探索FLASH-RT 的生物学机制及其临床转化的意义和价值,甚至有观点认为,FLASH-RT有望成为通过降低正常组织损伤提高肿瘤控制率的突破性治疗方法。但目前针对FLASH-RT的诸多方面,了解尚十分有限。
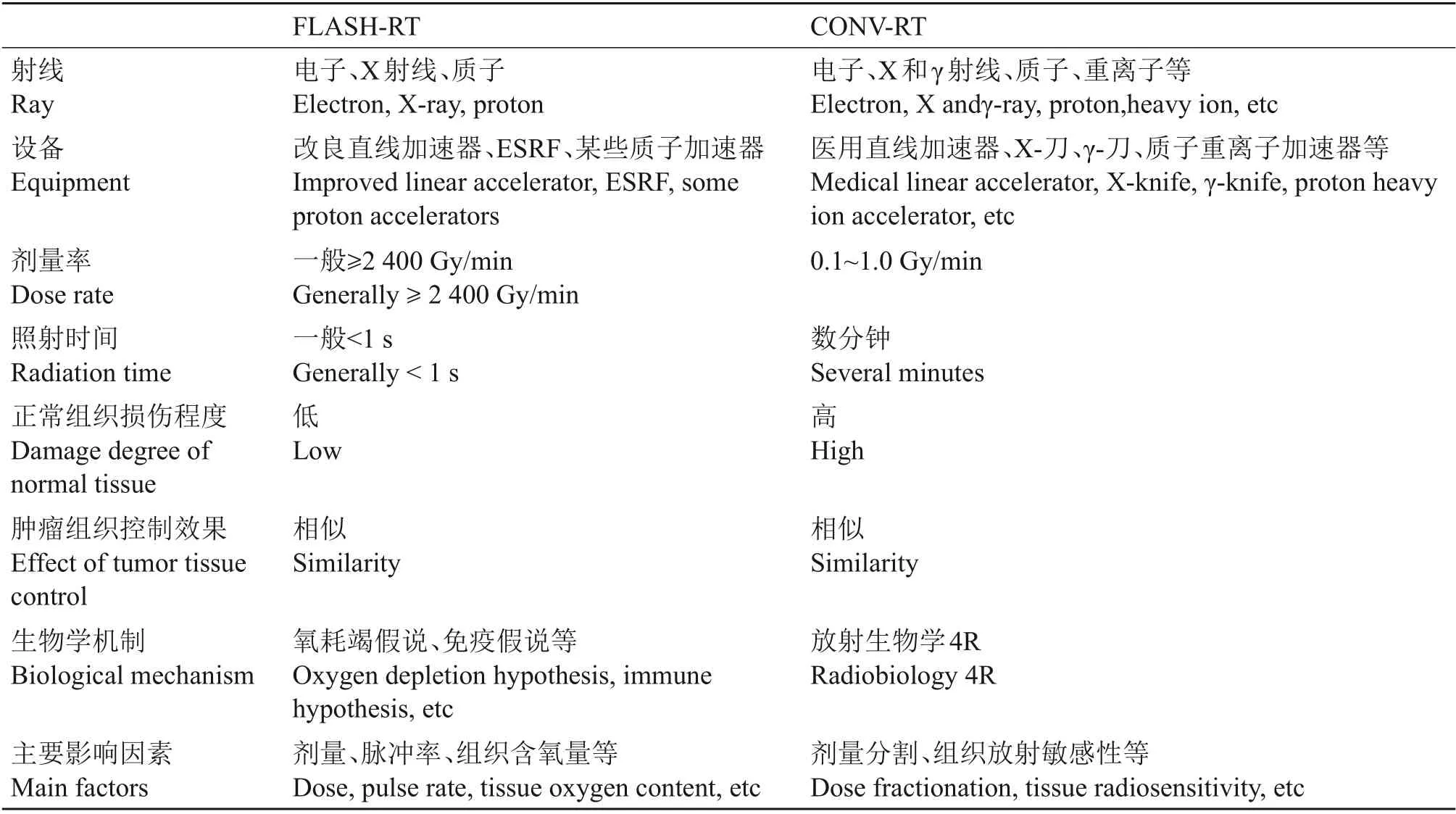
表1 FLASH-RT和CONV-RT比较Table 1 Comparison between FLASH-RT and CONV-RT

表2 FLASH-RT发展史Table 2 Development of FLASH-RT
1 FLASH-RT的临床前研究
尽管FLASH-RT 保护正常组织的特性已经在许多临床前研究中得到了验证,但FLASH 效应的机制仍不明确,在开展FLASH-RT 临床前研究时需要考虑以下问题。
1.1 剂量率影响
与常规剂量率照射(60Co γ 射线,1 Gy/min)比较,早期的FLASH 研究中采用的单脉冲、纳秒级的X 射线照射,瞬时剂量率超过7×108Gy/s[12]。然而目前FLASH-RT 的研究中所提及的剂量率大多是整个照射过程的平均剂量率。Montay-Gruel等[15]在剂量率从0.1~500 Gy/s,用4.5 MeV和6 MeV电子进行全脑10 Gy照射后发现:当剂量率≥30 Gy/s时,神经保护性FLASH效应明显,当剂量率≥100 Gy/s时,诱导出最大的FLASH 效应,但当剂量率低于30 Gy/s 时,神经保护作用消失。据另一项研究[16]报道,与CONV-RT 相比,37 Gy/s 的FLASH-X 射线全脑照射具有更大的记忆保护作用。然而与上述研究结果不同,Venkatesulu 等[20]的研究显示,在35 Gy/s 下 的FLASH-RT 比 在0.1 Gy/s 下 的CONV-RT具有更高的毒性。Smyth等[21]发现相对于CRT,等效剂量的高剂量率(37~41 Gy/s)同步加速器宽束放射治疗(Synchrotron broad-beam radiation therapy,SBBR)不具有正常组织保护作用。以上结果尽管可能受到使用模型、测定方法及研究的终点影响,但也提示FLASH-RT 对正常组织的保护作用可能并不普遍,并且诱发FLASH效应所需的剂量率可能不是通用的。
目前,FLASH-RT的最佳剂量率仍然是一个未解决的问题。Zhou 等[22]假设在FLASH-RT 期间,辐射诱导的正常组织细胞内部的短暂缺氧比CONV-RT 能更好地保护正常组织,然后通过量纲分析超短辐射脉冲FLASH-RT 所需的最小剂量率(Rmin)的数量级。结果表明FLASH-RT剂量率的下限可能非常接近临床前实验的Rmin(>40 Gy/s)。另外,临床上如果用FLASH-RT 治疗深部肿瘤,在对深部组织产生超高剂量率的同时,辐射束轨迹上的正常组织可能接受到较低的剂量率(低于诱导FLASH 效应的最小剂量率)照射,辐射路径上正常组织的损伤也需要认真考虑。
1.2 辐射源影响
目前普遍认为电子线放射治疗中存在FLASH效应,已经在一些小动物模型上得到初步验证,相关的人体实验也在进行中[19]。除电子线外,X射线照射中也观察到了FLASH效应[16],但仍需要进一步研究来确认。鉴于其物理特性,质子束放疗本身对正常组织具有一定的保护作用,质子FLASH 效应可以进一步增加一个额外的正常组织保护功能,起到更好的保护作用。Girdhani 等[17]首次展示在小鼠模型中使用质子FLASH 放疗能够降低正常组织毒性。但是,Buonanno 等[23]发现FLASH 质子照射在体外不能增加正常人肺成纤维细胞的存活率。Beyreuther 等[24]用5 Gy/min 的常规剂量率质子束与100 Gy/s 的质子FLASH 照射斑马鱼胚胎,没有发现任何毒性差异,分析原因可能是辐射的脉冲率影响了FLASH 效果,准连续质子束传输每个微脉冲内的剂量率(≈103Gy/s)比电子FLASH 研究的大脉冲(≈106Gy/s)低几个数量级/秒。因此,FLASH模式下质子的作用有待于进一步检验,目前已有文章讨论了新型质子FLASH 放射治疗系统的设计、实施和体内验证[25],阐明了FLASH放疗研究在质子等离子放射治疗中的重要性及临床意义[26],并且已经在考虑超高剂量率质子束的治疗计划[27]。
1.3 剂量分割和总剂量
目前,临床前FLASH-RT 研究中使用的总辐射剂量存在很大差异。大多数研究以10 Gy或更高的单次分割剂量来调节FLASH-RT。Vozenin 等[18]在使用FLASH-RT 治疗局部晚期鼻部鳞癌的猫时,给予单次剂量高达41 Gy 也未达到最大耐受剂量(Maximum tolerated dose,MTD),在单次25~41 Gy剂量照射下,没有出现剂量限值性毒性(Dose limited toxicity,DLT),正常组织表现出良好的耐受性。Bourhis 等[28]建议采用低分割递送FLASH,其结果表明低分割FLASH 方案在控制小鼠原位脑胶质瘤方面与CONV-RT方案的疗效相同。
另外,在制定FLASH-RT 计划时需要考虑α/β值(α/β 值表示引起细胞杀伤中单击和双击成分相等时的剂量,以Gy 为单位)。α/β 值低的组织(如脊髓、肾、肺、肝、骨和脉管系统等)对分次剂量敏感,在CONV-RT中加大分次剂量,组织晚反应会加重。然而研究发现单次高剂量FLASH-RT可以显著保护正常的肺和脑组织(双侧胸前单次照射16~30 Gy,全脑单次照射10 Gy)[13,15];α/β值高的组织(如粘膜、小肠绒毛细胞和皮肤基底细胞等)对治疗总时间更敏感,缩短总治疗时间,组织早反应会加重。Venkatesulu 等[20]的研究显示,同样单次16 Gy腹腔照射,FLASH-RT(35 Gy/s)比CONV-RT(0.1 Gy/s)更容易诱发急性胃肠道综合症。因此,FLASH-RT的疗效与组织特异性密切相关,具有相当的复杂性。
1.4 实验设计和疗效评估
目前,研究人员更多地关注FLASH-RT 正常组织并发症概率(Normal tissue complication probability,NTCP),而对肿瘤控制概率(Tumor control probability, TCP) 的 研 究 相 对 较 少。Favaudon 等[14]发现FLASH 照射对正常组织与肿瘤有明显的作用差异,随后在高等哺乳动物(猫和小型猪)中得到了验证[18],以上是促进FLASH临床转化的前提。但需要注意的是,该研究[18]是一项单臂试验且队列太小,仅表明FLASH-RT 有效。最近报道的第一位接受FLASH-RT 的人类患者[19]在正常皮肤和肿瘤上均获得了良好的疗效,但这项研究仅在一名患者中进行,仅允许有限比较FLASH-RT 和CONV-RT 之间的差异反应,不能将其视为可将FLASH-RT 成功转化至临床的证据。未来需进行大样本的随机对照试验,来明确FLASH 放疗的临床效果。此外,迄今为止的研究大多仅调查了辐射的早期影响,其远期效果尚存在不确定性。评估NTCP需要相当长的时间,TCP的评估时间也建议随访1年以上,这将有利于观察FLASH-RT后存活和缓慢进展的肿瘤干细胞对晚期复发的影响。
2 FLASH-RT的技术
技术驱动在放射治疗的持续发展中具有举足轻重的作用,FLASH-RT 也不例外。有关FLASHRT 临床转化的争议点归根结底也是FLASH-RT 的技术问题,目前尚存在诸多技术瓶颈。
2.1 变量难控
剂量率是FLASH-RT 研究的关键变量,但是以很高的剂量率进行剂量测定非常复杂,研究人员曾比较了4 种不同的技术:电离室(Ionization chambers)、辐射变色膜(Radiochromic films)、热释光剂量计(Thermoluminescent Dosimeter,TLD)和丙氨酸沉淀(Alanine pellets)[29-31],但数据分析具有差异性。
另外,在FLASH 研究中需要创建与传统射束匹配的FLASH 射束,但仅通过改变一个变量(剂量率)是十分困难的。在Favaudon 等[14]的研究中,患有肺肿瘤的小鼠在常规组中使用137Cs光子,在FLASH 组中使用4.5 MeV 电子,后者表现出较低的肺毒性。然而,137Cs光子在肿瘤外传递更高的剂量,而4.5 MeV电子在小鼠体内具有更低的表面剂量和更高的中心剂量,很难解释这种差异是由物理还是生物因素引起的。
2.2 技术受限
部分学者认为FLASH-RT 的普及在可预见的将来存在困难。目前FLASH-RT 的临床前研究大多使用低能电子,但是只有极少数的系统能够在FLASH 治疗所需的场大小和所需的剂量率下提供低能电子束,传统的临床直线加速器可以改装产生剂量率超过200 Gy/s的电子束,但它们的剂量测定和几何特性仅适用于小动物实验,且仅可用于治疗浅表肿瘤。为了治疗深部肿瘤,需要开发FLASH-高能电子(VHEE)或FLASH-X 射线或FLASH质子装置。但提供FLASH-X射线的加速器的功率应至少是产生FLASH 电子所需功率的100倍,并且产生光子的转换靶应具有抵抗巨大瞬时功率的特殊特性,这些都是巨大的技术挑战[28]。目前,针对深层肿瘤的FLASH 放疗临床前试验只能使用质子束进行。但用质子束治疗肿瘤,需要对射束进行散射或扫描以覆盖目标体积,Bragg峰中LET 的增加或光束的散射/扫描可能会降低剂量率,进而影响FLASH效应[27]。
另一方面,目前还没有与CONV-RT 类似的高精度传输技术来确保FLASH 光束和治疗目标对准,因此需要考虑与超快速释放FLASH-RT 相关的潜在风险。FLASH-RT包括传送有限数量的脉冲(≤10个脉冲),使用剂量监测和停止系统,能够逐脉冲监测脉冲剂量,以实现安全递送。目前只有个别高能物理实验室(如瑞士洛桑大学附属医院放射物理研究所)采用高速探测器、快速信号采集和处理技术来控制的大型粒子加速器,适用于FLASH-RT系统。另外,多叶光栅叶片运动速度的限制也无法做到快速的FLASH 强度调制,要达到亚秒级的强度调制需要开发新技术。
2.3 成本效益
因为目前低收入和中等收入国家的放射治疗需求最高[32],现阶段的FLASH-RT 可能与全球需求不兼容。最新研究表明,科学家尝试将传统的X射线管(使用160 kV X 射线束)用于FLASH-RT研究[33]。斯坦福大学的Schüler 等[30]最近发布了一种程序,将临床直线加速器改造成能够提供FLASH-RT的辐照器,剂量率超过200 Gy/s,初步结果显示了对小鼠肠道的保护作用[34]。以上技术如果成熟,将有力促进FLASH-RT的推广。
2.4 设备问题
迄今为止,通过对现有辐照系统的改进,对于小动物和大动物体表小靶区进行临床前FLASH辐照是可能的,这些设备的改良包括Varian直线加速器[30]、Elekta 直线加速器[35]、Oriatron eRT6 原型直线加速器[36]、欧洲同步辐射光源(ESRF)[16]和某些质子加速器[22,37]等。
Maxim 等[38]提出了多向高能敏捷扫描电子放射疗法(PHASER)概念。PHASER是一个既可以解决极高能量电子(VHEE)束的尺寸和稳定性问题,又可以产生6~10 MV FLASH X 射线光束的平台。该概念中还包括一种新颖且快速的图像引导技术。关于PHASER 的成本效益、紧凑性、功率效率和经济制造都是设计时需要考虑的关键因素,预计总体成本与传统直线加速器类似,这可能是将FLASH 引入临床的理想方法。最近Diffenderfer等[25]设计并通过剂量学验证了一个FLASH质子放疗系统,该系统可在毫秒级的时间内精确控制光束通量,并在线监控积分和剂量输送时间结构。这项研究以立体定向肺照射为范例,系统研究了质子FLASH计划的剂量率分布和递送时间。
3 FLASH-RT生物学机制问题
放射生物学机制是推广FLASH-RT 临床应用的基础,但迄今为止,大部分实验仍处于初步或未公开状态,其机理尚未明确,可能的机制包括耗氧假说、免疫假说和活性氧自由基。
3.1 耗氧假说
快速耗氧一直被认为是FLASH 对正常组织保护作用的潜在机制。用FLASH-RT 照射组织会导致放射化学氧耗竭,从而被照射的组织内出现极为急性的缺氧期,并因此产生短暂的辐射抗性[39]。氧气的作用是调节FLASH 效应的一个主要变量,也是评估FLASH 效应的关键物理参数。已有证据表明,许多正常组织在低生理氧合水平下能够维持少量细胞群的持续更新/再生[40]。Pratx 等[41-42]认为FLASH 照射的辐射防护作用可能是由正常组织中缺氧干细胞壁龛(骨髓和脑在内的多个器官中)的特异性保留引起的,即提出了一种新的FLASH 照射过程中放射性氧消耗、氧扩散和补充的模型。然而,耗氧假说很难解释相对于CONVRT,FLASH-RT 如何维持肿瘤反应。因为尽管肿瘤与正常组织相比乏氧程度高,但大多数并非完全缺氧[43]。FLASH-RT 之后,肿瘤组织内也会产生氧的放射化学耗竭,因此也会导致肿瘤的辐射抗性。Adrian 等[44]使用与生理相关的氧气浓度(相对分压在1.6%~20%)进行了体外研究,结果表明FLASH 效应取决于氧气浓度,对于低氧前列腺癌细胞(1.6%),FLASH 照射的存活率显著提高。尽管如此,现有的研究表明FLASH-RT 能够维持与CONV-RT相似的抗肿瘤反应[28,45],甚至在某些情况下,FLASH-RT 的抗肿瘤反应可能优于CONV-RT[46],其详细原理目前尚不清楚,有待于进一步研究。
考虑到FLASH-RT 引起的任何缺氧的短暂性,直接测量FLASH 照射后组织中任何潜在的氧气通量变化都是极其困难的。Petersson 等[47]的研究为耗氧量提供了一个可靠的定量模型以了解FLASH放射疗法的生物学效应,并且与FLASH 效应的一系列实验观察结果兼容。该模型表明,只有在中等氧浓度的情况下,氧水平才能耗尽足以影响放射敏感性的量,而在高氧或极低氧水平下则没有效果。因此,各种正常组织的生理性轻度缺氧是理解FLASH效应的基础,未来FLASH研究的关键是要考虑辐照时的相关氧张力,以及适当的计算机模拟,以帮助理解其相关的物理化学机制。
3.2 免疫假说
免疫调节也可能是FLASH 效应的一种潜在机制。Girdhani等[17]发现与CONV-RT相比,在临床前小鼠模型中使用质子FLASH-RT 可以降低正常组织毒性,随后进行的全基因组微阵列分析显示,FLASH-RT后的小鼠免疫系统广泛的激活和成熟受到抑制。Rama 等[46]发现FLASH 质子辐射改善了肺肿瘤的控制,这可能是CD3+T 淋巴细胞向肿瘤内募集的结果。在几项研究中,用免疫受损的动物来比较FLASH-RT 和CONV-RT 的治疗效果,但未观察到肿瘤反应的差异[6,13,16,48]。目前任何将免疫作用与FLASH 效应联系起来的证据都是相关性的,而不是因果关系的,尚不清楚以FLASH 照射后是否有任何不同的免疫反应会导致FLASH 效应。TGF-β在放疗的免疫刺激效应中起着至关重要的作用。TGF-β也被发现是T细胞上调和保护瘤内T细胞免受辐射影响的关键因素,照射后的肿瘤内T细胞可介导肿瘤的控制[49]。Vanpouille-Box等[50]发现,当抗TGF-β 与放疗结合时,放疗可作为原位疫苗。Favaudon等[14]发现常规肺照射后,TGFβ 增加,而在FLASH-RT 之后没有看到这样的激活。此外,Venkatesulu 等[20]发现FLASH-RT(35 Gy/s)不能保护小鼠心脏和脾脏照射后的免疫细胞,分析原因除了剂量率可能不够高外,还可能与肿瘤微环境中的T 细胞/组织驻留记忆T 细胞比循环/淋巴组织T 细胞更耐辐射有关。鉴于以上,FLASHRT后的免疫应答是否影响FLASH效应需要进一步探讨[51]。
3.3 活性氧自由基
Montay-Gruel 等[52]的研究表明,超高剂量率的耗氧会通过限制活性氧(ROS)的产生来促进对正常组织的保护。以FLASH-RT 或CONV-RT 照射氧浓度为4%的水(模拟生理氧气张力),FLASH照射后的水溶液中的H2O2浓度明显降低。Spitz等[53]认为FLASH效应与自由基的瞬时产生以及正常组织和肿瘤组织的氧化还原和自由基化学的固有差异有关。他们假设,与正常组织相比,肿瘤中氧化还原活性铁(即不稳定铁)的含量更高,正常组织与肿瘤组织之间的氧化代谢存在差异,而正常组织中由过氧化链反应产生的有机氢过氧化物和自由基的清除和衰变更快,因此对正常组织具有保护作用。
4 总结
综上所述,尽管FLASH-RT 具有独特的技术魅力,目前已有的数据似乎支持FLASH-RT 临床应用,但还存在一些问题如:(1)FLASH 研究需以剂量率作为单一控制变量进行,同时全面评估并量化其影响(包括短期疗效和远期影响),进一步确定FLASH 效应在X 射线和质子放疗中稳定性与可重复性;(2)开发高效且高性价比的FLASHRT技术,能有效推动FLASH技术迅速且大规模地应用于临床,使癌症患者受益;(3)目前FLASH效应的生物学机制已有很多猜测,如耗氧假说、免疫假说等,阐明FLASH 效应的潜在机制能够帮助和指导FLASH-RT 安全可靠地发挥作用。这些问题的解决对其临床推广至关重要。
总之,FLASH-RT有望成为放射治疗技术革新的范例,并大幅度改善治疗指数。但鉴于其技术的复杂性与疗效的不确定性,进一步深入探讨其生物机制是推广其临床广泛应用的前提。
